纳米颗粒物对肺表面活性物质界面性质的影响
刘 丹,李 杰,曹 妍,耿迎雪,柴小龙,蒋凡殊,师伟萌,赵 群,田森林
纳米颗粒物对肺表面活性物质界面性质的影响
刘 丹,李 杰,曹 妍,耿迎雪,柴小龙,蒋凡殊,师伟萌,赵 群*,田森林*
(昆明理工大学环境科学与工程学院,云南 昆明 650500)
以纳米二氧化硅、纳米碳粉、纳米氧化锌、纳米氧化铈、纳米碳化硅和纳米四氧化三铁等纳米颗粒物(NPs)为代表,研究其对肺表面活性物质(PS)界面性质的影响.结果表明,NPs对PS中的磷脂和蛋白组分均有吸附作用,其中纳米二氧化硅和纳米四氧化三铁分别对磷脂和蛋白组分的吸附能力最强,吸附率为89.3%和82.5%.NPs的存在会导致PS溶液的表面张力升高,这当中纳米二氧化硅的效果最为显著.纳米碳化硅和纳米二氧化硅等颗粒物会引起PS膜的π-A等温线的内缩/外扩,且颗粒物浓度越高,表面压力变化越明显.此外,PS也会对NPs的水合动力学直径和Zeta电位产生影响,导致其分散状态变化.由此可见,NPs可通过改变PS的组成和界面性质而具备危害人体健康的潜力.
纳米颗粒物;肺表面活性物质;界面化学性质;吸附作用;肺健康
纳米颗粒物(NPs)作为粒度小于100nm的微粒,由于其独特的理化特性而被广泛应用于电子、食品、建筑、纺织、医疗器械和药物等领域[1].近年来,其暴露所带来的环境和健康问题逐渐引起了人们的关注[2-3].呼吸暴露是NPs人体暴露的主要途径,由于粒径小、重量轻,NPs极易通过呼吸作用进入肺部,甚至在肺泡中沉积[4].而一旦到达肺泡区,吸入的NPs首先会与肺泡内衬层的肺表面活性物质(PS)液膜相接触[5-6].PS主要是由脂质(85%~90%,主要为二棕榈酰磷脂酰胆碱)和表面活性蛋白(10%)组成的复合物[7-8].它以薄膜的形式覆盖在整个呼吸道的表面,在降低肺泡表面张力,维持肺泡稳定和机体防御等方面发挥着至关重要的作用,是维持正常呼吸必不可少的关键组分[9-10].特殊的脂蛋白体系和界面化学性质是PS功能的基础[11].
由于比表面积大[12]和吸附能力强[13]的特性, NPs在接触到PS后,可能会吸附PS中的活性组分,这将会改变PS的组成体系,导致其结构和功能的异常,干扰PS的界面化学性质[14],进而诱导呼吸疾病的产生.研究发现[15]细颗粒物的添加会使肺泡灌洗液中磷脂浓度降低.当大鼠吸入石英、二氧化硅、二氧化钛和碳化硅等颗粒物时,将会对灌洗液中脂质和蛋白质含量产生显著影响.大量的毒理学研究虽已证实NPs暴露不仅与肺功能降低有关,也可诱发肺部炎症、肺纤维化和肺损伤等肺部疾病的产生[16-17].然而,NPs暴露与肺功能下降之间的因果关系仍缺乏足够的物理和化学证据.
因此,鉴于以往生理学、毒理学等领域在评估NPs暴露与人体健康效应难以全面认识物理化学作用机制的问题.本文通过体外实验,采用界面化学的方法考查NPs暴露对PS的气-液界面化学性质的影响.以提取的动物源肺表面活性物质为PS模拟物,以纳米二氧化硅、纳米碳粉、纳米氧化锌、纳米氧化铈、纳米碳化硅和纳米四氧化三铁为NPs的代表,主要探究了NPs对PS中的活性组分(磷脂和蛋白组分)的吸附作用,研究了NPs对PS表面张力、相行为等界面化学性质的影响,并通过布鲁斯特角显微镜(BAM)对存在/不存在NPs时PS膜的微观结构进行了表征,进一步研究了PS及其活性组分对NPs分散状态的影响,以期更加深入地了解NPs暴露对天然PS界面行为不利的物理和化学效应以及NPs对肺潜在的毒性作用.
1 材料和方法
1.1 药品与试剂
天然的PS从屠宰场获得的猪肺泡灌洗液中获取,提取过程参照Bernahard[18]的方法,将生理盐水反复灌入新鲜猪肺得到肺泡灌洗液,然后再将灌洗液经过滤、离心、氯仿萃取、浓缩、乙酸乙酯沉淀、冻干等处理过程得到白色蜡状PS产物;二棕榈酰磷脂酰胆碱(DPPC,纯度³99%)购自Sigma公司;牛血清蛋白(BSA,纯度98%)购自北京百灵威科技有限公司;纳米SiO2(直径:(50±5) nm,纯度99.99%)、纳米碳粉(NCPs,直径:30nm,纯度95%)购自麦克林试剂有限公司;纳米ZnO (直径:(50±10) nm,纯度99.5%)、纳米CeO2(直径:20~50nm,纯度99.5%)、纳米SiC (直径:40nm,纯度99.99%)、纳米Fe3O4(直径:20nm,纯度99%)均购自阿拉丁试剂有限公司;氯化钠、二氯甲烷、三氯甲烷、六水合三氯化铁和硫氰亚铁铵均为分析纯,购自成都市科龙化工试剂厂;蛋白检测试剂盒(考马斯亮蓝)购自南京建成生物工程研究所;实验用水均为超纯水.
1.2 NPs对PS活性组分的吸附
在40mL的顶空瓶中分别加入18mL的PS溶液(原浓度200mg/L)和2mL 的BSA溶液(表面活性蛋白的代表,原浓度50mg/L),为接近肺内PS的组成情况需确保混合液中磷脂与蛋白组分的比例为9:1[19-20].此外,鉴于NPs潜在的累积效应,选取0.1g/L暴露浓度进行了吸附实验,即在混合液中加入0.002g NPs混均.将顶空瓶密封并置于恒温摇床中,在(37±0.5)℃下以(120±5) r/min的速度振荡48h.再在(37±0.5)℃下以3000r/min离心20min,最后再静置3h.
磷脂含量测定: 依据硫氰亚铁铵与脂质反应会生成溶于氯仿的有色复合物的原理,对磷脂进行定量分析.移取5mL上清液,再加入5mL的氯仿和2mL的0.1mol/L的硫氰亚铁铵溶液,混均1min后在室温下3000r/min离心2min,抽取3mL下层氯仿溶液,用紫外分光光度计测定其在470nm处的吸光度值.
蛋白质含量测定: 通过考马斯亮蓝法进行蛋白含量的测定.移取上清液1mL再加入2mL蛋白显色剂溶液,混均15min后在紫外分光光度计上测定595nm处的吸光度值.
将上述测定的吸光度值代入相应的标准曲线(表1)即可求得溶液中磷脂和蛋白的含量,进一步通过公式(1)可计算出NPs对磷脂和蛋白的吸附量.

表1 磷脂和蛋白组分测定的标准曲线
注:为表面活性组分在盐水溶液中的真实浓度(mg/L);为表面活性组分的吸光度值.
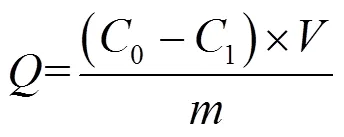
式中:0和1分别表示PS的初始和平衡浓度,mg/L;为磷脂和蛋白的吸附量,mg/g;为NPs的质量,g;为溶液的体积, L.
1.3 表面张力实验
在20mL的50mg/L的PS溶液中加0.002g NPs,配制成颗粒物浓度0.1g/L的悬浮液,在(37±0.5)℃下,以(120±5) r/min振荡 48h,再在37℃下以3000r/min离心20min,静置3h后取上清液用Wilhelmy板法测定表面张力.
1.4 表面压力-面积(π-A)等温线
通过Langmuir-Wilhelmy膜天平对存在/不存在颗粒物时PS的π-A等温线进行测量.亚相溶液为超声分散30min后的包含不同NPs浓度的生理盐水悬浮液.
将260mL的亚相溶液(37±0.5)℃倒入液槽中,然后用微量进样器将30μL的储备膜液(1g/L的PS的氯仿溶液)均匀的滴加在亚相溶液的表面,静置20min,待氯仿完全挥发,然后调节滑障速率为15mm/min进行对称压缩,压缩至液槽表面积剩余10%,同时设备将自动记录表面压力随液槽表面积的变化曲线(即π-A等温线).此外,以纳米SiC和纳米SiO2为NPs的代表,进一步考查NPs浓度的变化对PS的π-A等温线的影响.
1.5 表面压力-时间(π-t)等温线
按照1.4所述的实验过程,待氯仿完全挥发后,将设备调成π-t模式,分别将SiO2和SiC存在下的初始表面压力设置为5和30mN/m,当压缩到表面压力设定值时设备将自动停止,然后设备将自动记录表面压力随时间的变化曲线,也即π-t等温线.为了更加直观的观测颗粒物对PS膜微观结构的影响,通过BAM对气-液界面处的PS膜进行了观测[21].
1.6 粒径分布及Zeta电位分析
将0.0002g NPs分别加入到20mL的生理盐水溶液和40mg/L的PS各活性组分溶液(PS、DPPC和BSA)中,控制NPs的含量为10mg/L.将样品溶液超声处理30min,多次过滤后分别经由动静态光散射仪和Zeta电位分析仪测定NPs的粒径分布和表面电位.
1.7 数据处理
每组实验均做空白和平行实验,以保证实验结果的准确性.本文采用空白(0.9% NaCl)为对照,且每组实验至少测量3次以保证其重复性,误差线表示95%的置信水平(=3).所有实验数据均采用Origin 9.0和Microsoft Power Point软件处理并作图,结果以均值±标准误差(mean ± SE)的形式表示.
2 结果与讨论
2.1 NPs对PS中活性组分的吸附
磷脂和特异性蛋白作为PS的主要活性组分是其发挥正常生理功能的基础.由于NPs特有的强吸附性能,当与PS相接触后可能会吸附PS中的活性组分,这也是NPs能对PS界面性质产生影响的根本原因.因此,在此探究了几种典型NPs对PS中磷脂以及蛋白组分的吸附作用.如图1(a)所示,各种NPs对PS中的磷脂组分均呈现一定的吸附作用,吸附能力的大小为:SiO2> SiC > NCPs > ZnO > SnO2> Co3O4> Fe3O4> CeO2,其中纳米SiO2对磷脂组分的吸附作用最强,吸附率高达89.3%.鉴于磷脂组分在PS界面化学性质中所起到的作用(降低肺泡气–液界面的表面张力)[22],NPs的吸入可能会导致PS界面化学性质的异常,这将在表面张力部分进行讨论.从图1(b)也可以看出,NPs对蛋白组分都有一定的吸附能力,吸附作用的顺序为:Fe3O4> ZnO > SiO2> SiC > NCPs > SnO2> Co3O4> CeO2,其中吸附蛋白能力最强的是纳米Fe3O4,吸附率为82.5%. PS中表面活性蛋白的含量虽然较少,但其对于保持PS膜的机械稳定性,以及机体防御具有重要意义[23].由此可以推断,除了颗粒物本身能促进和产生活性氧物质,NPs对蛋白组分的吸附作用也可能是其诱发机体炎症反应的一个重要原因.

2.2 NPs对PS表面张力的影响
PS的低表面张力特性是其发挥生理功能的基础,而维持PS的界面化学特性对于正常的呼吸功能具有重要的意义[24].因此,探究NPs暴露对PS溶液表面张力的影响很有必要.在图2中,当NPs浓度为0.1g/L时,PS溶液的表面张力都呈现升高的现象,其增加的顺序为:SiO2> SiC > NCPs > SnO2> ZnO > Co3O4> Fe3O4> CeO2,这与图1(a)中NPs对PS中磷脂组分的吸附能力相一致,进一步验证了磷脂是PS中降低表面张力的最关键组分.可见,NPs的吸入会导致肺泡内PS表面张力的升高,鉴于正常呼吸功能与PS表面张力的密切关系,长时间暴露在富含NPs的环境中不仅会干扰正常的呼吸功能,也可能加剧呼吸系统疾病的产生.
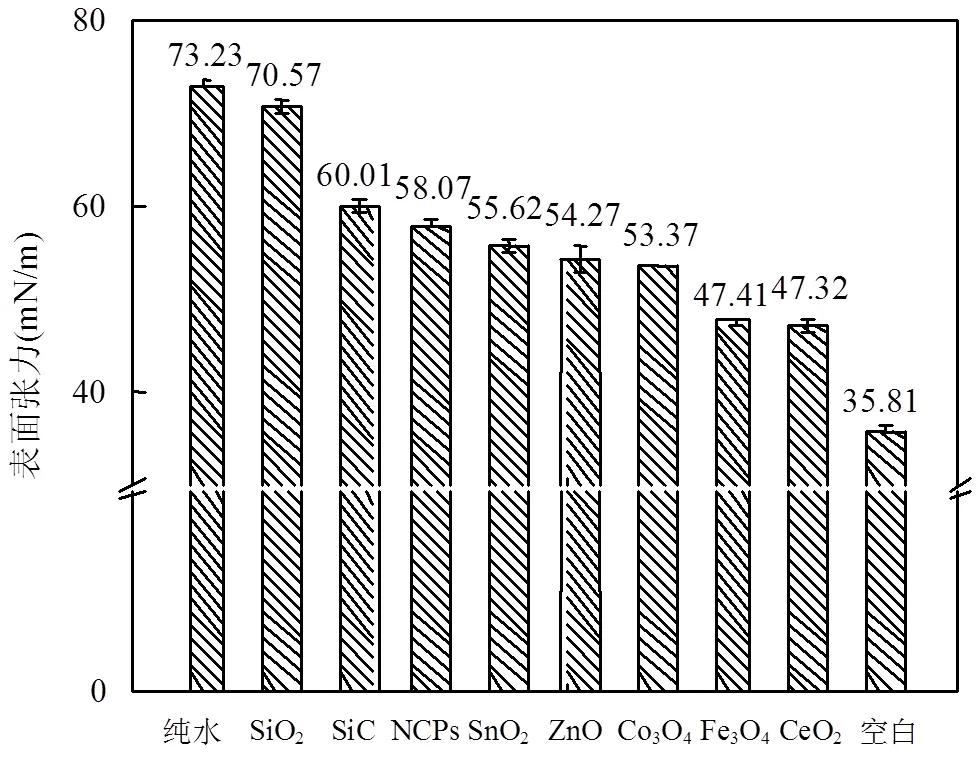
图2 NPs对PS(50mg/L)表面张力的影响
2.3 NPs对PS气-液界面π-A和π-t等温线的影响
由于PS在气-液界面的π-A等温线与呼吸过程中肺泡的相行为变化相似,而被广泛用于体外环境污染物暴露的肺功能评估[25].PS单层的表面压力-表面积等温线的实验结果如图3所示,当亚相为生理盐水时,PS的π-A等温线在滑障不断压缩的过程中,气-液界面处PS的分子间距不断减小,表面压力不断增大,依次出现了气、液、固3个相态的转变,PS单层的最大表面压力可达50mN/m,这与Fan等[26]的报道一致.当NPs存在时,PS的π-A等温线发生了两种不同的变化.其中,纳米SiC、NCPs、纳米ZnO和纳米Co3O4使得π-A等温线向表面积变小的方向移动(内缩),同一表面积对应的表面压力下降明显,其对应的π-A等温线的气-液相的相转变点也出现了明显后移现象.与之相反,纳米SiO2、Fe3O4、SnO2和CeO2等颗粒物存在导致了PS膜π-A等温线的外扩,即整个曲线向表面积增大的方向移动,同一表面积所对应的表面压力升高,气-液相的相转变明显提前.

图3 NPs对PS气-液界面π-A等温线的影响
磷脂作为气-液界面处PS膜的主要成膜组分,颗粒物吸附能力越强,成膜组分的含量越少[27],相应的π-A等温线应呈现内缩趋势.从吸附实验结果来看(图1(a)),SiC和SiO2对磷脂的吸附能力较强,但是其存在下PS的π-A等温线却呈现相反的趋势,因此在后续实验中选取SiC和SiO2进行实验探究.在图4(a)中,SiC浓度越高,PS的π-A等温线内缩现象越明显.当亚相中SiC浓度分别为0,0.01,0.02和0.1g/L时,在表面积为160cm2处,其对应的表面压力分别为6.96,6.12,4.51,2.31mN/m, PS π-A等温线气-液相的相转变所对应的位置分别为205.85,201.92, 192.21,167.91cm2.π-A等温线在气-液相阶段的表面压力与界面上的表面活性分子的含量呈正相关[28-29].SiC造成PS的π-A等温线内缩,可能是由于颗粒物的吸附作用导致.
在NPs等外源物质对细胞膜的吸附或渗透性实验中,吸附能力的变化通常由表面压力随时间的变化来解释[29].为揭示NPs对PS的吸附行为,进一步选取初始表面压力为30mN/m开展π-t等温线实验,其结果如图4(b)所示.亚相溶液不含SiC时,π-t等温线的稳态表面压力为30mN/m左右,而当添加了颗粒物时,π-t等温线的稳态表面压力逐渐降低,且随着亚相中颗粒物浓度的增加表面压力逐渐下降.这表明SiC浓度越高,其吸附的PS越多,解释了π-A等温线在气-液相阶段表面压力降低的原因(图4(a)),这与表面张力(图2)的实验结果是一致的.
为了更直观地观察SiC暴露对PS膜的影响,通过BAM对SiC存在/不存在时气-液界面处PS单层膜的微观结构进行了观测.结果表明,与不含SiC的 PS单层膜相比(图4(c)),含有SiC的 PS单层膜的界面上出现了空洞(图4(d)),这是SiC对气-液界面处的PS的吸附导致的.由此可以推断,SiC对PS π-A等温线的造成的内缩影响主要归因于其对PS成膜组分的吸附作用.

如图5(a)所示,亚相中不同浓度(0,0.001,0.01和0.1g/L)的SiO2均使π-A等温线外扩,且颗粒物浓度越高,外扩现象越明显,相同表面积处对应的表面压力上升得越快.Guzman等[30]发现,SiO2可导致DPPC单分子膜表面压力的升高.Hao等[29]也发现NPs能嵌入界面上DPPC单层膜的间隙,从而导致其表面压力升高.因此,纳米SiO2导致PS单层膜π-A等温线外扩也可能是发生了类似的作用.如图5(b)所示,当初始表面压力为5mN/m,不存在纳米SiO2时,π-t等温线的稳态表面压力维持在5mN/m左右.而当亚相溶液中存在SiO2时,表面压力逐渐上升,且颗粒物浓度越大,表面压力上升的越明显.这是由于在低表面压力下,界面上的PS分子排列的相对疏松,分子之间的间隙较大[19,26-27],有利于亚相中的颗粒物吸附到界面并嵌入到PS膜之中,解释了SiO2存在时表面压力升高的现象.为验证这一推论,对不存在/存在SiO2时的PS膜进行了BAM观察.与不含SiO2(图5(c))相比,当亚相中添加SiO2后,PS分子膜中出现大量的白色亮斑(图5(d)),这些白色的斑点就是SiO2.由此可见, SiO2造成PS单层膜π-A等温线外扩的主要原因是颗粒物嵌入到了界面膜的分子间隙中.

2.4 PS对NPs粒径和Zeta电位的影响
粒径大小是控制颗粒物机体转化及其毒性作用的关键因素,与PS相接触后,PS也可能对NPs的粒径产生影响,其中水合动力学直径可反映颗粒物在溶液体系中的粒径分布状态[31].选取纳米SiO2和纳米SiC为NPs代表,进一步探究在PS及其活性组分的溶液中颗粒物水合动力学直径变化.不同溶液体系中粒径分布结果如图6所示,在生理盐水中SiO2(图6(a))和SiC(图6(b))水动力学直径主要分布在2和1.2μm.加入PS后, SiO2的水动力学直径出现了减小现象,其水动力学直径主要集中在0.89μm,而SiC则相反,其直径主要集中在1.4μm.这表明,PS提高了SiO2的分散性,促使SiC团聚.在PS的主要组分DPPC和BSA溶液中,由其粒径变化可知,DPPC可促使SiO2和SiC的团聚,BSA则有利于SiO2和SiC的分散.此外,由图1可知,SiO2和SiC是吸附DPPC最强的两种纳米颗粒物,DPPC使SiO2和SiC水合动力学直径增大的原因也有可能是其大量吸附DPPC造成的.
Zeta电位是悬浮物稳定性的重要指标[32], Zeta电位的绝对值越高,体系趋向于分散且越稳定.反之,颗粒物越倾向于聚集.生理盐水、PS、DPPC、BSA中的SiO2和SiC的Zeta电位如图6所示.与生理盐水中的Zeta电位相比,PS溶液中SiO2(图6(c))和SiC (图6(d))Zeta电位的绝对值分别为5.89和3.54mV,这表明PS使SiO2的性能更稳定,分散性提高;而SiC则更趋于凝聚,分散性降低,这与水合粒径的结果相对应.DPPC则使SiO2和SiC的Zeta电位的绝对值减小,BSA使SiO2和SiC的Zeta电位的绝对值增大,这表明DPPC是PS活性组分中促使SiO2和SiC在溶液中趋于凝聚的主要原因.有研究认为细颗粒物在肺液中的团聚有益于肺部对这些细颗粒物的清除过程[33],但若肺部积累过多的NPs可能会引起呼吸道疾病的产生,故探究颗粒物在肺部的分散/团聚的性能,对评估NPs在体内运输及其对健康的危害有非常重要的意义.
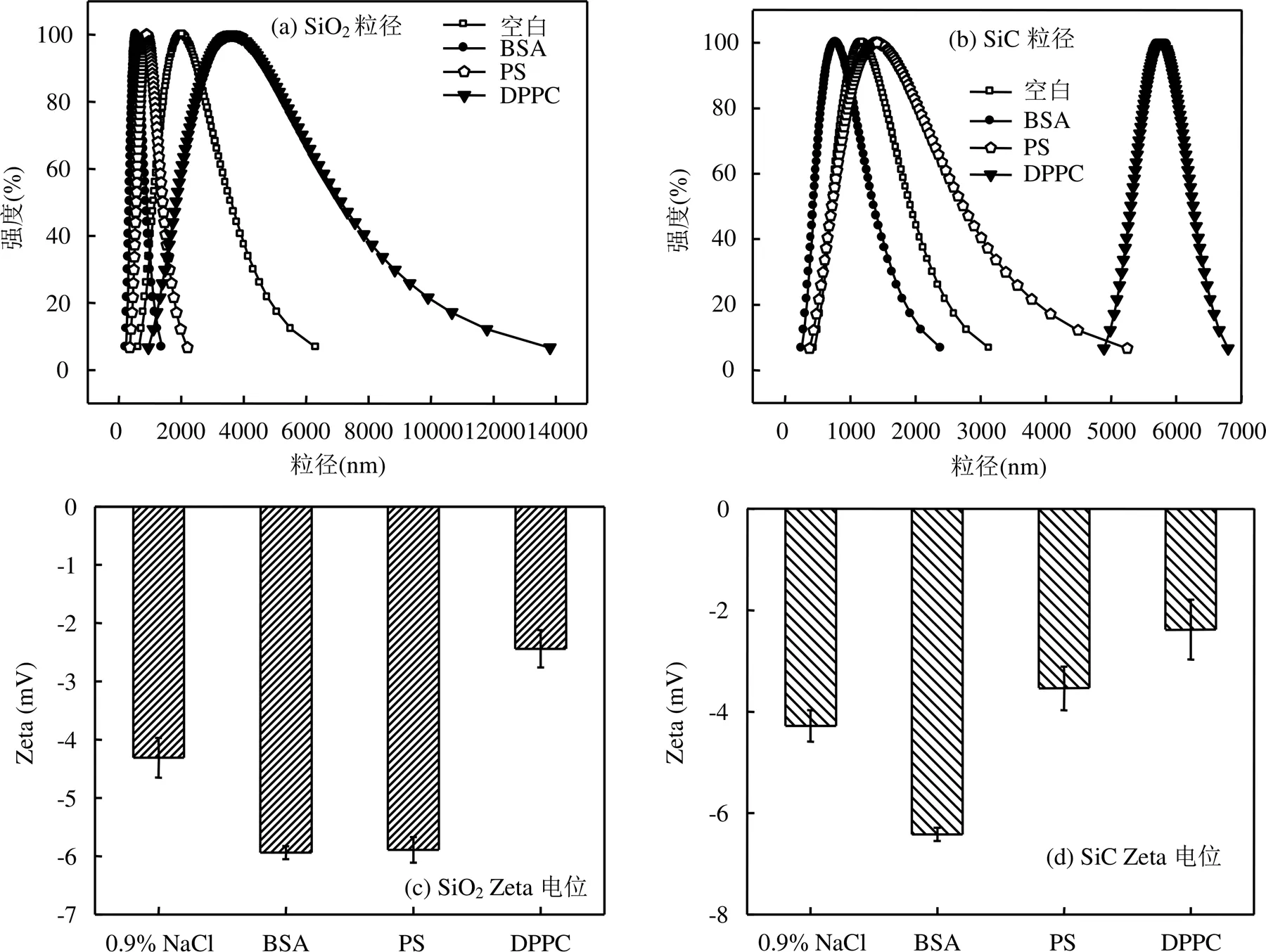
图6 纳米SiO2和纳米SiC在生理盐水、PS、DPPC、BSA中的水合动力学直径及Zeta电位
3 结论
3.1 NPs对PS中的活性组分(磷脂和蛋白)都有一定的吸附作用,其中纳米SiO2和纳米Fe3O4分别对磷脂和蛋白有较强的吸附作用,吸附率分别为89.3%和82.5%.
3.2 NPs均可导致PS溶液表面张力的升高,且与NPs对磷脂组分的吸附能力呈正相关.纳米SiC对PS的吸附导致了PS膜上成膜组分(磷脂)的减少和π-A等温线内缩,而纳米SiO2进入PS膜的分子间隙导致π-A等温线的外扩.
3.3 PS及其活性组分会对NPs的水合动力学直径和Zeta电位产生影响,改变溶液体系中NPs的稳定性,从而可影响其在机体内的迁移归趋.
[1] Li X M, Liu W, Sun L, et al. Effects of physicochemical properties of nanomaterials on their toxicity [J]. Journal of Biomedical Materials Research Part A, 2015,103(7):2499-2507.
[2] Kreyling W G, Semmler-Behnke M, Takenaka S, et al. Differences in the biokinetics of inhaled nano- versus micrometer-sized particles [J]. Acc Chem Res, 2012,46(3):714-722.
[3] Li R, Navab K, Hough G, et al. Effect of exposure to atmospheric ultrafine particles on production of free fatty acids and lipid metabolites in the mouse small intestine [J]. Environmental Health Perspectives, 2015,123(1):34-41.
[4] Valle R P, Wu T, Zuo Y Y. Biophysical influence of airborne carbon nanomaterials on natural pulmonary surfactant [J]. Acs Nano, 2015,9(5):5413-21.
[5] Schleh C, Hohlfeld, Jens M, et al. Interaction of nanoparticles with the pulmonary surfactant system [J]. Inhalation Toxicology, 2009,21:97- 103.
[6] Muhlfeld C, Rothen-Rutishauser B, Blank F, et al. Interactions of nanoparticles with pulmonary structures and cellular responses [J]. AJP: Lung Cellular and Molecular Physiology, 2008,294(5):L817- L829.
[7] Peters A, Veronesi B, Lilian Calderón-Garcidueas, et al. Translocation and potential neurological effects of fine and ultrafine particles a critical update [J]. Particle and Fibre Toxicology, 2006,3(1):13.
[8] Curstedt T, Calkovska A, Johansson J. New generation synthetic surfactants [J]. Neonatology, 2013,103(4):327-330.
[9] Ki-Hyun Kim, Shamin Ara Jahan, Ehsanul Kabir. A review on human health perspective of air pollution with respect to allergies and asthma – ScienceDirect [J]. Environment International, 2013,59(3):41-52.
[10] 董声焕.肺表面活性物质基础与临床 [M]. 北京:人民军医出版社, 2012:18-24.
Dong S H. Pulmonary surfactant basic and clinical studies [M]. Beijing: People’s Military Medical Press, 2012:18-24.
[11] Speer C P, Sweet D, Halliday H L. Surfactant therapy: past, present and future [J]. Early Human Development, 2013,89:S22-S24.
[12] I Pujalté, Passagne I, Brouillaud B, et al. Cytotoxicity and oxidative stress induced by different metallic nanoparticles on human kidney cells. [J]. Particle & Fibre Toxicology, 2011,8(1):10.
[13] 赵 建.人工纳米颗粒对生物体内主要生物分子和多环芳烃的吸附[D]. 青岛:中国海洋大学, 2011.
Zhao J. Adsorption of main biomolecules and polycyclic aromatic hydrocarbons by artificial nanoparticles [D]. Qingdao: Ocean University of China, 2011.
[14] Garcia-Mouton C, Hidalgo A, Cruz A, et al. The lord of the lungs: The essential role of pulmonary surfactant upon inhalation of nanoparticles [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 144.
[15] Kendall M, Guntern J, Lockyer N P, et al. Urban PM2.5surface chemistry and interactions with bronchoalveolar lavage fluid [J]. Inhalation Toxicology, 2004,16(Suppl 1):115-129.
[16] Wang M, Li J, Dong S, et al. Silica nanoparticles induce lung inflammation in mice via ROS/PARP/TR/MIN signaling-mediated lysosome impairment and autophagy dysfunction [J]. Particle and Fibre Toxicology, 2020,17(1):1-22.
[17] Chen H W, Su S F, Chien C T, et al. Titanium dioxide nanoparticles induce emphysema–like lung injury in mice [J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2006,20(13):2393-2395.
[18] Bernhard W, Mottaghian J, Gebert A, et al. Commercial versus native surfactants. Surface activity, molecular components, and the effect of calcium [J]. Am J Respir Crit Care Med, 2000,162(4):1524-1533.
[19] Zhao Q, Li Y J, Chai X L, et al. Interaction of pulmonary surfactant with silica and polycyclic aromatic hydrocarbons: Implications for respiratory health [J]. Chemosphere, 2019,222(MAY):603-610.
[20] Rachana R, Banerjee R. Effects of albumin and erythrocyte membranes on spread monolayers of lung surfactant lipids [J]. Colloids & Surfaces B Biointerfaces, 2006,50(1):9-17.
[21] 耿迎雪,李曼焘,曹 妍,等.苯并[a]蒽与肺表面活性剂混合磷脂的相互作用[J]. 中国环境科学, 2020,41(7):3381-3389.
Geng Y X, Li M X, Cao Y, et al. Interaction of benzo [a] anthracene with mixed phospholipids of pulmonary surfactant [J]. China Environmental Science, 2020,41(7):3381-3389.
[22] Anna S K, Trojan S, Cwiklik L, et al. Modeling Lung Surfactant Interactions with Benzo[a]pyrene [J]. Chemistry – A European Journal, 2017,23(22):5037-5016.
[23] Seurynck-Servoss S L, Brown N J, Dohm M T, et al. Lipid composition greatly affects the in vitro surface activity of lung surfactant protein mimics [J]. Colloids & Surfaces B Biointerfaces, 2007,57(1):37-55.
[24] Padilla–Chavarría H I, Guizado T R, Pimentel A S. Molecular dynamics of dibenz[a,h]anthracene and its metabolite interacting with lung surfactant phospholipid bilayers [J]. Physical Chemistry Chemical Physics, 2015,17(32):20912–20922.
[25] Geng Y, Zhang L, Li Y, et al. Effect of pulmonary surfactant on the dispersion of carbon nanoparticles [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021,629:9.
[26] Fan Q, Wang Y E, Zhao X, et al. Adverse Biophysical Effects of Hydroxyapatite Nanoparticles on Natural Pulmonary Surfactant [J]. Acs Nano, 2011,5(8):6410.
[27] Farnoud A M, Fiegel J. Low concentrations of negatively charged sub-micron particles alter the microstructure of DPPC at the air–water interface [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2012,415(6):320-327.
[28] Zhao Q, Li Y J, Chai X L, et al. Interaction of nano carbon particles and anthracene with pulmonary surfactant: The potential hazards of inhaled nanoparticles [J]. Chemosphere, 2019,215(JAN.):746-752.
[29] Hao C C, Li J H, Mu W N, et al. Adsorption behavior of magnetite nanoparticles into the DPPC model membranes [J]. Applied Surface Science, 2016,362:121-125.
[30] Guzmán E, Liggieri L, Santini E, et al. DPPC–DOPC Langmuir monolayers modified by hydrophilic silica nanoparticles: Phase behaviour, structure and rheology [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2012,413:174-183.
[31] Wiseman C, Zereini F. Characterizing metal(loid) solubility in airborne PM10, PM2.5and PM1in Frankfurt, Germany using simulated lung fluids [J]. Atmospheric Environment, 2014,89(6.):282-289.
[32] Krickl S, Touraud D, Kunz W, Investigation of ethanolamine stabilized natural rubber latex from Taraxacum kok-saghyz and from Hevea brasiliensis using zeta-potential and dynamic light scattering measurements [J]. Industrial Crops and Products, 2017,103:169-174.
[33] Levard C, Mitra S, Yang T, et al. Effect of Chloride on the Dissolution Rate of Silver Nanoparticles and Toxicity to Ecoli [J]. Environmental Science & Technology, 2013,47(11):5738-5745.
Effect of nano-particles on interfacial chemical properties of pulmonary surfactant.
LIU Dan, LI Jie, CAO Yan, GENG Ying-xue, CHAI Xiao-long, JIANG Fan-shu, SHI Wei-meng, ZHAO Qun*, TIAN Sen-lin*
(Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China)., 2022,42(5):2379~2386
Nano-particles (NPs) such as nano-silica, nano-carbon powder, nano-zinc oxide, nano-cerium oxide, nano-silicon carbide and nano-iron tetroxide were used as representatives to study their effects on the interface properties of pulmonary surfactant (PS). The results shown that NPs had adsorption effects on both phospholipid and protein components in PS, and nano-silica and nano-ferric tetroxide had the strongest adsorption capacity for phospholipid and protein components, respectively, with adsorption rates of 89.3% and 82.5%. The existence of NPs would lead to the increase of the surface tension of PS solution, among which the effect of nano-silica was the most significant. Particles such as nano-silicon carbide and nano-silicon dioxide can cause the inward shrinkage/outward expansion of the π-A isotherm of the PS film, and the higher the particle concentration, the more obvious the surface pressure change. In addition, PS also had an effect on the hydration kinetic diameter and Zeta potential of NPs, resulting in the change of its dispersion state. It can be seen that NPs can change the composition and interface of PS by changing the composition and interface of PS.
nanoparticles;pulmonary surfactant;interfacial chemical properties;adsorption;lung health
X503.1
A
10000-6923(2022)05-2379-08
刘 丹(1995-),女,云南昆明人,昆明理工大学硕士研究生,主要从事大气污染与人体健康方向的研究.
2021-10-25
云南省基础研究计划项目(202101AT070129,201001AU 070038);国家自然科学基金资助项目(21777064)
* 责任作者, 赵 群, 讲师, zq441206@163.com; 田森林, 教授, tiansenlin@outlook.com

