石墨烯等碳纳米材料在心肌组织工程中的应用
王 旭,关 静,张 勇
心血管疾病是全球最常见的死亡原因,严重危害人类的健康和生存质量(世界卫生组织,2017年)。心肌梗死(myocardial infarction,MI)是一种常见的心血管疾病,可由冠状动脉闭塞引起,持续的缺血可造成不可逆的心肌损伤和病理性心室重构,最终导致心力衰竭[1]。传统的MI治疗方法有应用β受体阻滞剂、抗血小板药物、抗凝药物等药物疗法,以及包括溶栓治疗和心脏介入手术的心肌再灌注治疗[2]。由于心肌再生能力有限,传统的治疗方法仅能改善MI的症状,或延缓心脏功能的恶化,无法实现梗死后心肌功能的重建。心脏移植虽是替代MI终末期心力衰竭患者受损心脏的有效疗法,但由于供体器官紧缺、免疫排斥反应和器官移植后感染等问题的存在,仍亟需一种可促进心肌再生、重建梗死心肌功能的新疗法。
心肌组织工程学是一门基于工程学和生命科学技术与原理,在体外利用种子细胞、支架材料和细胞因子合成具有功能性的心肌组织替代物,旨在实现MI后受损心肌组织的修复、再血管化与功能重建的新兴学科[3]。正常生理条件下,心肌细胞通过协调动作电位和钙离子转运实现兴奋-收缩偶联[4]。因而,理想的工程化心肌组织除了具有优异的生物相容性及与心肌相一致的机械性能,还应具有匹配天然心肌电生理特性的导电性,为心肌提供适宜的导电微环境,重建心肌兴奋-收缩偶联。导电纳米材料,如碳纳米材料、金属纳米粒子、MXenes、导电聚合物等,均具有与天然心肌相匹配的电导率,为构建心脏类器官提供了可能,并已应用于心肌组织工程,可有效恢复心脏功能。应用含金属纳米粒子、二维(two-dimensional,2D)过度金属碳/氮化物MXenes及导电聚合物的工程化心脏贴片[5,6]均可显著降低MI后的MI面积。碳纳米材料,如碳纳米管(carbon nanotubes,CNTs)和石墨烯因其独特的形态、结构和理化性质,被广泛应用于纳米医学领域。
1 碳纳米管
CNTs是由石墨烯卷曲而成的无缝、中空、圆柱形纳米管结构,可根据石墨烯的层数分为单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs),每层管壁中的碳原子均以SP2杂化方式形成蜂窝状原子层[7]。以SP2方式杂化的碳键具有更大的强度,使CNTs具有更高的机械强度,单个MWCNTs的弹性模量约为1 TPa,抗拉强度为100 GPa,这种机械强度高于工业纤维10倍以上。同时基于SP2方式杂化的碳结构具有更快的电荷迁移速率,使CNTs具有良好的导电性能,MWCNTs可携带高达109A/cm2的电流[8]。典型的SWCNTs直径为0.8~2.0 nm,MWCNTs的直径为5~20 nm,长度可从数十纳米至几厘米不等[8],这种极高的长径比,可模拟天然组织固有的各向异性。目前CNTs的合成方法包括物理方法(电弧放电法、激光消融法)和化学方法(化学气相沉淀法)。
基于CNTs在生物医学领域展现出的应用潜力,CNTs除了被应用于体内细胞示踪、药物及基因输送,还可与其他材料相混合制成支架,应用于心肌组织工程,以改善支架导电性。Kharaziha M等[9]将CNTs平行地嵌入明胶纳米纤维支架中,显著改善了支架材料的导电性和柔韧性。CNTs的嵌入模拟了天然心肌各向异性的结构,促进了心肌细胞在支架上的黏附、滞留及排列,增强了心肌细胞的活性和成熟度。在含CNTs的支架上种植的心肌组织更均质,具有更高的跳动率和更低的兴奋阈值。Liu Y等[10]利用CNTs调节电纺纤维支架的导电性和内部结构,发现混入超过3%的CNTs后纤维支架中可形成导电网络,使心肌细胞活性增加,形态伸长并可同步搏动。Mombini S等[11]以聚乙烯醇、壳聚糖和CNTs为底物,利用静电纺丝技术构建了纳米纤维支架,并通过电刺激成功诱导了支架上大鼠间充质干细胞(mesenchymal stem cell,MSCs)向心肌细胞的分化,其中含1%CNTs的改良支架展现出了最佳的心肌细胞分化性能。CNTs也可与1,2,4-丁三羧酸酯等聚合物组合制成支架,与纯聚合物支架相比,含CNTs的聚合物支架上接种的心肌细胞有更高的成熟度和更早的心脏搏动[12]。随着对导电纳米材料研究的不断深入,越来越多的导电纳米材料被应用在了心肌再生领域,Lee J等[13]分别用CNTs、氧化石墨烯(graphene oxide,GO)和还原氧化石墨烯(reduced graphene oxide,rGO)制成甲基丙烯酰化明胶(gelatin methacryloyl,GelMA)水凝胶,并比较了这3种碳纳米材料水凝胶对心肌细胞结构和功能的影响。研究表明,在CNTs-和rGO-GelMA支架上培养的心肌细胞具有更理想的细胞形态和更高的功能性心脏标志物表达,且CNTs-GelMA可介导整合素,激活Yes相关蛋白/转录共激活因子PDZ结合基序(Yes-associated protein/transcriptional coactivator with a PDZ-binding domain,YAP-TAZ)通路促进心肌细胞成熟,使工程化心肌组织的成熟标志物表达水平达到天然心脏组织成熟标志物表达水平。此外,由不同支架构建的工程化心肌组织具有不同的心肌细胞表型,CNTs-GelMA呈心室样、GO-GelMA呈心房样、rGO-GelMA呈心室/心房混合型。综上,在CNTs支架上生长的心肌细胞可展现出更规律的排布与搏动,使CNTs在工程化心肌组织的支架材料中展现出更大的优势。
但是关于CNTs体内应用的细胞毒性问题一直存在争议。部分证据表明,CNTs在体内可诱发炎症、上皮样肉芽肿、纤维化和氧化应激,但也有研究表明CNTs的毒性取决于它的长度和表面修饰[14]。过长的CNTs被细胞吞噬时可能会使细胞膜破裂,提示人们通过化学氧化法制备缩短的CNTs在心肌组织工程中的应用潜力[14]。为了提高CNTs的生物相容性,Zhao G等[15]研发了一种全水相工艺,用以合成定向排列的CNTs/丝素蛋白电纺支架。该支架不仅可促进心脏组织的定向生长、肌节及缝隙连接的仿生分布,全水相工艺的应用还提高了支架的生物相容性。Shokraei N等[16]采用电喷涂技术将MWCNTs添加到聚氨酯纳米纤维上制备了具有更好的细胞相容性的导电纳米纤维贴片。工程化心肌组织常通过侵入性手术植入人体,为克服这一局限性,Peña B等[17]研发了一种具有CNTs功能化的可注射反向热凝胶,该凝胶在达到人体体温后可转变为具有三维(three-dimensional,3D)结构的凝胶基质。这种凝胶可促进心肌细胞的排列和增殖,改善心肌细胞功能,同时也提出了一种通过微创手术将CNTs支架植入人体的新方法。此外,研究表明CNTs在生物降解过程中存在潜在毒性[18],因而在评估CNTs本身毒性的同时,CNTs分解产物的毒性还有待更全面的评估。
2 石墨烯及其衍生物
石墨烯是由1个碳原子与3个相邻碳原子通过SP2杂化形成的具有蜂窝状结构的2D碳原子单层,具有优异的导电性[粉末状样品电导率为(2 500±20)S/m],是迄今为止最薄、最坚韧的材料。GO是一类重要的石墨烯衍生物,表面有丰富的官能团(环氧基、羟基、羧基),具有水溶性,在水介质中能稳定存在,可应用于体内药物或基因的传送[19]。GO是一种绝缘体[粉末状样品电导率为(0.021±0.002)S/m],经热还原为rGO后可恢复导电性[粉末状样品电导率为(2 400±200)S/m][20]。
石墨烯及其衍生物具有较大的比表面积,出色的电学、光学特性,并有研究报道与CNTs相比,石墨烯具有更低的细胞毒性[21,22],因此被广泛应用于生物传感、生物成像和组织再生等领域。Hitscherich P等[23]利用静电纺丝技术,将石墨烯纳米粒子添加到聚己内酯[poly(caprolactone),PCL)支架中,石墨烯在PCL中的均匀分布提供了局部导电位点,可通过电刺激石墨烯位点对整个支架实施外部电刺激。该支架对小鼠胚胎干细胞来源的心肌细胞(mouse embryonic stem cell derived cardiomyocytes,mES-CM)展现出了良好的生物相容性和增强的Ca2+转运能力。MI后M1型巨噬细胞在MI区域形成的局部炎症环境,可加重心力衰竭。Han J等[24]合成了一种靶向巨噬细胞的GO复合物,该复合物不仅可减少细胞内活性氧(reactive oxygen species,ROS)水平来缓解炎症,还可分泌细胞因子促进心肌修复。Zhou J等[25]将GO掺入富马酸寡聚(聚乙二醇)[oligo(poly(ethylene glycol))fumarate,OPF]制备了一种具有半导体性能的水凝胶。GO的功能团丰富,易于与传统支架材料通过共价结合形成复合支架,随后可通过对复合支架还原处理,恢复石墨烯的导电性。Norahan MH等[26]通过冷冻干燥法制备了胶原支架,与GO包覆后用还原剂处理支架,获得了具有促血管生成特性的导电心脏贴片。rGO-Gel-MA支架[27]、rGO-海藻酸盐水凝胶[28]及rGO-银-聚氨酯纳米纤维支架[29]均在心肌组织工程中显示出了良好的应用前景。且该支架中rGO具有抗菌特性,可通过氧化应激破坏细菌细胞膜,为应用的心脏贴片提供抗菌微环境[30]。Stone H等[31]采用超声法和粒子浸出法相结合的新技术,将rGO掺入电纺聚(酯酰胺)[poly(ester amide),PEA]支架,研发出了高孔隙率的导电支架。除了生物相容性,理想的心脏支架还需具有3D结构,以模拟天然心肌组织微环境。Bahrami S等[32]以泡沫镍作为模板,利用化学气相沉淀法制备了具有更大比表面积的3D石墨烯泡沫,并研讨了其在心肌组织工程领域的应用。以石墨烯及其衍生物为支架的工程化心肌组织可以修复心脏组织、恢复心功能。Tsui JH等[33]利用3D生物打印技术成功将脱细胞猪心肌细胞外基质-rGO杂化水凝胶构建成工程化心肌组织,实现了心脏药物毒性的测定,也为建立高通量药物筛选平台提供了可能。
目前石墨烯主要的制备方法包括氧化还原法和化学气相沉淀法。氧化还原法适合大规模生产,但纯度较低,生成的GO有下调神经元信号传导的风险[34]。化学气相沉淀法应用更广,但获得的石墨烯底物不易处理不利于体内植入,且常需掺入其他蛋白来增强生物功能。为此Hernandez Y等[35]开发了液相剥离技术,以大规模生产质量高、未氧化、适合生物应用的单层石墨烯;Ryan AJ等[36]探讨了该技术的商业可行性、生物相容性和在心肌组织工程中的应用前景。关于石墨烯合成的方法、复合的支架材料及支架结构的选择,还需根据心脏生理学、MI病理学基础,进行更深入的探究。研究表明,20~300 nm大小的GO可被细胞摄取[37,38],同时石墨烯较高的纵横比,常会导致合成石墨烯形状的不确定,研制能够控制聚合产物形状,如宽度、长度、边缘结构的石墨烯纳米带的合成方法也将推动石墨烯在临床应用的转化。部分研究表明,石墨烯可能会通过物理作用扰乱细胞骨架组织、有丝分裂、细胞器完整性、细胞运动及细胞分泌,或可能通过氧化应激产生潜在毒性[39]。因而在活体动物的研究中,还需评估石墨烯在体内的生物分布、生物持久性和慢性毒性。
3 总结与展望
具有优异导电性的CNTs和石墨烯常被作为心肌组织工程的支架材料,CNTs或石墨烯的添加不仅能赋予工程化心肌组织优越的机械性能和柔韧性,还可通过共价或非共价官能化调节心肌的电生理。表1、2分别总结了基于CNTs和石墨烯及其衍生物的工程化心肌组织的支架类型及特性。碳纳米材料应用于心肌组织工程的基础医学研究仍有很多局限性亟待临床突破。首先,碳纳米材料作为组织工程学和再生医学中的新兴材料,需加强其临床前安全性评价。明确应用碳纳米材料的有效剂量,材料本身及其降解产物在体内的分布、存留时间及毒性,并通过官能团修饰等方式提高碳纳米材料的生物相容性。另外,需对碳纳米材料在心肌组织工程中的应用作全面的临床有效性评价。除啮齿类动物,还需增加猪等大型动物样本量,延长随访时间,观察长期治疗效果及可能存在的副作用。研究表明,碳纳米材料可介导细胞经典Wnt信号通路[25],或通过增加细胞膜胆固醇量活化G蛋白偶联受体P2Y受体(purinoceptor 2Y),进而激活细胞信号通路[40]。因而深入了解碳纳米材料的生物学作用,也有益于进一步评估碳纳米材料的有效性。最后,碳纳米材料常通过心肌内注射或心脏贴片等方式植入体内,为了减少开胸手术对患者造成的伤害,需开辟微创介入等植入工程化组织的新途径。相信随着工程技术与医学及生命科学的交叉融合将攻破心肌组织工程的关键技术,实现这项创新医疗产品的成果转化,使基于碳纳米材料的工程化心肌组织成为治疗MI的常规备选方案之一。
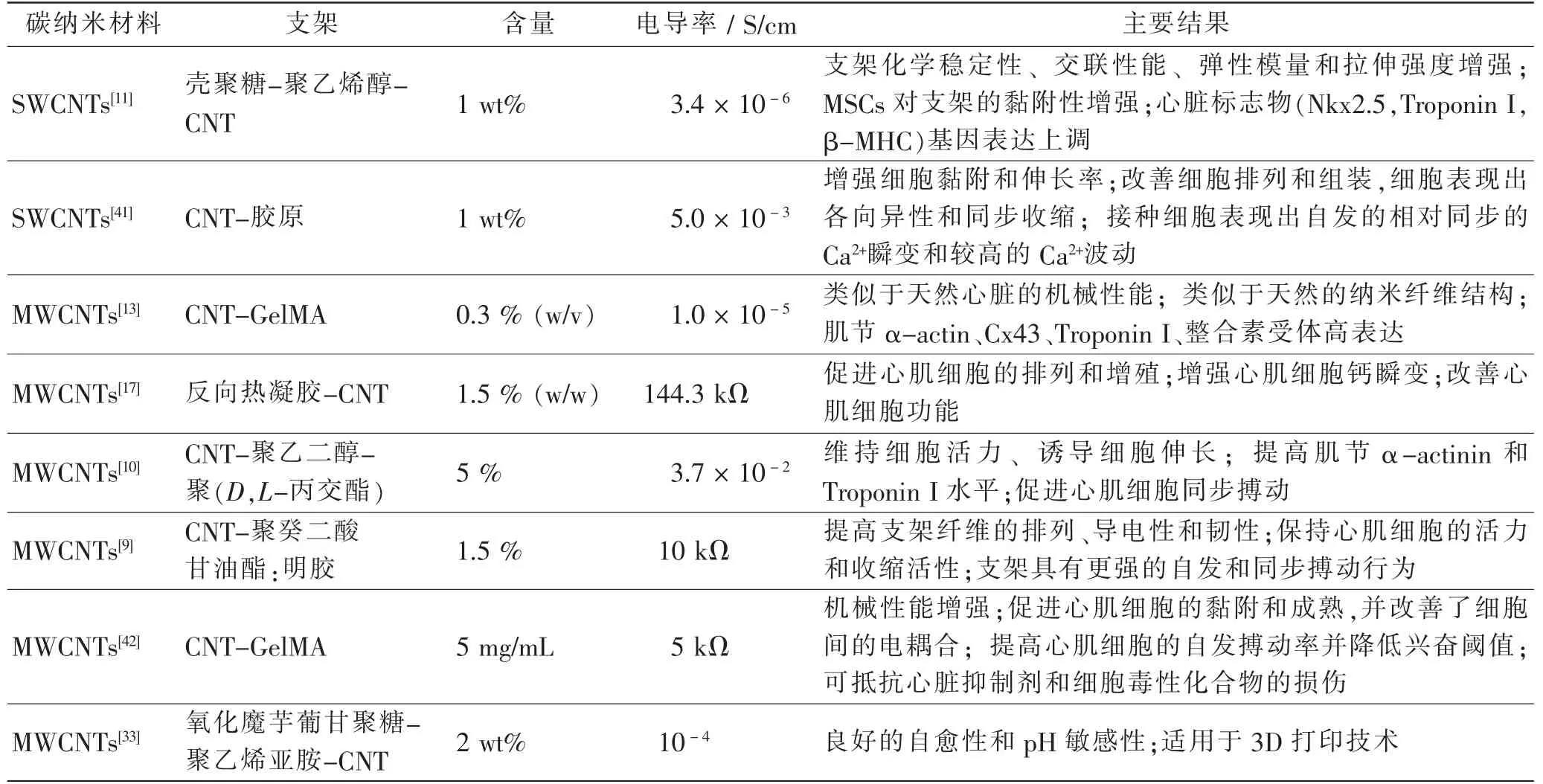
表1 基于CNTs的工程化心肌组织的支架类型和特性Tab.1 Support types and properties of engineered myocardial tissue based on CNTs

表2 基于石墨烯及其衍生物的工程化心肌组织的支架类型和特性Tab.2 Support types and properties of engineered myocardial tissue based on graphene and its derivatives

