关中地区紫花苜蓿,小麦及玉米根际土壤理化性质研究
昝看卓, 刘 丛, 张燕燕, 阿山江·伊米尼江, 白 婕, 龙明秀, 王可珍, 屈 洋, 何树斌*
(1. 西北农林科技大学草业与草原学院,陕西 杨凌 712100; 2. 宝鸡市农业科学研究院,陕西 岐山 722400)
长期以来,以小麦(Triticumaestivum)和玉米(Zeamays)为主的传统农业种植模式为我国的粮食安全做出了突出贡献,但这种以谷物为主的种植模式,由于长期缺乏休耕,及工业化肥的大量使用导致土壤团聚体[1]和微生物[2]减少,土壤碳(C)、氮(N)流失严重等一系列土壤健康问题[3-5]。因此,传统高强度、单一的农业种植面临提高资源利用效率和实现土壤可持续生产的巨大挑战[6]。紫花苜蓿(Medicagosativa)和青贮玉米是当前草牧业生产中重要牧草及饲料作物,是近年来“中央一号”文件和“粮改饲”等优先发展的饲草资源。具有“牧草之王”美誉的紫花苜蓿,不仅能为家畜提供重要的蛋白质饲料,还可通过增加有机质输入和固氮微生物等改善土壤质量,实现土壤的可持续生产[7]。豆科和禾本科作物的间套种生产模式由于能够提高土地[8]、光热[9]和氮磷等资源的高效利用[10,11],在农业领域“双减”背景下,特别是在我国北方地区是一项应用前景广泛、资源高效利用的农业种植模式[11]。2021年苜蓿套种青贮玉米高效生产技术成功入选农业农村部重大引领性技术[12]。
陕西省立足资源禀赋,突出区域优势,“十三五”期间,在关中地区重点发展了草畜产业,优化了种植业结构,扩大了青贮玉米和苜蓿等优质饲草的种植面积。基于此,本研究以陕西省宝鸡市岐山县刘家塬试验站单播四年的紫花苜蓿、玉米、小麦及套种紫花苜蓿和青贮玉米的根际土壤为研究对象,通过对作物及饲草根际土壤C、N含量、土壤稳定性同位素(δ13C和δ15N)、土壤微生物量和土壤酶活性的研究分析,旨在掌握土壤理化性质对小麦、玉米、紫花苜蓿单播及玉米-紫花苜蓿套种的响应规律,明确较传统的种植模式,基于豆科饲草的复合型种植模式是否能够实现资源的高效利用与土壤的可持续生产。本研究拟从土壤理化性质的角度为关中地区落实“中央一号”文件和“粮改饲”等,实现农业资源的高效利用提供理论依据。
1 材料与方法
1.1 研究区概况
试验在陕西省宝鸡市农业科学研究院刘家塬试验站(107°39′E,34°27′N)进行,该地区位于关中平原西部,属暖温带大陆性季风型半湿润气候,平均海拔为669.6 m,年平均气温为12.0℃,平均日照时数2064.8 h,平均无霜期214 d,年平均降水500~650 mm,主要集中在7—9月。试验小区地势平坦,肥力均匀,保水保肥性好,光照充足,适于小麦、青贮玉米和紫花苜蓿的生长[13]。
1.2 试验设计
试验种植小麦品种为‘小堰22’,玉米品种为‘郑单958’,紫花苜蓿品种为‘三得利’。试验设单播玉米(M)、单播小麦(W)、紫花苜蓿单播(A)及紫花苜蓿与玉米套种(AM)4个处理,每处理3次重复,共12个小区,小区面积10 m×3 m。2017年起,每年4月末以37.5 kg·hm-2的播种量种植玉米;10月初以187.5 kg·hm-2的播种量种植小麦;6月末以22.5 kg·hm-2播种量、40 cm行距条播紫花苜蓿。紫花苜蓿建植后的第二年,7月刈割后在其空白行间隔行以30 cm株距机械播种青贮玉米种子。小麦和玉米每年施肥675.0 kg·hm-2复合肥,紫花苜蓿仅在建植前施入适量磷酸二铵和尿素。为保证良好的出苗率,适时人工喷灌,并择机进行补苗、间苗、定苗和除草等。冬小麦和夏玉米均按照关中地区的收获习惯适时收获,紫花苜蓿种植当年因长势较弱未刈割,第二年起在初花期留茬约5 cm的高度适时刈割。
1.3 土壤样品采集与测定方法
2019年9月25日分别采集各处理小麦、玉米和紫花苜蓿根际土壤样品。去除土壤表层凋落物后,用铁锹和土钻在每小区对角线上间隔50 cm采集根际土壤样品,在各样地内采集3钻土样(0~20 cm),每3个采集样混合为一份土壤样品。将采集的土样带回实验室后,去除植物根系、石块等混合均匀后,一部分新鲜土样过10目(2.00 mm)筛,在4℃冰箱冷藏,用于土壤微生物量的测定;另一部分土壤样品自然风干后,过100目(0.15 mm)筛,用于土壤酶[14]等理化性质的测定。
在中国农业科学院农业环境与可持续发展研究所利用元素分析同位素质谱联用仪(vario PYRO cube)测定土壤稳定性同位素碳(δ13C)、同位素氮(δ15N)及TC、TN含量。采用氯仿熏蒸浸提法测定土壤微生物碳(Microbial biomass carbon,MBC)、微生物氮(Microbial biomass nitrogen,MBN)、微生物磷(Microbial biomass phosphatase,MBP)含量[15]。采用3,5-二硝基水杨酸比色法[16]测定蔗糖酶(Sucrase,SUC),37℃培养24 h后1 g土壤中葡萄糖的质量(mg)表示其活性;采用苯酚钠比色法[15]测定脲酶(Urease,UR),37℃培养24 h后以1 g土壤中NH3-N的质量(mg)表示其活性;采用磷酸苯二钠比色法[20]测定碱性磷酸酶(Alkaline phosphatase,AP)和中性磷酸酶(Neutral phosphatase,NP),37℃培养24 h后1 g土壤中释放的酚的质量(mg)表示其活性。
1.4 数据处理与分析
采用Microsoft Excel 2019软件进行数据整理,SPSS 19.0软件进行单因素方差分析(One-Way ANOVA)和最小显著差异(LSD)检验,R语言及Origin 2020软件进行相关性分析、冗余分析(RDA)和热图(heatmap)制作。
2 结果与分析
2.1 不同处理下作物及牧草根际土壤TC、TN的变化
由表1可知,单播模式下,紫花苜蓿根际土壤TN含量最高达1.31 g·kg-1,较小麦和玉米根际土壤TN含量显著提高了12.02%和5.30%(P<0.05);小麦根际土壤TC最低达15.55 g·kg-1,紫花苜蓿和玉米根际土壤TC含量分别较小麦显著提高了10.23%和11.48%(P<0.05)。紫花苜蓿与玉米套种模式下土壤TC和TN含量均比其单播要高,但在土壤TC含量中差异不显著(P>0.05),仅与玉米相比显著提高了TN含量(P<0.05)。

表1 作物及牧草根际土壤TC、TN的变化Table 1 Soil total carbon and nitrogen characteristics in rhizosphere soils of crops and pasture
2.2 不同处理下作物及牧草根际土壤C、N稳定同位素的特征
由图1可知,不同处理下作物及牧草根际土壤δ13C数值在-20‰~-16‰之间波动,小麦根际土壤δ13C数值显著低于其它处理(P<0.05)。根际土壤δ15N数值在2‰~8‰之间波动,变化幅度略高于δ13C。紫花苜蓿根际土壤δ15N高达8‰,其余各处理根际土壤δ15N由高到低的顺序依次是AM>M>W,与传统单一的谷物种植模式相比,基于豆科饲草复合生态型种植模式对土壤δ15N的影响较大。
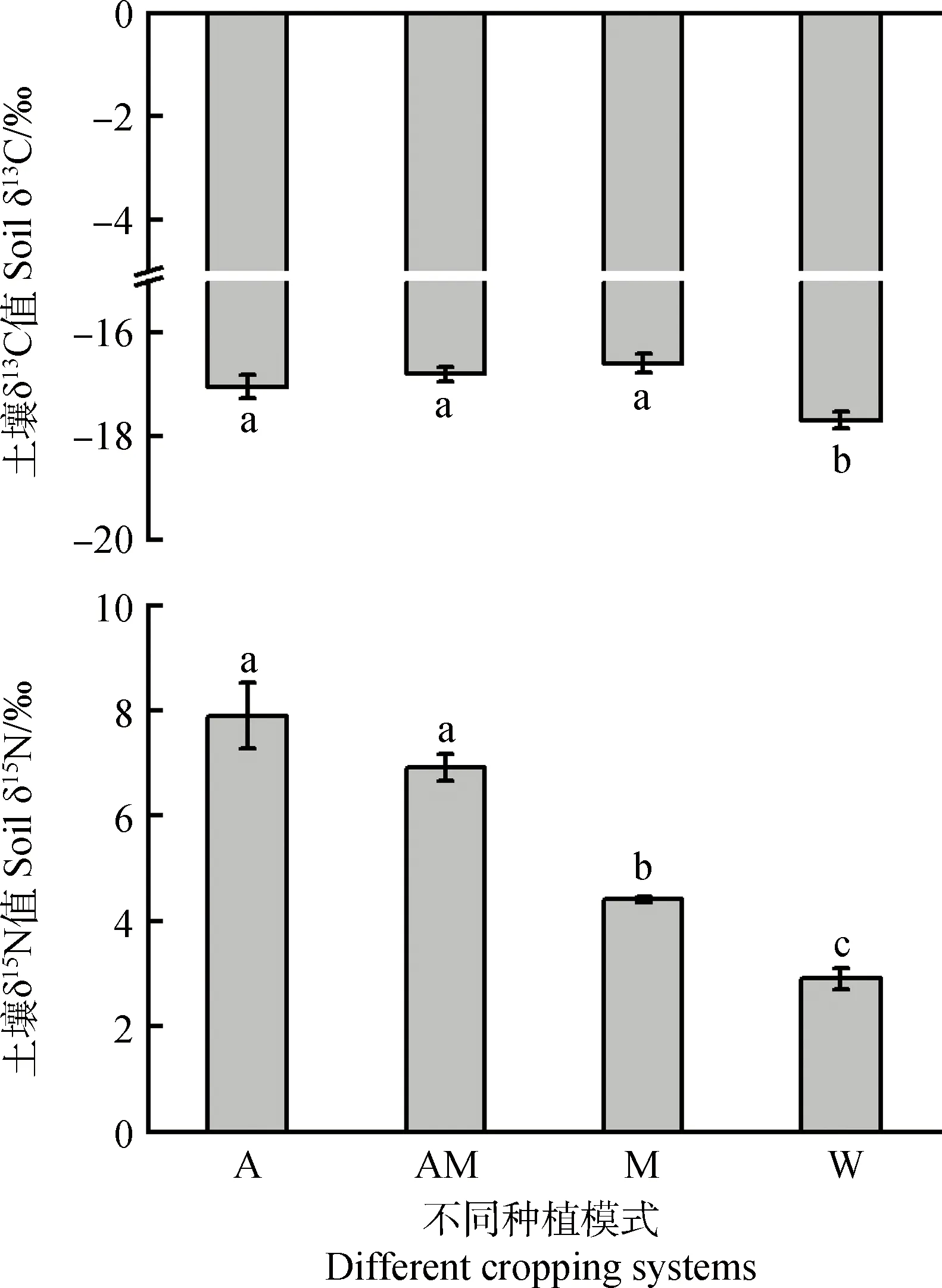
图1 作物及牧草根际土壤C、N稳定同位素的特征Fig.1 Carbon and nitrogen isotope abundance characteristics in rhizosphere soils of crop and pasture注:不同小写字母表示差异显著(P<0.05)Note:Different lowercase letters indicate significant difference at the 0.05 level
2.3 作物及牧草根际土壤微生物生物量特征
根际土壤微生物量C、N和P对各处理的响应如表2所示,各处理下,作物及牧草根际土壤MBC由高到低的排列依次是AM>A>M>W,且W处理与其它各处理差异显著(P<0.05),这说明较传统的谷物种植,基于豆科牧草的种植有利于MBC的积累和提高。MBN在玉米根际土壤最低为8.30 mg·kg-1,在小麦根际土壤中最高为22.29 mg·kg-1。MBP在作物和饲草根际土壤中由低到高的顺序依次是M>W>AM>A,且MBN和MBP对各处理的响应规律相反。

表2 作物及牧草根际土壤微生物生物量特征Table 2 Microbial biomass characteristics in rhizosphere soils of crop and pasture
2.4 作物及牧草根际土壤酶活性
如表3所示,单播模式下,紫花苜蓿根际土壤中蔗糖酶、脲酶和中性磷酸酶含量最高,分别为3.65,0.34和12.26 mg·kg-1·d-1,而在小麦根际土壤中最低,分别为2.56,0.34和10.74 mg·kg-1·d-1。蔗糖酶、脲酶和中性磷酸酶中对各处理的响应较为一致,即A>AM>M>W。此外,小麦根际土壤中碱性磷酸酶的活性最低,但在玉米中却最高,为6.97 mg·kg-1·d-1;紫花苜蓿与玉米套种模式下脲酶的活性为0.35 mg·kg-1·d-1,与单播小麦差异显著(P<0.05),但是与单播的苜蓿和玉米差异不显著。

表3 作物及牧草根际土壤酶活性Table 3 Enzyme activities in rhizosphere soils of crop and pasture
2.5 相关性与冗余分析
土壤TC与δ15N、MBC和NP呈极显著正相关(P<0.01),与δ13C和SUC呈显著正相关(P<0.05),与MBN呈极显著负相关关系(P<0.01);土壤TN与δ15N、MBC、SUC和NP呈极显著正相关(P<0.01),与UR呈显著正相关(P<0.05)。MBC与SUC、NP呈极显著正相关(P<0.01),与MBN呈极显著负相关关系(P<0.01);MBN与MBP、AP呈极显著负相关关系(P<0.01)(图2)。冗余分析(RDA)结果表明:土壤C、N含量解释了土壤酶活性变化的50.86%,微生物生物量解释了土壤酶活性变化的69.81%(图3),表明作物及其牧草根系可通过土壤养分及微生物影响土壤酶活性的变化,从而影响土壤内营养物质的循环与利用。
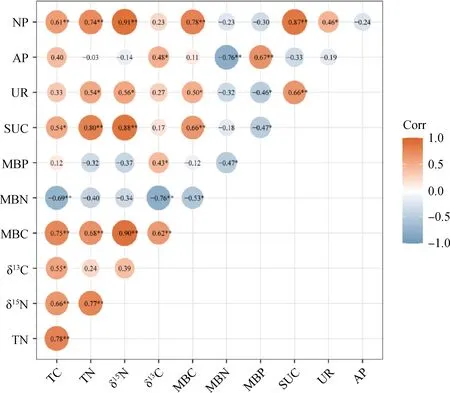
图2 土壤养分、微生物量和酶活性之间的相关性分析Fig.2 Correlation analysis between soil nutrients,microbial biomass and enzyme activities注:数字为相关系数;*表示相关关系显著(P<0.05);**表示相关关系显著(P<0.01);红色代表正相关和蓝色代表负相关,通过颜色深浅和圆形大小来显示相关程度Note:The number is the correlation coefficient;* and ** indicate significant difference at the 0.05 and 0.01 level,respectively;red for positive correlation and bule for negative correlation,showing the degree of correlation by color depth and the size of the circle
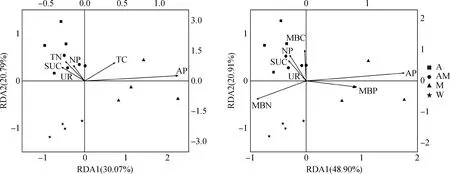
图3 土壤养分、微生物量和酶活性之间的冗余分析Fig.3 Redundancy analysis among soil nutrients,microbial biomass and enzyme activities
3 讨论
研究表明,在黄土高原地区持续种植4~5年春小麦、玉米和土豆(SolanumtuberosumL.)等一年生作物后,土壤中C、N含量明显降低[7]。本研究结果也表明,关中地区连作四年小麦和玉米后作物根际土壤C、N含量均比紫花苜蓿明显降低。一方面,传统农业种植过程中化肥的投入抑制了土壤微生物、影响了土壤酸碱度,减少了团聚体的形成[1];另一方面,频繁的耕作及其残茬去除不但破坏了土壤结构,还减低了有机营养物质输入[7]。C4植物光合C同化能力及N素吸收效率均比C3植物强,因此C4植物通过根系等向土壤输入的C,N营养物质相对较多[17],故而玉米根际土壤的C,N含量往往高于小麦,这与我们的预期是一致。本研究中紫花苜蓿根际土壤中C,N含量较高,这说明来源于豆科植物的N是维持土壤肥力的主要来源[18],且黄土高原地区紫花苜蓿有助于增加土壤肥力等[7],潜在原因是由于豆科植物的残茬,根系分泌物、根瘤凋落物等具有含N量高和C/N低的特征,在土壤中分解较快,易于降解,有助于土壤团聚体的形成和土壤C,N含量的显著提升[17-18]。其次,多年生豆科牧草生长季长,发达的根系网络、较少的土壤扰动等增强了土壤C,N的沉降能力[3]。因此,基于多年生豆科牧草的种植是一项增加农田土壤中C储量,应对气候变化和构建可持续的农业生物系统的一项重要策略[1]。
土壤δ13C能够估算土壤C的来源[19]、土壤C库的变化[20]和地上植被功能类群的改变等[21]。绿色植物的光合作用在羧化阶段能够同化原子量较低的12C,排斥原子较大的13C同位素[19],因此C3植物的δ13C大约在-28‰,而C4植物约在-14‰[22],这在一定程度上解释了本研究中玉米根际土壤δ13C较高的原因。与紫花苜蓿单播相比,紫花苜蓿与玉米的套种有提高根际土壤δ13C的趋势,可能是由于套种模式下土壤C库中来自玉米富集13C的C源在增加[23]。本研究中冬小麦根际土壤中δ13C较低,可能因为土壤C的来源主要是植物组织而不是微生物生物量[24]。土壤δ15N反应了土壤N的输入、转化和循环等[25]。研究表明,土壤δ15N与环境因子的变化,土壤水分和N素有效性显著相关[26]。本研究也证实了土壤δ15N与土壤N素有效性显著正相关,且紫花苜蓿及其与玉米的套种模式下δ15N的数值比较高。较高的土壤δ15N可能是对土壤N饱和的一种反应,在土壤N浓度较高的情况下,较轻的14N同位素优先通过淋溶、氨化,反硝化作用等产生15N贫化的气体(NO,N2O和N2),输出生态系统,导致土壤库中15N富集[26]。其次,秋季关中地区紫花苜蓿及其与玉米的套种模式下土壤水分相对玉米和冬小麦较高,充足的水分调整了土壤中分解者种群,增加了反硝化作用N的损失[27],故而增加了土壤δ15N[28]。此外,由于植物根际及其分泌物等存在扩散效应,导致根际土壤δ15N比非根际高,且植物根部渗出物种15N的含量高[25],推测这可能也是本研究中豆科牧草及其套种模式根际土壤δ15N较高的一个重要原因。然而,农田生态系统中土壤δ13C和δ15N信号变化是相当复杂的,后续的研究应深入阐明生长年限、土壤深度和栽培管理措施等对其的调控机制。
土壤C,N含量与土壤微生物、土壤酶活性是紧密联系的[29-30],共同参与调控了土壤营养物质的循环与利用的全过程[30]。本研究中冬小麦根际土壤微生物生物量C、蔗糖酶和中性磷酸酶活性较低,但紫花苜蓿单播及其套种模式下相对较高。这可能是由于紫花苜蓿庞大的根系能够固持更多土壤水分[31],分泌有机酸和脱落的根瘤调整了土壤微生物的种群[29],提高了微生物生物量和酶活性等。此外,豆禾套种增加了禾本科侧根的生物量[32],增加的根系生物量通过根沉积、呼吸或根系衰老等方式,增加了土壤微生物C[10-33],提高了土壤酶和微生物的活性等[30]。虽然,微生物生物量涉及到有机质的降解及其植物残体中营养元素的释放与循环[34],但本研究中紫花苜蓿根系微生物生物量P含量偏低,而小麦根际土壤中微生物氮偏高,这可能是由于受到冬小麦施肥、种植年限和作物品种等影响的结果。
4 结论
紫花苜蓿根际土壤全氮(TN)、同位素氮(δ15N)、微生物生物量碳(MBC)、微生物生物量氮(MBN)及蔗糖酶(SUC)、脲酶(UR)和中性磷酸酶(NP)均显著高于小麦和玉米。此外,紫花苜蓿与玉米的套种下,根际土壤全碳(TC),TN和MBC显著高于单个作物连作。因此,从土壤理化性质的角度分析,关中地区落实“中央一号”文件和“粮改饲”等政策,有助于实现农业资源的高效利用与土壤的可持续生产。

