酿酒酵母表达侧耳源单基因生物合成麦角硫因
潘 涛,林金德,余颖豪,郭丽琼,2,林俊芳,2,
(1.华南农业大学食品学院,广东 广州 510642;2.广东省微生态制剂工程技术研究中心,广东 广州 510642)
麦角硫因(ergothioneine,EGT),又称2-巯基组氨酸-三甲基甜菜碱,最初由Chairles Tanret于1909年在麦角菌()中发现,是机体内重要的生物活性物质,广泛存在于生物体内,具有清除自由基、解毒、保护DNA免受金属离子的氧化损伤、维持细胞的正常生长和细胞免疫以及防止紫外线辐射损伤等多种生理功能。EGT是一种重要的天然抗氧化剂,有抗衰老、抗氧化、抗炎症等功能,与神经退行性疾病、抑郁症等精神疾病存在一定的关联,与人类健康息息相关,但人体自身不能合成EGT,只能通过膳食摄入。EGT在制药、生物医学、化妆品和食品等领域展现出良好的应用前景。
生物合成法新近发展起来的利用多基因组合表达的高效生物制备方法,可以通过代谢调控等发酵过程控制手段有效地通过异源合成提高EGT产率。近年来,科学家们对EGT合成途径的研究发现耻垢分枝杆菌EGT合成途径有5 个合成酶基因(~),但是分枝杆菌等条件致病菌的EGT基因来源存在一定的安全隐患,同时基因数目较多等导致产业化生产的难度较大。后来有研究者发现粗糙脉孢菌()EGT生物合成途径有2 个基因,即和,其中中的C—S裂解过程已被解析。Pluskal等从粟酒裂殖酵母()中挖掘出1 个与同源性较高的基因和4 个与C—S键断裂相关()的基因,通过基因敲除验证前者参与EGT的合成,而后者4 个基因中只有1 个参与了EGT的合成。本课题组在食用菌生物合成EGT方面已取得一定的研究成果并克隆得到金针菇和灰树花的EGT合成途径基因,在金针菇中有3 个基因(、和),在灰树花中有两个基因(和)。相比于耻垢分枝杆菌等原核细菌,真菌具有更加简洁的EGT生物合成途径,为EGT的代谢工程大规模化生产提供了便捷的手段。目前,EGT相关合成酶应用于EGT的生产相对较少,因此,进一步挖掘EGT合成酶基因将有利于寻找催化活性更好的EGT合成酶,从而提高EGT的产量,推动EGT产业的发展。
大多数侧耳属食用菌可以产EGT,但其相关合成酶尚未被挖掘和通过代谢工程应用于EGT的生产。故本实验拟结合生物信息学分析等方法,挖掘、克隆侧耳属EGT相关合成酶基因,并进行功能鉴定,致力于寻找更加高效的EGT合成酶,促进我国EGT产业的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
平菇()、白灵菇()、杏鲍菇()购自山东省寿光市食用菌研究所;大肠杆菌DH5a、酿酒酵母EC 1118、pYES 2载体、酿酒酵母表达载体pRS42K均由本实验室保存;pCloneEZ-TOPO克隆载体购自上海唯地生物技术有限公司。
1.1.2 试剂与培养基
酶、PrimerSTAR Max Premix(2×)、限制性核酸内切酶R I 宝日医生物技术(北京)有限公司;质粒小量提取试剂盒、琼脂糖凝胶DNA回收试剂盒等南京诺唯赞生物科技股份有限公司;反转录试剂盒Script One-Step gDNA Removal and cDNA Synthesis SuperMix 北京全式金生物公司;引物和DNA测序由广州天一辉远基因科技有限公司完成。
LB(Luria Broth)培养基:胰蛋白胨10 g/L,酵母提取粉5 g/L,NaCl 10 g/L(固体培养基则加入2%琼脂粉),121 ℃高压灭菌30 min,抗性筛选时加入氨苄青霉素使其最终质量浓度为100 mg/L。酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母提取粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L(固体培养基则加入2%琼脂粉),115 ℃高压灭菌15 min,抗性筛选时加入G 418硫酸盐使其最终质量浓度为100 mg/L。马铃薯葡萄糖(potato dextrose broth,PDB)培养基:取去皮土豆200 g的沸水提取物(煮沸30 min至土豆变软),称取20 g葡萄糖、1.5 g MgSO·7HO、3 g KHPO,加蒸馏水定容至1 000 mL,自然pH值,121 ℃灭菌30 min。
1.2 仪器与设备
LC-2030高效液相色谱(high performance liquid chromatography,HPLC)仪 日本株式会社岛津制作所;电击转化仪 美国Bio-Rad公司;JY92-2D超声波破碎仪 宁波新芝生物科技股份有限公司;YX-280D手提式压力蒸汽灭菌锅 合肥市华泰医疗设备有限公司。
1.3 方法
1.3.1 侧耳属EGT合成途径基因序列的挖掘
利用已报道的粗糙脉孢菌EGT生物合成酶(NCU04343)、金针菇、灰树花通过NCBI数据库BLASTp和BLASTn,比对搜索侧耳属食用菌平菇、白灵菇和杏鲍菇的假定EGT合成酶基因,分别命名为、和。
1.3.2 侧耳属基因的克隆
将平菇、白灵菇和杏鲍菇接种于PDB培养基中进行振荡培养,取新鲜的菌丝球用STE法进行总RNA的提取。采用全式金公司的Script One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒将总RNA反转录成cDNA。设计引物,以反转录产物cDNA为模板,采用高保真酶PrimerSTAR Max Premix(2×)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增产物回收纯化后,按pCloneEZ-TOPO克隆载体试剂盒方法连接到TOPO载体,转化至大肠杆菌DH5a感受态细胞中,挑取转化子进行菌落PCR鉴定,将鉴定正确的转化子送往广州天一辉远基因科技有限公司测序。克隆侧耳属基因所用引物如表1所示。

表1 Egt 1克隆引物Table 1 Primer sequences used for Egt 1 cloning
1.3.3 侧耳属的生物信息学分析
将侧耳属Egt 1蛋白氨基酸序列上传至ExPASProtParam tool(http://web.expasy.org/protparam/),对其进行理化性质分析;再将氨基酸序列上传至SWISS MODEL(https://swissmodel.expasy.org/)中,通过同源模板比对建模,进行蛋白质三级结构预测。
1.3.4 表达载体pRS42K---构建
以pRS42K和pYES 2质粒为模板,用高保真酶PrimerSTAR Max Premix(2×)扩增出带pRS42K同源臂的启动子和终止子,以测序正确的基因pCloneEZ-TOPO克隆载体质粒为模板,扩增基因并在上下游加上启动子和终止子的同源臂,通过重叠延伸组建成一个表达框--,采用Clone ExpressII One Step Cloning Kit同源重组试剂盒将加同源臂的--表达框重组到线性化的pRS42K载体上并转化至大肠杆菌DH5α感受态细胞中,挑取转化子进行菌落PCR鉴定,将鉴定正确的转化子送往广州天一辉远基因科技有限公司测序。
1.3.5 酿酒酵母EC 1118感受态的制备、转化和鉴定
大量提取测序正确的pRS42K---大肠杆菌转化子质粒,并转化至酿酒酵母EC1118中。酿酒酵母感受态的制备和电转化参考Zhang Yueping等的方法进行,转化结束后将菌液涂布于含100 μg/mL G 418的YPD平板,30 ℃培养2 d,挑取转化子进行菌落PCR鉴定。
1.3.6 酿酒酵母的发酵培养
种子液的制备:将成功构建的酿酒酵母工程菌株接种于50 mL含100 μg/mL G418的YPD液体培养基中,30 ℃、200 r/min过夜预培养。按照1%的接种量将构建成功的酿酒酵母工程菌液种子液接种到50 mL含100 μg/mL G418的YPD液体培养基中,30 ℃、220 r/min培养16 h。
1.3.7 酿酒酵母中平菇PoEgt 1重组酶体外酶活性测定
发酵结束后用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)分别洗涤收集细胞,将平菇的工程菌株混匀在10 mL PBS中,加入反应底物以控制最终浓度为:0.02 mol/L组氨酸、0.02 mol/L半胱氨酸、0.005 mol/L-腺苷蛋氨酸、0.01 mol/L Fe、0.005 mol/L磷酸吡哆醛。混匀,超声破碎菌体,破碎条件:功率33%,约250 W;总超声时间6 min,工作3 s,间隔3 s,报警温度40 ℃。超声结束后,将反应体系放置在36 ℃反应2 h,期间每隔20 min混匀一次。反应产物利用0.22 μm水系滤膜过滤后用于HPLC检测。
HPLC测定条件:色谱柱采用月旭(Welch)公司的UltimateHILIC Amphion II(4.6 mm×150 mm,5 μm),检测波长257 nm,流速1 mL/min,流动相(乙腈∶水=80∶20),单次样品分析采集时间30 min,对照组设置为酿酒酵母EC 1118正常菌株。利用1.5、3、6、12 mg/L的EGT标准品溶液进行EGT标准曲线的制作。
1.4 数据处理
发酵实验做3 次平行,测定EGT含量取平均值,利用Excel 2019软件进行数据处理;核酸及氨基酸序列同源性比对采用DNA MAN 8软件。
2 结果与分析
2.1 侧耳属Egt 1基因的挖掘分析和克隆
利用粗糙脉孢菌、金针菇和灰树花核酸序列及氨基酸序列,运用BLASTp和BLASTn进行比对得到平菇中的相似性较高的蛋白假定蛋白PLEOSDRAFT_1058188(KDQ26018.1)、杏鲍菇中相似性较高的蛋白假定蛋白BDN71DRAFT_1511997(KAF9489594.1)和白灵菇基因组中相似度较高的核酸序列(序列ID为MKZX01000041.1,区域为78 985~82 124)。以cDNA为的编码序列扩增模板进行PCR扩增,扩增产物切胶回收后经1%琼脂糖凝胶电泳检测结果如图1所示,平菇、杏鲍菇和白灵菇条带大小约2 600 bp,片段大小符合。
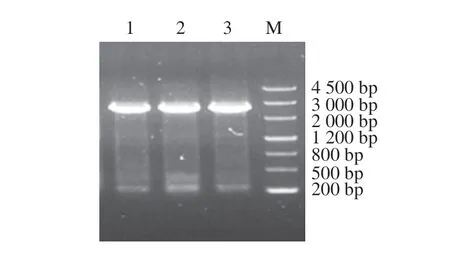
图1 Egt 1扩增凝胶电泳图Fig.1 Identification of Egt 1 by PCR
2.2 侧耳属Egt 1的生物信息学分析
2.2.1 侧耳属Egt 1蛋白的理化性质分析
通过ExPAS-ProtParam tool(http://web.expasy.org/protparam/)分别对所编码蛋白质进行理化分析得到结果如下:PoEgt 1、PtEgt 1、PeEgt 1蛋白大小分别为96.9、96.7、96.8 kDa,依次由853、855、854 个氨基酸组成,等电点pI分别为5.26、5.20、5.20,总亲水性的平均值依次为-0.509、-0.485、-0.455。亲疏水性中正值越大表示越疏水,负值越大表示越亲水,根据总亲水性的平均值分析结果可以看出侧耳属蛋白为亲水性蛋白。
2.2.2 侧耳属同源性比较
利用DNA MAN 8软件比较克隆后测序得到的核酸序列和蛋白氨基酸序列(氨基酸序列比对结果如图2所示),根据比对结果可知,从cDNA中克隆得到的杏鲍菇、平菇和白灵菇核酸序列同源性为97.03%,蛋白氨基酸序列同源性为97.93%。三者的核酸序列和氨基酸序列相似度极高,后续验证活性实验选取平菇进行。

图2 PoEgt 1、PeEgt 1、PtEgt 1氨基酸比对结果Fig.2 Alignment of amino acid sequences of PoEgt 1,PeEgt 1 and PtEgt 1
2.2.3 侧耳属Egt 1的结构及功能预测
利用Swiss-Model对Egt 1蛋白进行预测分析,分析结果显示,侧耳属Egt 1蛋白氨基酸序列能明显检测到与分枝杆菌中和的相似性。进一步利用Swiss-Model对侧耳属Egt 1进行三级结构预测,预测结果如图3所示,3 个蛋白的预测三维结构相似。再利用NCBI-Conserved Domains Search database对侧耳属Egt 1蛋白氨基酸序列进行保守结构域预测分析发现,侧耳属Egt 1可能含有2 个结构域,分别为甲基转移酶超家族结构域和硫酸酯酶超家族结构域。其中,甲基转移酶结构域被描述为组氨酸特异性甲基转移酶,拥有-腺苷甲硫氨酸依赖性,由分枝杆菌基因簇的一部分表达,即基因,可将3 个甲基转移至组氨酸的-氨基部分;硫酸酯酶超家族结构域对应Egt 1的后半部分,描述为硫酸酯酶修饰因子酶,该结构域存在于翻译后硫酸酯酶修饰SUMF1蛋白所需的真核蛋白中,其中基因编码甲酰甘氨酸生成酶,是一种硫酸酯酶,可能将半胱氨酸氧化成半胱氨酸亚硫磺,再催化成甲酰甘氨酸。
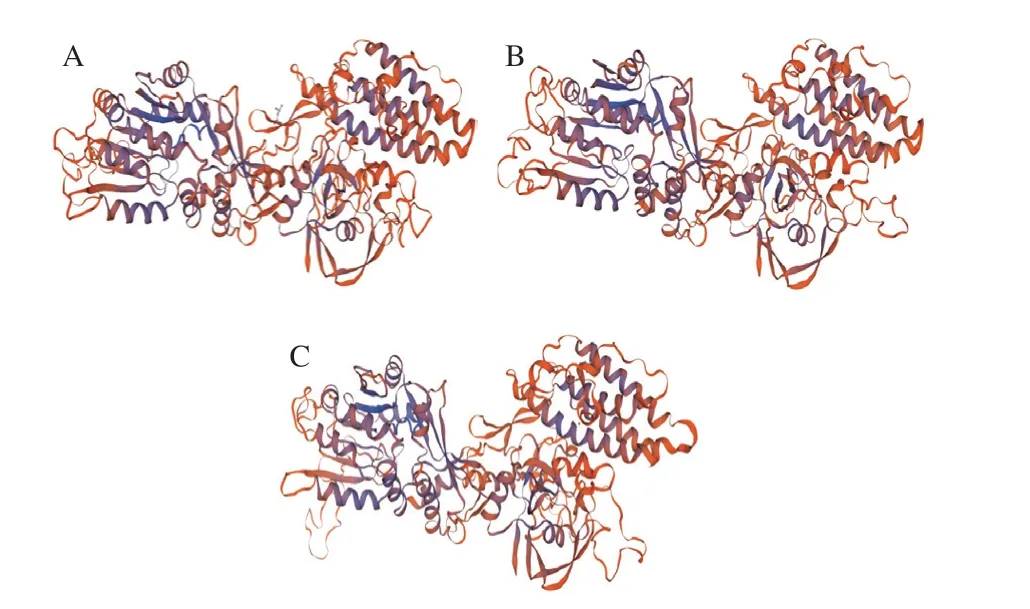
图3 PoEgt 1(A)、PeEgt 1(B)和PtEgt 1(C)三维结构图Fig.3 Structural diagram of PoEgt 1 (A),PeEgt 1 (B) and PtEgt 1 (C)
2.3 酿酒酵母PoEgt 1表达载体的构建
进行表达载体pRS42K---构建及转化,通过OEPCR得到的表达框--与线性化的pRS42K进行重组后转化至大肠杆菌DH5α,菌落PCR鉴定后送测序,测序结果正确,表达载体pRS42K--构建成功,提取质粒转化进酿酒酵母EC 1118中。
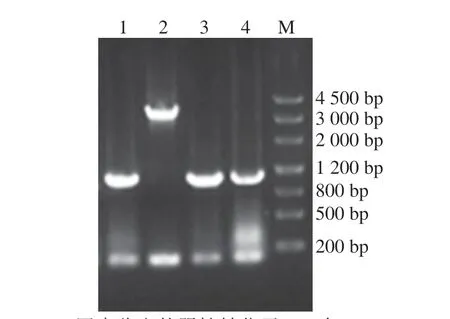
图4 酿酒酵母转化菌株pRS42K-TEF1p-PoEgt 1-CYC1t PCR鉴定Fig.4 PCR identification of S.cerevisiae transformants for strain pRS42K-TEF1p-PoEgt 1-CYC1t
2.4 酿酒酵母工程菌株EC 1118-42K-TEF1p-PoEgt 1-CYC1t发酵产物的检测
EGT标准曲线方程为=76 922-4 570.4,式中,为EGT质量浓度/(mg/L),为峰面积;相关系数=0.999 8,说明EGT在1.5~12 mg/L之间线性关系良好。
含表达质粒pRS42K---的酵母发酵培养后,破碎菌体酶促反应产物出现与标准品EGT出峰时间相同的吸收峰(图5),表明酶促反应体系中有EGT生成,产量为(2.5±0.08)mg/L。而酿酒酵母对照菌株EC 1118(培养时不加G 418抗生素)相同处理后HPLC检测没有出峰,即没有EGT生成,表明具有单基因生物合成EGT的功能。
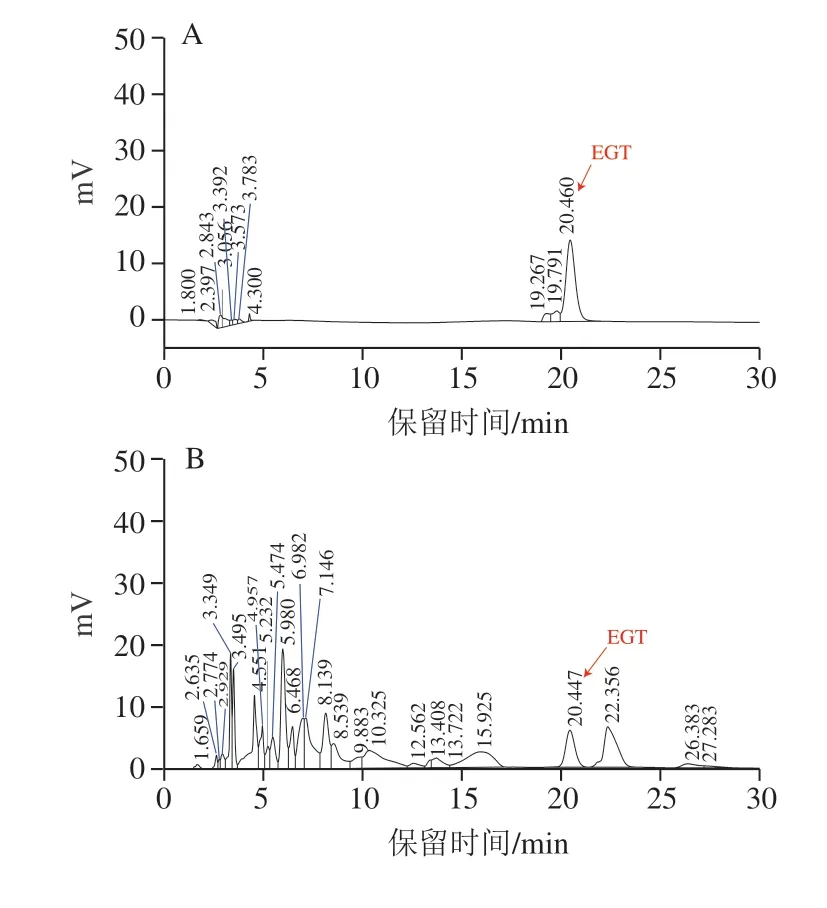
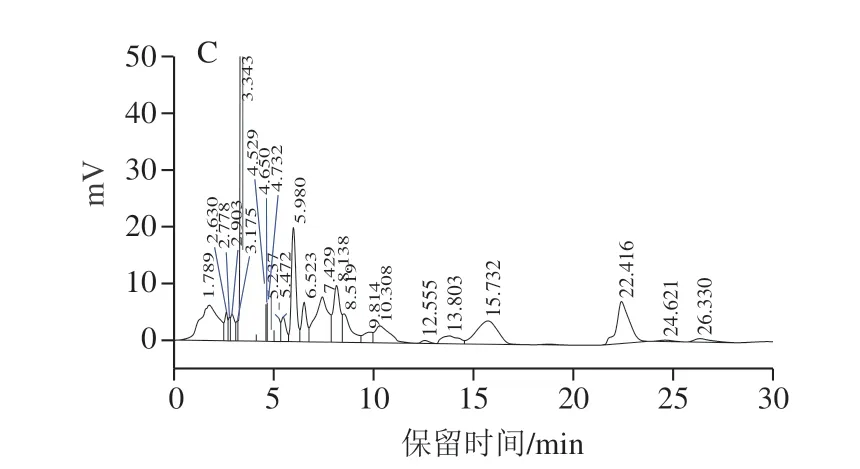
图5 EGT HPLC检测结果Fig.5 HPLC profiles of EGT from different sources
3 讨论
自1909年EGT被发现以来已有100多年,但是直到21世纪初才通过体外表征得出耻垢分枝杆菌EGT由五基因簇负责合成,其合成途径繁琐、基因数目过多导致异源表达时载体构建麻烦,同时过大的载体也会对菌体造成负担。后来发现真核生物粗糙脉孢菌、粟酒裂殖酵母等也能合成EGT,体内生物合成途径有2 个酶(Egt 1和Egt 2),这大大简化了EGT的生物合成途径,推动了异源合成EGT的进展,并证明了挖掘EGT合成酶基因新来源的重要性。
食药用菌中含有丰富的EGT,但目前对于食药用菌中EGT相关合成基因的研究鲜有报道。在灰树花中,甲基化形成的组氨酸甜菜在介导下可以与半胱氨酸反应形成C—S键,随后经过裂解C—S键脱去半胱氨酸生成EGT。在金针菇中,可催化组氨酸和半胱氨酸形成组氨酸甜菜碱半胱氨酸亚砜再在和的共同作用下将组氨酸甜菜碱半胱氨酸亚砜转化为EGT,而第一步在分枝杆菌中需要-的共同参与,合成途径繁琐。在粗糙脉孢菌中,只能催化组氨酸甜菜碱生成组氨酸甜菜碱半胱氨酸亚砜,而组氨酸如何转化为组氨酸甜菜碱还尚不清楚。本研究采用生物信息学分析软件和数据库进行侧耳属蘑菇EGT合成途径基因的挖掘、蛋白结构和功能的预测,克隆得到侧耳属EGT合成途径基因、和,在酿酒酵母中进行异源表达并检测到产物EGT,产量为(2.5±0.08)mg/L,证明了该基因具有单基因合成EGT的活性,丰富了EGT合成酶基因来源。进一步通过建模、功能预测等发现侧耳属Egt 1是由2 个功能结构域组成的酶,分别对应分枝杆菌中和的功能,主要介导组氨酸甲基化的形成和半胱氨酸C—S键的形成。许多大肠杆菌和酿酒酵母中本身就含有半胱氨酸脱硫酶,所以只需向含有半胱氨酸脱硫酶的工程菌中转入便可以获得EGT,这与本课题组前期关于灰树花的研究一致,还有待进一步挖掘、研究侧耳属EGT合成途径中的其他基因以及通过分子手段(如基因编辑技术等)对EGT代谢通路进行改造,更换启动子、运用整合型表达载体将EGT合成酶基因整合进酵母基因组中,提高其在异源表达宿主中的稳定性,再进一步通过发酵优化等手段提高EGT产量。

