源于Bacillus megaterium STB10的直链麦芽五糖生成酶酶学性质及其产物合成规律
韩 煦,班宵逢,李才明,顾正彪,李兆丰
(江南大学食品学院,江苏 无锡 214122)
直链麦芽低聚糖(maltooligosaccharide,MOS)是由3~10 个葡萄糖(G1)单元通过-1,4-糖苷键连接而成的链状低聚糖。其中,直链麦芽五糖(G5)由于其具有良好的加工适应性、较好的溶解度、适宜的甜度、较强的抗结晶性能及抑制淀粉回生能力等特性受到食品领域研究者的广泛关注。此外,G5在医疗健康领域还具有重要的应用,其可用作为精确测定人体尿液或血清中-淀粉酶活性的诊断试剂,及肾衰竭患者的膳食营养补充剂,在疾病诊断、营养补充等方面发挥着重要作用。
G5 的酶法生产主要利用直链麦芽五糖生成酶(maltopentaose-forming amylase,MFA)作用于淀粉的-1,4-糖苷键,生成以G5为主的MOS混合物,并在此基础上实现G5的分离与纯化。目前,MFA在细菌、嗜温和嗜热真菌中均有发现,其中,以在芽孢杆菌属中发现的MFA为主。例如:Yoshigi等从含有可溶性淀粉的培养基中分离出1 株可以产MFA的蜡状芽孢杆菌;Hmidet等发现了来源于A21的MFA。在此基础上,随着基因工程技术的发展,部分研究者尝试对MFA的基因进行克隆测序,并构建其异源表达系统,以期实现MFA的工业化生产。如:Shida等利用大肠杆菌表达系统对来源于sp.KO8940的MFA进行了克隆表达,该酶水解活力可达到33.8 U/mL。
虽然先前的研究进行了许多尝试,但目前已被异源表达的MFA大多催化活力较低,还有待进一步提升。此外,这些MFA大多存在产物特异性差的问题,其水解淀粉后产物中G5的比例多集中在20%~40%之间,使得后续分离纯化成本增高,限制了G5的工业化应用。因此,急需筛选出具有良好产物特异性的MFA以满足G5的工业化生产。此外,天然菌株发酵生产MFA往往存在表达量较低、发酵周期长及安全性争议等问题,在食品、医药等领域的应用受到限制。因此,需要在筛选出应用性能优良基因的基础上,实现其在食品级枯草芽孢杆菌的规模化制备,从而为MFA的工业化应用奠定基础。
本研究筛选来源于巨大芽孢杆菌()STB10的()基因,前期研究显示其可能具有较高的产物特异性,构建该基因的枯草芽孢杆菌表达系统,实现MFA的胞外表达,并对其酶学性质及产物合成规律进行研究,以期为G5的酶法制备提供理论依据。
1 材料与方法
1.1 材料与试剂
巨大芽孢杆菌STB10、大肠杆菌JM109、枯草芽孢杆菌WB600、枯草芽孢杆菌-大肠杆菌穿梭质粒pST均保藏于本实验室。
限制性内切酶I、DNA上样缓冲液、核酸染色剂NA-Red、Tris乙酸盐乙二胺二乙酸(Tris acetate-ethylene diamine tetraacetic acid,TAE)缓冲液(50×)、琼脂糖、DNA Ladder、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒、SDS-PAGE蛋白上样缓冲液、蛋白质分子质量标准、Bradford蛋白浓度测定试剂盒 上海碧云天生物技术研究所;Prime STAR HS DNA聚合酶、聚合酶链式反应(polymerase chain reaction,PCR)扩增Buffer 大连TaKaRa公司;质粒小量提取试剂盒、超级感受态制备试剂盒、硫酸卡那霉素、透析袋 生工生物工程(上海)股份有限公司;酵母粉、胰蛋白胨 英国Oxoid公司;直链麦芽三糖(G3)、直链麦芽四糖(G4)、直链麦芽五糖(G5)、直链麦芽六糖(G6)、直链麦芽七糖(G7)标准品 日本Hayashibara生物化学研究所;直链麦芽八糖(G8)、直链麦芽九糖(G9)标准品 法国Elicityl公司;-淀粉酶 无锡杰能科生物工程有限公司;-淀粉酶 大连美仑生物技术有限公司;马铃薯直链淀粉和支链淀粉 上海Sigma-Aldrich公司;其他试剂均为进口或国产分析纯。
1.2 仪器与设备
ProFlexPCR系统 美国ABI公司;WD-9413B凝胶成像分析仪 北京市六一仪器厂;RJ-LD-50G低速大容量立式离心机 上海生析超生仪器有限公司;Centrifuge 5424台式高速离心机 德国Eppendorf公司;Mini Protein 3蛋白电泳系统 美国Bio-Rad公司;AKTA primeplus蛋白质纯化系统 美国通用电气公司;FE28-Standard pH计 瑞士Mettler-Toledo公司;ZQZY-70BS空气恒温摇床 上海知楚仪器有限公司;UV2450紫外-可见光分光光度计 日本Shimadzu公司;SW22恒温水浴摇床、TW12恒温水浴槽 德国Julabo公司;GI54T高压灭菌锅 美国Zealway仪器有限公司;BPH-9042恒温培养箱 上海一恒科学仪器有限公司;SWCJ-2FD净化工作台 苏州净化设备有限公司;GenPure UV-TOC/UF Xcad plus型超纯水仪、905超低温冰箱、高效阴离子交换色谱(high performance anion-exchange chromatography with pulsed amperometric detector,HPAEC-PAD)系统 美国Thermo Scientific有限公司。
1.3 方法
1.3.1的克隆、表达及酶纯化
以巨大芽孢杆菌STB10基因组DNA为模板,以F和L为引物,PCR扩增出线性基因片段,使用碧云天I试剂盒对PCR产物进行消化。以质粒pST及消化后的线性片段为模板,以F和L为引物,PCR扩增出线性基因片段pST/。将消化后的pST/转化到大肠杆菌JM109中培养富集,提取质粒测序验证。将测序正确的质粒pST/转化感受态枯草芽孢杆菌WB600,即得到能够表达MFA的基因工程菌枯草芽孢杆菌WB600(pST/)。PCR体系参考Jiang Haimin等的方法。引物设计如下:F:5’-TTCAGCCCTGCCCAGGCCGATACAGTTAAC AATGGAACGCTAATGCA-3’,L:5’-GCCTATCCC TCACGCCTTACCTCTGGACATATATAGAAACTGAT CC-3’;F:5’-TTCAGCCCTGCCCAGGCC-3’,L:5’-GGCCTGGGCAGGGCTGAA-3’。
将活化后的基因工程菌枯草芽孢杆菌WB600(pST/)种子液以2%(/)比例接种到TB发酵培养基(酵母粉4 g/L,胰蛋白胨12 g/L,甘油5 g/L,KHPO2.32 g/L,KHPO•3HO 16.43 g/L;pH 7.0;含有20 μg/mL硫酸卡那霉素)中,于25 ℃发酵60 h后收集发酵液,4 ℃、10 000×离心15 min,收集上清液即得到MFA的粗酶液。采用疏水层析和离子交换层析对粗酶液进行分离纯化。疏水层析使用HiTrap Phenyl HP柱,缓冲液A1为10 mmol/L Tris-HCl(pH 7.0),缓冲液B1为含有10%(/)饱和(NH)SO溶液的10 mmol/L Tris-HCl溶液(pH 7.0),粗酶液加入终体积分数为10%的饱和(NH)SO溶液待纯化。在2 mL/min流速下,用5~6 个柱体积的缓冲液B1平衡疏水柱;预处理后的粗酶液上样流速为2 mL/min;之后先用6~8 个柱体积的缓冲液B1平衡疏水柱,再分别用体积分数0%~100%的缓冲液A1、超纯水、0.5 mmol/L NaOH溶液进行梯度洗脱,流速为1 mL/min。离子交换层析采用强阴离子HiTrap Q-HP柱,缓冲液B2为含有1 mol/L NaCl的10 mmol/L Tris-HCl(pH 7.0),并将经疏水柱纯化后含有目的蛋白的组分置于4 ℃在缓冲液A1中透析48 h。在2 mL/min流速下,用5~6 个柱体积的缓冲液A1平衡强阴离子柱;预处理后的一步纯化酶液上样流速为2 mL/min;之后先用6~8 个柱体积的缓冲液A1平衡强阴离子柱,再分别用体积分数0%~100%缓冲液B2、超纯水与10 mmol/L NaOH溶液进行洗脱。收集各洗脱组分测定酶活力和SDS-PAGE验证。
1.3.2MFA催化活力的测定
M FA 催化活力的测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法,参考Xie Xiaofang等方法并适当修改。用NaHPO-NaHPO缓冲液(10 mmol/L,pH 7.0)配制1 g/100 mL可溶性淀粉为底物,反应体系为0.1 mL酶液和0.9 mL底物,反应温度50 ℃,反应时间15 min。通过葡萄糖标准曲线计算体系中还原糖含量,以每分钟生成1 μmol还原糖(以葡萄糖计)所需的酶量定义为1 个酶活力单位(U)。
1.3.3MFA最适反应温度及热稳定性的分析
通过测定不同温度梯度下MFA的催化活力及不同温度保温一定时间下的残余酶活力,以分析MFA最适反应温度及热稳定性。
1.3.4MFA最适反应pH值及pH值稳定性的分析
使用不同pH值缓冲液(CHO-NaCHO缓冲液(10 mmol/L,pH 3.0~6.0)、NaHPO-NaHPO缓冲液(10 mmol/L,pH 6.0~8.0)、甘氨酸-NaOH缓冲液(10 mmol/L,pH 8.0~12.0))配制1 g/100 mL可溶性淀粉底物,于50 ℃测定MFA水解活力以分析酶的最适反应pH值。使用不同pH值缓冲液稀释MFA,并将酶液于4 ℃静置3 h后,于50 ℃测定残余酶活力以分析MFA的pH值稳定性。
1.3.5 金属离子对MFA活力及热稳定性的影响
参考相关文献,金属离子及EDTA浓度为0.5 mmol/L,设置不添加金属离子保温的酶液作为对照组。
1.3.6MFA动力学性质
参考相关文献,根据Bradford的方法,使用上海碧云天的Bradford蛋白浓度测定试剂盒说明书测定MFA浓度,并以牛血清白蛋白作为标准品绘制标准曲线。底物为NaHPO-NaHPO缓冲液(10 mmol/L,pH 7.0)配制的0.1~10 mg/mL马铃薯直/支链淀粉溶液,MFA对直/支链淀粉的催化活力测定条件及方法如1.3.2节所述。采用Lineweaver-Burk双倒数法计算MFA的米氏常数()、最大反应速率()、催化常数()和催化效率(/)等动力学参数。
1.3.7MFA反应模式分析
参考文献[34-36]的方法并适当修改,以-淀粉酶和-淀粉酶为对照,使用NaHPO-NaHPO缓冲液(10 mmol/L,pH 7.0)配制0.25 g/100 mL彻底糊化的马铃薯直链淀粉与支链淀粉溶液为底物。将0.2 mL酶液和1.80 mL底物在50 ℃反应不同时间后于沸水浴中加热30 min以终止反应。待反应体系冷却至室温后,取其中1.0 mL反应液稀释一定倍数,加入1.0 mL DNS溶液,采用1.3.2节方法计算还原糖含量。另取稀释适当倍数的0.3 mL反应液,加入4.0 mL碘液(0.05 g/100 mL KI、0.005 g/100 mL I,pH 7.5),振荡混合后避光静置15 min后在660 nm(以直链淀粉为底物)和530 nm(以支链淀粉为底物)波长处测定吸光度以计算体系碘蓝值。比较3 种酶水解淀粉底物时碘蓝值随还原糖含量的变化趋势。
1.3.8MFA产物特异性分析
样品制备:将10 U/g(以干基底物计)的MFA粗酶液与2%(/)麦芽糊精(DE4)底物溶液于40 ℃反应24 h后,取1 mL反应液于沸水浴中加热30 min灭酶,取上清液稀释一定倍数后过0.22 μm水系滤膜,用HPAECPAD分析产物含量。
HPAEC-PAD条件:CarboPac PA 200色谱柱,柱温35 ℃,流动相分别为1 mol/L NaAc、0.25 mol/L NaOH及超纯水,流速0.5 mL/min,进样量10 μL。单糖质量分数的计算如式(1)所示:

1.3.9MFA产物合成规律分析
通过探究MFA水解直/支链淀粉的产物组成分析底物对产物合成的影响。底物为预先糊化的0.25 g/100 mL马铃薯直/支链淀粉溶液(pH 7.0),向反应体系中加入20 U/g(以干基底物计)的MFA,于40 ℃反应不同时间后取样灭酶,制样方法同1.3.8节,用HPAEC-PAD测定MFA水解产物中单糖组分质量分数和底物转化率。底物转化率计算如式(2)所示:

1.4 数据处理与分析
使用Microsoft Office Excel 2019软件对数据进行初步处理,使用Prism graphpad 7.0软件作图;使用SPSS 23.0版本中的Student’s检验程序和单因素方差分析(ANOVA)对数据进行显著性分析(<0.05)。使用Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo)对序列进行比对,比对结果使用ESPript v3.0(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)作图。
2 结果与分析
2.1 BmMFA的表达、分离和纯化
食品级枯草芽孢杆菌无致病性,培养发酵条件简单、菌体易于生长繁殖,是MFA分泌表达较为理想的系统。前期实验中,已将目的基因克隆到大肠杆菌-枯草芽孢杆菌穿梭型质粒(pST质粒)中,并将该质粒转入到食品级枯草芽孢杆菌WB600中,获得基因工程菌枯草芽孢杆菌WB600(pST/)。
目前已报道的MFA发酵水平均不高,例如来源于GRS 313的MFA催化活力仅为98.3 U/mL。将基因工程菌枯草芽孢杆菌WB600(/)接种到TB发酵培养基中,于25 ℃培养60 h后,离心收集发酵上清液,测定其催化活力可达到196.57 U/mL,比活力达到588.54 U/mg,发酵上清液中蛋白含量为76.98 mg,表明MFA在枯草芽孢杆菌中成功进行了分泌表达,且发酵水平较高。采用疏水柱和强阴离子交换柱对粗酶液进行分离纯化,图1为MFA的SDS-PAGE验证结果,经两步纯化的目的条带相对分子质量大小与酶的理论分子质量(56 kDa)符合。MFA与其他来源的MFA氨基酸序列比对结果如图2所示。MFA的氨基酸序列与来源于sp.JAMB-204(JAMB,GenBank:
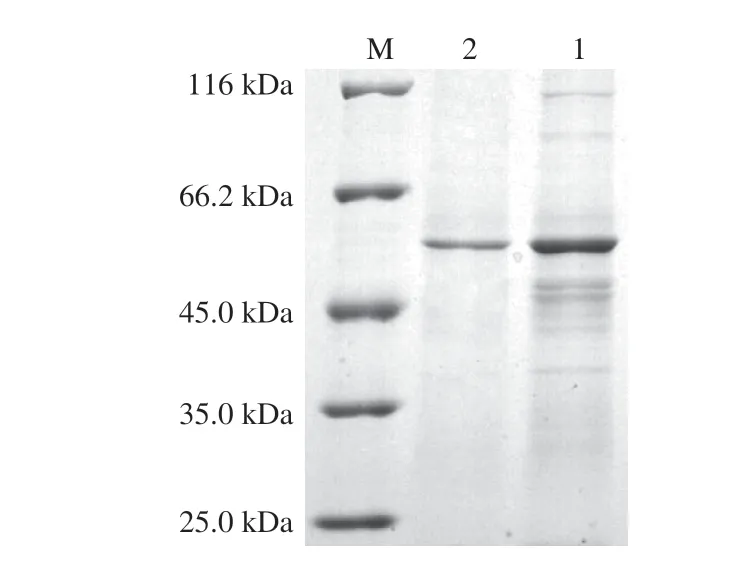
图1 BmM FA的SDS-PAGE分析Fig.1 SDS-PAGE analysis of BmMFA purified by hydrophobic chromatography or ion chromatography

图2 BmMFA与其他来源MFA氨基酸序列比对Fig.2 Amino acid sequence alignment of BmMFA with maltopentaose-forming amylases from other sources
BAF03567.1)、(,GenBank:AGK25234.1)、sp.(,GenBank:E24185.1)、sp.KO8940(KO,GenBank:BAA01600.1)及(,GenBank:AIV43244.1)的MFA相比对,氨基酸序列相似性为53.36%,表明其具有MFA的典型特征基因。
2.2 BmMFA的酶学性质分析
2.2.1 最适反应温度及热稳定性图3a结果表明,在不同的温度下,MFA催化活力呈现先上升后下降的趋势。在50 ℃时,MFA的催化活力达到最大值。酶的催化活力与反应温度密切相关,温度对酶的催化特性的影响主要体现在两方面:一方面可归属于热力学的正效应,当反应温度逐渐升高时,酶的催化位点逐步暴露,单位时间内酶与底物结合几率增大,酶的催化效率上升;随着温度的进一步提升,酶失活的负效应增强,底物对酶的保护作用不足以抵抗热变性作用,导致酶发生解折叠作用,表现为其催化活力的降低。50 ℃为该酶的正负效应达到平衡的温度,即该酶在50 ℃时具有最高的催化活力。
此外,还对MFA的热稳定性进行了研究,结果见图3b。随着温度的上升,MFA的热稳定性呈现下降的趋势,在酶的最适温度50 ℃时,该酶的半衰期约为30 min,与其他来源的MFA相比,其热稳定性还有待进一步提升。因此,在工业上应用MFA时,反应温度不宜过高。
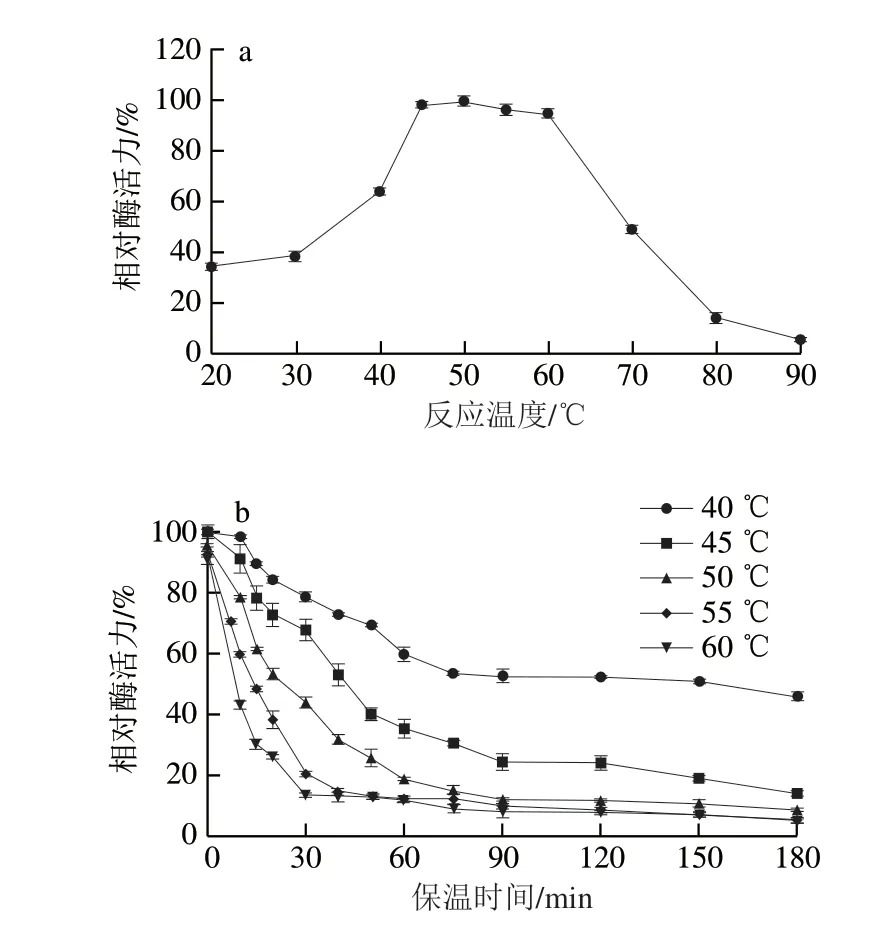
图3 BmMFA的最适反应温度(a)及热稳定性(b)Fig.3 Optimal reaction temperature (a) and thermostability (b) of BmMFA
2.2.2 最适反应pH值及pH值稳定性
图4a结果表明,在不同pH值下,MFA的催化活力和稳定性呈现先上升后下降的趋势,MFA的最适反应pH值为7.0。此外,研究还发现,相同pH值下,MFA在甘氨酸-NaOH缓冲液中的催化活力高于NaHPO-NaHPO缓冲液。这可能是由于甘氨酸-NaOH缓冲液中的甘氨酸增强了酶与底物的亲和力,并对酶分子构象具有一定的保护作用。
图4b结果显示,在pH 6~10下,MFA仍可保持超过80%的催化活力,表明其可适应较宽的pH值范围,且该酶对碱性环境的耐受性强于酸性环境的耐受性。在pH 7.0时,该酶可保持最高程度的稳定性,因此在工业上应用MFA时,适宜在pH值为中性的反应体系环境中。
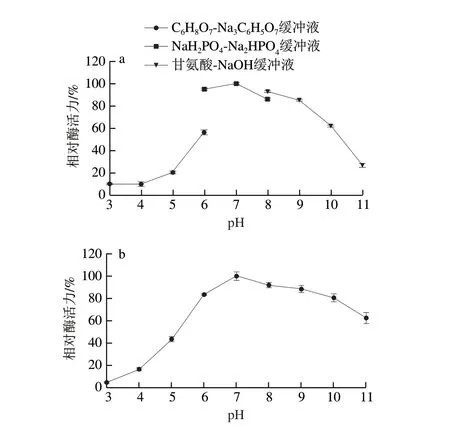
图4 BmMFA的最适反应pH值(a)及pH值稳定性(b)Fig.4 Optimal reaction pH (a) and pH stability (b) of BmMFA
2.2.3 金属离子对酶活力和热稳定性的影响
如图5所示,相比较于未添加金属离子的对照组,Fe、Mn、Cu、Zn显著降低了MFA的催化活力(<0.05),表明MFA对重金属离子较敏感。添加其他金属离子时,MFA的催化活力可保持在80%以上,这表明MFA具有相对较强的离子耐受性。不仅如此,少量Ca还具有激活MFA的作用,表现为Ca提升了MFA的催化活力。
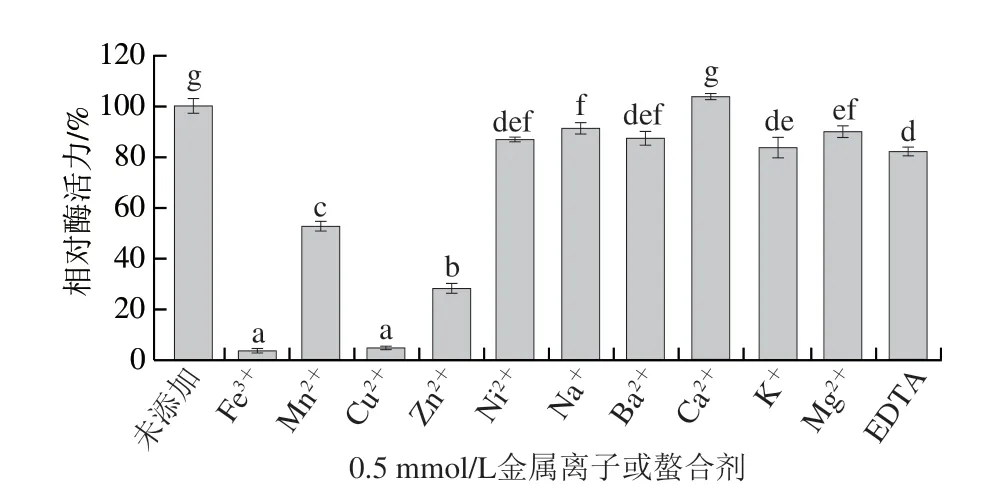
图5 金属离子或螯合剂对BmMFA活力的影响Fig.5 Effects of metal ions or EDTA on the activity of BmMFA
此外,实验还研究了Ca、Mg、Na对MFA热稳定性的影响,结果如图6所示。以未添加金属离子的酶为空白对照,0.5 mmol/L Ca使MFA在55 ℃的半衰期由13 min提高到15 min,而Mg、Na则降低了MFA的热稳定性。说明在实际生产MOS时,可以适当添加Ca以保证MFA的应用效果。
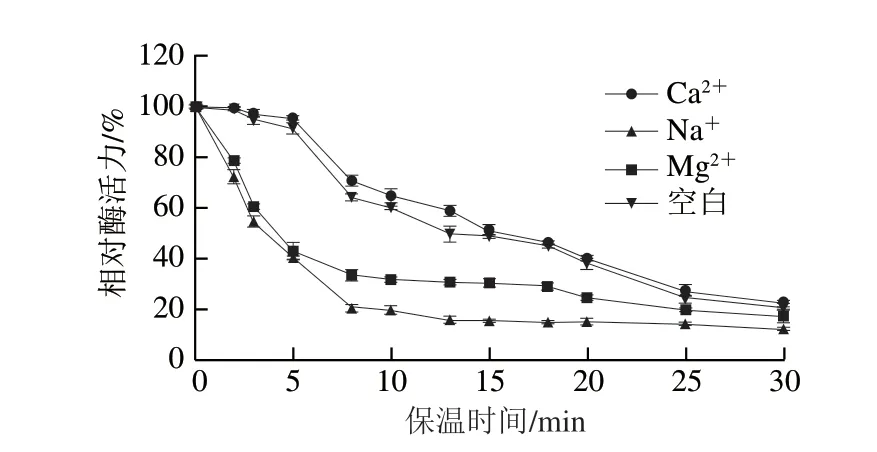
图6 金属离子对BmMFA热稳定性的影响Fig.6 Effects of metal ions on the thermostability of BmMFA
2.2.4MFA的动力学分析
分别以马铃薯支链淀粉和直链淀粉为底物,分析MFA的动力学性质,结果如表1所示。动力学参数及/分别代表酶对底物的亲和力及催化效率。结果显示,以支链淀粉为底物时,MFA的值远小于以直链淀粉为底物,说明MFA对支链淀粉的亲和力显著高于直链淀粉(<0.05)。此外,以支链淀粉为底物时,MFA的/值比以直链淀粉为底物时大,表明该酶对支链淀粉的催化效率更高。因此,在工业上应用MFA时,适宜选择支链淀粉含量相对较高的底物。

表1 BmMFA作用于直链淀粉/支链淀粉的动力学参数Table 1 Kinetic parameters of BmMFA with amylose/amylopectin as substrate
2.2.5MFA催化反应模式分析
MFA催化模式的分析将有利于深入了解MFA的作用方式,从而为工业化应用MFA提供指导。淀粉酶根据反应模式的差异一般被分为内切酶和外切酶两种。-淀粉酶作为一种典型的内切酶,可以随机作用于淀粉分子内部的-1,4-糖苷键,产生不同聚合度麦芽低聚糖和含有-1,6-糖苷键极限糊精的混合物,其碘蓝值快速下降。-淀粉酶是典型的外切酶,可以从淀粉的非还原末端开始水解淀粉,相对于被内切酶作用的底物,其多糖链的聚合度变化较为缓慢,表现为其碘蓝值随着还原末端数量的增加而缓慢下降。为确定MFA的反应模式,将-淀粉酶、-淀粉酶和MFA各自水解淀粉过程中的还原糖含量变化(以葡萄糖计)和淀粉链聚合度(碘蓝值)变化之间的关系用图7a(支链淀粉为底物)和图7b(直链淀粉为底物)表示。结果显示,MFA水解支/直链淀粉的碘蓝值-还原糖含量趋势更接近于-淀粉酶,这表明MFA水解淀粉时体现出内切酶的作用机制。
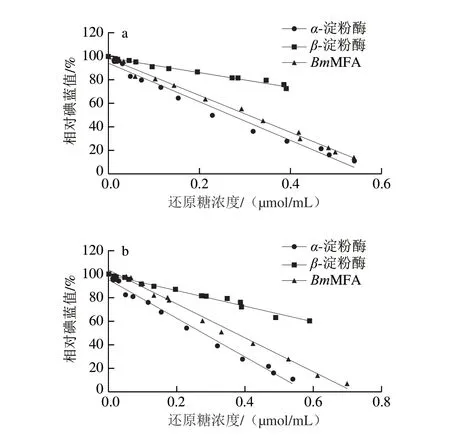
图7 α-淀粉酶、β-淀粉酶和BmMFA作用于直/支链淀粉的反应模式Fig.7 Action patterns of AA,BA and BmMFA on amylopectin and amylose
内切型淀粉酶倾向于随机作用多糖链分子内部的糖苷键,生成不同聚合度的低聚糖混合物,并且随着反应时间的推移才会体现出特定的主产物优势。因此,使用MFA制备G5产品时,适宜通过延长反应时间以促进产物中G5的累积。
2.3 BmMFA的产物合成规律
2.3.1MFA的产物特异性
MFA产物特异性是区别于一般-淀粉酶的关键性质,产物特异性的高低直接影响MOS产量以及目标产物的分离成本。通过分析MFA水解麦芽糊精的产物组成情况,对该酶的产物特异性进行分析,结果见表2。麦芽糊精经MFA充分作用后,其酶解产物为不同聚合度的MOS混合物,其中,G1~G7为MFA的主要产物;在G1~G7中,G5的占比最高,可达到42.08%,且与其他聚合度的MOS副产物相比,具有显著差异(<0.05)。MFA水解麦芽糊精24 h后,底物转化率达到76.61%,G5得率可以达到32.24%,与其他来源MFA相比,MFA具有较高的产G5的能力,表现出相对较强的G5产物特异性,适宜工业上酶法生产G5。
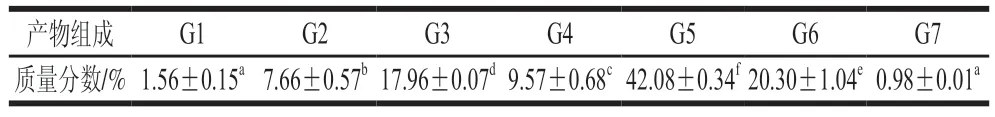
表2 BmMFA水解麦芽糊精产物比例Table 2 Product composition of BmMFA-hydrolyzed maltodextrin
2.3.2 底物结构对产物组成的影响
底物结构对MFA的产物合成具有重要的影响,通过分析酶解不同结构底物的产物组成情况,对实际生产时底物的筛选具有重要意义。MFA对支链淀粉的比活力为436.21 U/mg,对直链淀粉的比活力为339.83 U/mg。在相同加酶量及反应条件下,用MFA分别水解支/直链淀粉,其所得产物所占比例见图8。两组底物水解产物中G1~G5含量均随反应时间的延长逐渐增加。在相同反应时间下,相比于直链淀粉,以支链淀粉为底物时MFA酶解产物中G5含量更高,以支链淀粉为底物时,MFA表现出更好的产物特异性。
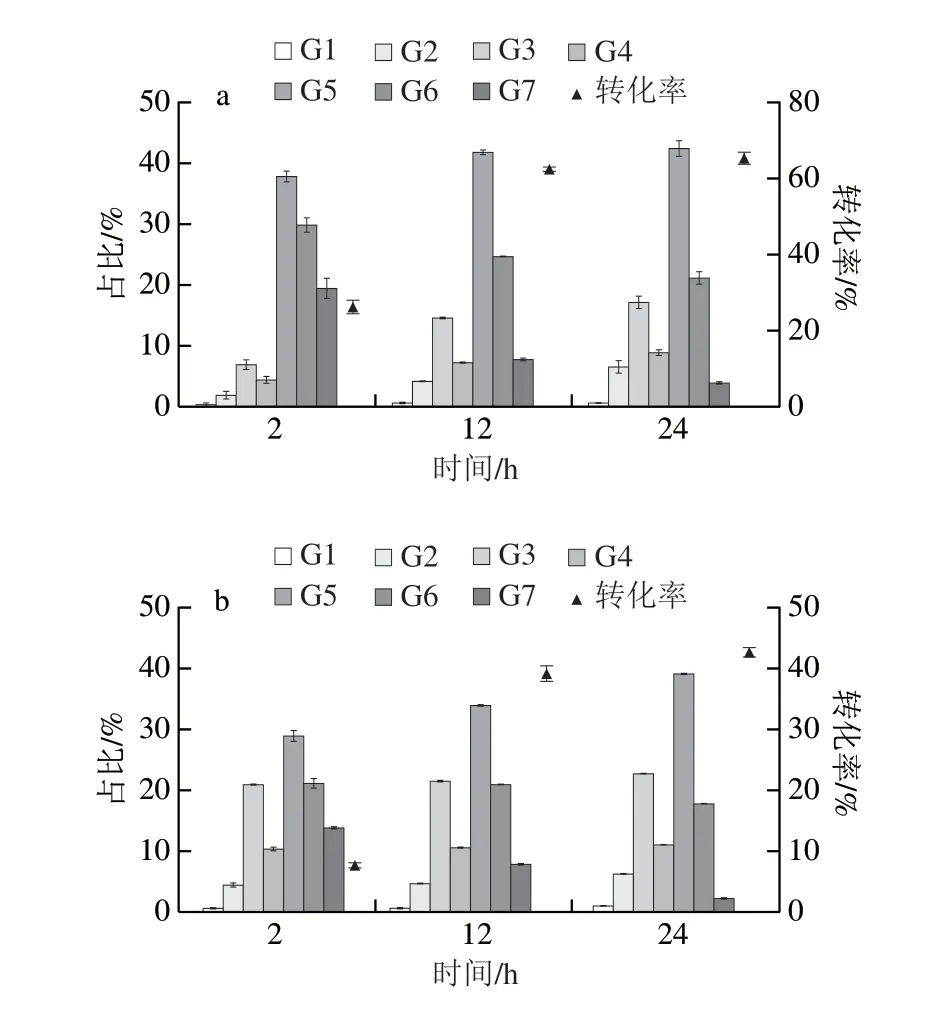
图8 BmMFA水解支链淀粉和直链淀粉的产物Fig.8 Products of BmMFA-hydrolyzing amylopectin and amylose
2.3.3 底物结构对反应程度的影响
MFA对反应程度及底物水解程度的高低对生产成本具有重要意义,以酶对底物的转化率为指标,探究底物结构对酶水解反应程度的影响,结果见图8。反应2 h,MFA对支链淀粉的转化率为24.15%,是以直链淀粉为底物时转化率的2.13 倍。这可能是因为在反应初期,支链淀粉的簇状结构有利于酶与底物的结合。
反应进行到中后期(12~24 h),MFA水解支链淀粉的转化率增速不及以直链淀粉为底物,这可能是由于随着淀粉水解程度的增加,以支链淀粉为底物可能产生较多的极限糊精,MFA难以继续作用于这些极限糊精,使得底物转化率增速减慢。但总体而言,MFA以支链淀粉为底物时的转化率高于以直链淀粉为底物;反应进行到24 h,以支链淀粉为底物时的转化率比以直链淀粉高52.36%。这可能是由于MFA对支链淀粉具有更强的亲和力。
3 结论
本研究实现了MFA在枯草芽孢杆菌表达系统中的分泌表达,并对其酶学性质和产物合成规律进行了研究。结果显示,MFA的最适反应温度为50 ℃,最适反应pH值为7.0,其具有相对较宽的pH值应用范围;MFA倾向于内切酶的作用机制,以支链淀粉为底物时的亲和力及催化效率较高;产物合成规律研究结果表明MFA具有较好的产物特异性,水解麦芽糊精24 h后产物中G5质量分数在42%以上,表现出了相对较强的工业化生产G5的应用潜力;底物为支链淀粉时更利于主产物G5的累积及酶对底物的水解程度。MFA酶学性质及产物合成规律的研究,为酶法制备G5的工业化应用提供了理论依据。

