酶催化合成酰胺类化合物的研究进展
李正一, 陈永正, 万南微
(遵义医科大学 药学院 贵州省生物催化与手性药物合成重点实验室 贵州省绿色制药工程研究中心,贵州 遵义 563000)
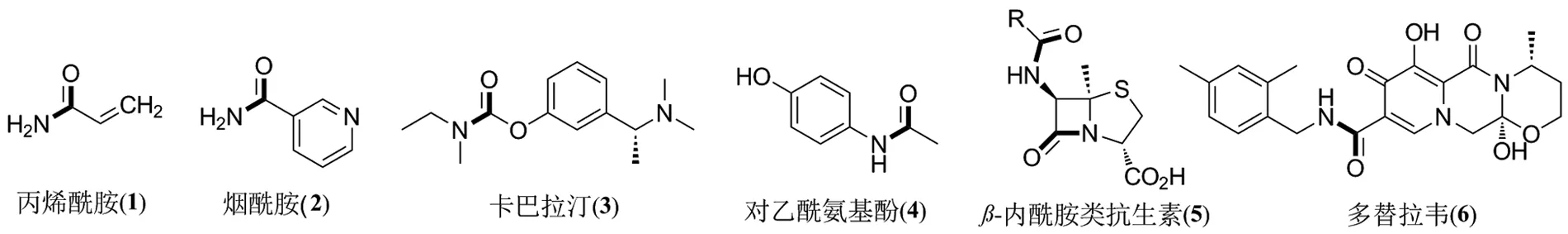
酰胺键的合成是有机化学中最重要的反应之一。酰胺类化合物具有稳定性高、极性大等特点,因而被广泛地应用于各个领域,尤其在医药和精细化学品中扮演着重要的作用,例如丙烯酰胺(1)、烟酰胺(2)、卡巴拉汀(3)、对乙酰氨基酚(4)、β-内酰胺类抗生素(5)、多替拉韦(6)等(Scheme 1)。传统的化学方法是将羧酸或其衍生物与胺偶联形成酰胺类产物,但需要使用有毒或危险试剂以及昂贵的偶联试剂,存在安全性、纯化操作复杂和原子经济性不高等问题[1-2]。例如,制备1 kg的抗艾滋病毒药物Fuzeon需要45 kg的原料,其中并未包括合成和纯化步骤中所使用的溶剂[3],原子经济性差。2007年,美国化学学会绿色化学研究所举行的制药圆桌会议明确提出了酰胺键绿色高效合成的挑战和重要意义[4]。生物催化技术反应条件温和且选择性较高,为酰胺类化合物的构建提供了一种绿色合成策略,本文概述了应用于合成酰胺类化合物的各类酶促反应的研究进展。
Scheme 1

Scheme 2

Scheme 3
1 腈水合酶
腈水合酶(Nitrile hydratase, NHase),是一类作用于腈类化合物的碳氮三键并通过水合反应生成相应酰胺类化合物的酶,被广泛地应用于绿色高效地生产酰胺类物质。早在1980年,日本京都大学Asano实验室筛选并重新鉴定出一株菌RhodococcusrhochochrousJ1,首次将含CN基团的有机腈转化为含CONH2基团的酰胺类化合物的酶命名为腈水合酶[5-6]。其催化的水合反应还能有效地避免副产物羧酸的产生,实现结构上化学、区域和对映体的选择性,展现出化学合成法无可比拟的优势[7]。更重要的是,随着生物信息学、蛋白质工程、宏基因组学等领域的发展研究,其自身耐受性和稳定性方面的缺陷正逐渐得到改善。经研究发现,腈水合酶的催化反应机制是在该酶作用下使腈类化合物转化为酰胺类化合物,如若有酰胺酶(Amidase)的存在,则再催化酰胺最终生成有机酸(Scheme 2a)[8]。继上海市农药研究所微生物法丙烯酰胺生产技术研发成功之后,生物法烟酰胺工业化技术也随之发展起来,能使酶活力高达1000万单位/毫升发酵液(Scheme 2b)[9]。
值得引起关注的是腈水合酶应用于治疗癫痫的活性成分——左乙拉西坦的绿色合成。据专利报道[10],利用半理性设计的腈水合酶突变体能催化得到收率43%的产物,且副产物R-型异构体可以回收利用,但总体产率较低(Scheme 3a)。最近Arndt等[11]开发了一种新的左乙拉西坦的动态动力学拆分和钌催化的细胞外阳极氧化合成方法,产率提升至76%,ee值超过99%(Scheme 3b)。
依赖ATP的酶包含很多,例如ATP抓取酶(ATP-grasp)、酰胺键合成酶(ABS)、酰基辅酶A合成酶(ACS)、N-酰基转移酶(NAT)以及氨酰基tRNA合成酶(aaRS)等。而CapW和CapS是例外,在不依赖 ATP的条件下,CapW可以利用S-腺苷甲硫氨酸(SAM)甲基化提供一个甲酯,随后通过CapS连接甲酯和胺前体获得酰胺类化合物(Scheme 4)[12]。

Scheme 4

Scheme 5

Scheme 6

Scheme 7
2.1 酰胺键合成酶
酰胺键合成酶(Amide bond synthase, ABS)由于其相对简单的、单一的、独立的特点而成为合成应用中较为通用的酶[13]。McbA是β-咔啉类生物碱Marinacarbolines(MCBs)生物合成途径中一种重要的酰胺键合成酶[14],能够利用ATP作为辅助因子,并表现出广泛的底物普适性,不仅可以接受苯甲酸、惰性羧酸、喹啉和苯并呋喃等不同的羧酸底物,还能接受不同的胺供体形成一系列酰胺类产物[15]。2014年,Ju等[14]利用McbA酶作为一种温和、高效且环保的生物催化剂,生成10种新的酰胺类化合物,产率高达93%,展现出其广泛的底物灵活性(Scheme 5)。
2.2 泛酸合成酶
来自大肠杆菌的泛酸合成酶(Pantothenate synthase, PSE.coli)是一类结合三磷酸腺苷(ATP)催化羧酸和胺形成酰胺的连接酶。该酶可以催化(R)-泛解酸和β-丙氨酸的缩合反应生成辅酶A的前体物质——(R)-泛酸(维生素B5)[16]。2021年,Poelarends等[17]研究发现PSE.coli除了能够催化β-丙氨酸外,还能接受各种不同结构的胺,具有较广泛的底物谱,可以得到转化率高达99%以上的酰胺类化合物(Scheme 6)。
2.3 冠状酸连接酶
2021年,Jason等[18]发现冠状酸连接酶(Coronafacic acid ligase, CfaL)可以催化茉莉酸与异亮氨酸反应,生成植物激素茉莉酸-L-异亮氨酸(JA-Ile),且进一步证明了该酶可以接受不同的羧酸底物(脂肪族羧酸与一些手性化合物等)和氨基酸底物来合成不同的酰胺(Scheme 7),转化率高达99%,并通过与改进的ATP再生技术相结合等方法,提高了酶的活性以及稳定性。
Scheme 8

Scheme 9

Scheme 10

Scheme 11
2.4 3-异氰丁酸腺苷化酶
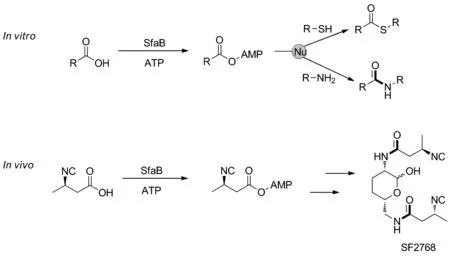
3-异氰丁酸腺苷化酶(AMP-ligase, SfaB)是二异腈天然产物SF2768生物合成基因簇(sfa)中的一种独立的腺苷酸形成酶,能利用腺嘌呤核苷三磷酸(ATP)激活羧酸底物进行胺偶联。2020年,He等[19]重新利用SfaB通过酶促反应和自发亲核进攻实现酰胺化或硫酯化,从而提供了一种新的酶学方法用以制备相应的酰胺和硫酯(Scheme 8)。
3 脂肪酶
3.1 南极假丝酵母脂肪酶
南极假丝酵母脂肪酶(Candida antarctica lipase, CAL)分为A型和B型[20],而CAL-B被认为是一种比CAL-A具有更多功能的生物催化剂,能够接受大范围的底物,并且在一些反应中表现出了更好的选择性[21-23]。因此,CAL-B作为许多底物的首选酶,目前已被广泛地应用于合成α-羟基酰胺、脂肪酰胺、生物聚合物等。2006年,Baldessari等[24]描述了一种由CAL催化制备N-羟基烷基丙烯酰胺的方法。该方法在CAL-B和CAL-A催化下,通过烷醇胺与丙烯酸乙酯的氨基水解反应合成N-羟烷基丙烯酰胺。当使用CAL-B时,底物转化率高(Conv.=89%~96%),但使用CAL-A时仅以低转化率(Conv.=7%)获得酰胺N-(2-羟乙基)丙烯酰胺(Scheme 9)。

Scheme 12

Scheme 13

Scheme 14

Scheme 15
3.2 柱状假丝酵母脂肪酶
柱状假丝酵母脂肪酶(Candida cylindracea lipase, CCL)可以催化水解、醇解和酯化等多种反应,还被广泛应用于生物传感器、生物材料和生物识别等领域中。1985年,Gotor等[25]提供了一种获得丙炔酰胺的简便方法(Scheme 10)。该方法指出丙酸乙酯与胺反应可以得到相应的加成产物,而有趣的是,在CCL作用下,丙酸乙酯还可以与芳香胺反应形成酰胺。
3.3 猪胰脂肪酶
猪胰腺脂肪酶(Porcine pancreas lipase, PPL)与其他脂肪酶相比更便宜,且对非天然底物的生物转化具有高稳定性和较好的特异性[26]。它可以通过对映选择性水解,分解外消旋醇和羧酸为相应的酯来合成重要中间体[27-29],因此在精细化学品和商品的生产中应用越来越广泛。Abell等[30]以叔戊醇为溶剂,利用PPL催化底物异丙基氨基酸酯的环化反应,生成转化率高达80%的内酰胺(Scheme 11)。
3.4 洋葱假单胞菌脂肪酶
洋葱假单胞菌脂肪酶(Pseudomonas cepacia lipase, PCL)因具有很强的酯交换能力和高对映体选择性而被广泛应用于诸多领域。Adamczyk等[31]认为脂肪酶介导的苄基酯向酰胺的转化具有重要的实际意义,并发现了从洋葱假单胞菌中分离的PS-30是一种能介导苄基酯向酰胺转化的酶,且该酶在7 d内实现了较好的转化率(Scheme 12)。
3.5 淀粉假单胞菌脂肪酶
Pelt等[32]已经证明了淀粉假单胞菌脂肪酶(Pseudomonas stutzeri lipase, PSL)是一种有用的氨基分解催化剂,具有相对广泛的底物范围(Scheme 13)。且PSL在各种甲酯和胺的氨基分解反应中的催化能力优于Novozym®435(固定化的CAL-B, NOV435)。
3.6 鞘氨醇单胞菌脂肪酶
研究发现,鞘氨醇单胞菌脂肪酶(Sphingomonas paucimobilis lipase, SpL)来自鞘氨醇单胞菌HXN-200,是第一个可以催化酯或酸的氨基分解反应产生酰胺的胞内酶。它能直接从酸中高效合成酰胺,而不需要制备酯作为底物。此外,SpL具有较广的底物范围,能够接受相对较大的底物进行氨基解反应得到相应高产量的酰胺。还可以催化外消旋酯或外消旋胺的高对映选择性反应,为高ee值条件下合成手性酰胺提供了一种新的方法(Scheme 14)[33]。
Scheme 16

Scheme 17

Scheme 18
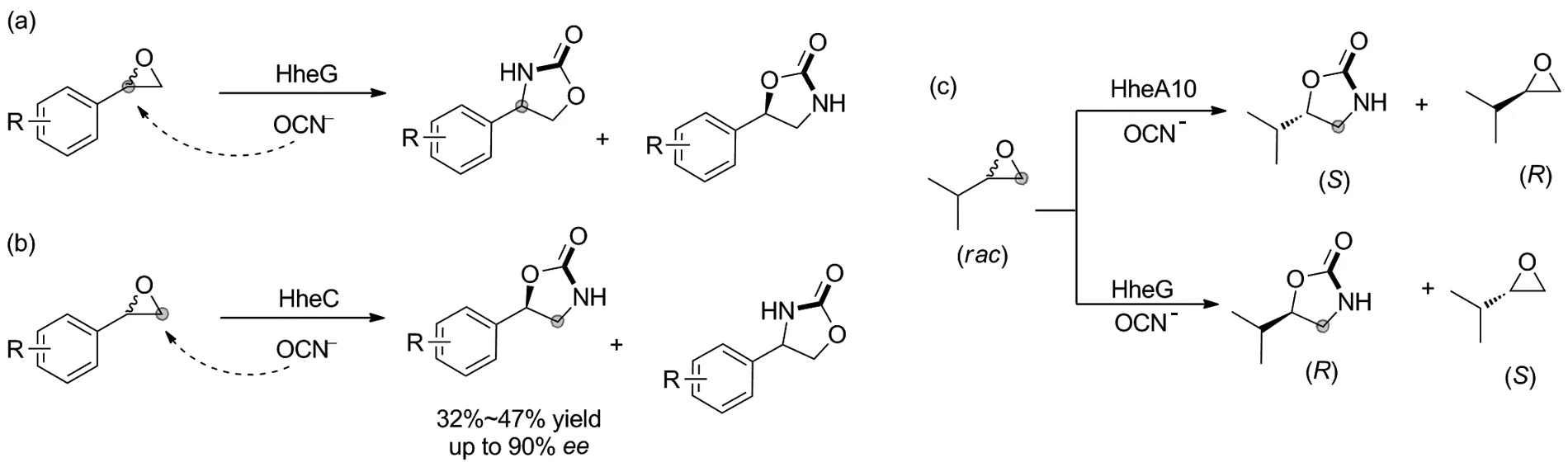
卤醇脱卤酶也叫卤醇-卤化氢裂解酶(Halohydrin dehalogenases, HHDHs),能够可逆地作用于邻羟基卤化物,从而形成环氧化物及其开环产物。2008 年,Janssen课题组[34]在卤醇脱卤酶HheC的催化作用下,利用亲核试剂氰酸钠对环氧化物进行β-位开环,产生的β-取代醇进一步自发环化,实现了手性5-取代噁唑烷酮的合成(Scheme 15)。
2019年,本课题组探究了在亲核试剂NaOCN作用下,利用HheG催化消旋环氧苯乙烷的α-开环反应,得到了4-芳基噁唑烷酮类化合物,并首次实现了通过酶催化环氧化物合成4-芳基噁唑烷酮,但该方法ee值较低(ee最高52%)(Scheme 16a)[35]。随后在2020年,本课题组发现当HheC作为催化剂催化环氧苯乙烷对映和区域选择性β-开环反应时,能得到手性的5-芳基噁唑烷酮类化合物,产率高达到47%,ee值高达到90%。该方法开发了一种温和、绿色的合成手性噁唑烷酮类化合物的途径(Scheme 16b)[36]。同年,本课题组通过筛选获得可分别催化2-异丙基环氧乙烷不对称开环反应的生物催化剂HheG和HheA10,并以超过99%ee值合成立体选择性互补的手性5-异丙基-2-噁唑烷酮(Scheme 16c)[37]。
2021年,本课题组进一步以廉价的烯烃和氰酸盐作为原料,将苯乙烯单加氧酶和卤醇脱卤酶相结合,开发了一种用于烯烃不对称氨基羟基化的一锅法生物催化级联反应,该双酶级联SMO-HheG反应兼容性好,能使不同烯烃转化为具有良好立体和区域选择性的对映体噁唑烷酮,产率37%~70%,ee值94%~>99%,区域选择性94%~>99%。此外,通过该生物催化级联方法可以制备出含有两个手性中心的4,5-二取代噁唑烷酮(Scheme 17)[38]。
5 其他酶
5.1 P450酶
细胞色素P450 (Cytochrome P450, CYP450)属于单加氧酶,是一类拥有多种催化功能的酶,可以实现不同底物的羟基化、氨基化等。2015年,Fasan等[39]利用P450BM3的突变体P411BM3有效地催化碳酸盐叠氮化物的环化反应,并成功合成4-取代噁唑烷酮(Scheme 18)。

Scheme 19

Scheme 20

Scheme 21
5.2 酰基转移酶
酰基转移酶(Acyl transferase, AT)能催化酰基转移形成酯或酰胺[40-41],而其中需要依赖复杂且昂贵的酰基供体,如酰基辅酶A硫酯等。自1993年以来,水解酶混杂酰基转移酶被发现[42],它可以作为一种理想的生物催化剂应用于水酶级联反应中,特别是对于几乎不溶于有机溶剂的亲水底物的酰化反应。
2007年,Richard等[43]从耻垢分枝杆菌(Mycolicibacteriumsmegmatis)中分离出一种新型的酰基转移酶MsAcT,并进一步证明了该酶可以催化醇解反应。2016年,Berglund等[44]利用MsAcT与来自硅酸杆菌(Silicibacterpomeroyi)的胺转氨酶(Sp-ATA)开发了一种高效的“一步一锅”级联反应形成酰胺,并得到转化率高达97%的N-苄基-2-甲氧基乙酰胺(Scheme 19a),再次证明了水解酶混杂酰基转移酶在级联反应中的潜力。2018年,Paradisi等[45]证明了MsAcT具有非常广的底物范围,能接受不同的胺和酰基供体在水中制备N-乙酰衍生物。其中醋酸乙烯基是最好的供体,在反应20 min后得到具有较好产率(85%~99%)的酰胺类化合物(Scheme 19b)。
5.3 青霉素酰化酶
青霉素酰化酶(Penicillin acylase, PA)又称为青霉素酰胺酶或青霉素氨基水解酶[46],根据其底物特异性不同可以分为:青霉素G酰化酶、青霉素V酰化酶和氨苄西林酰化酶。1960年,Kaufman和Bauer首次证实了青霉素酰化酶作为生物催化剂在合成方面的应用(Scheme 20)[47]。从那以后,该酶主要用于工业上制备6-氨基青霉酸和半合成β-内酰胺类抗生素[48]。
5.4 环状假单胞菌
2016年,本课题组[49]证实了环状假单胞菌(Pseudomonasplecoglossicida)ZMU-T04作为生物催化剂可以对1,2,3,4-四氢喹啉进行对映选择性苄位C—H键氧化。研究发现,苄基羟基化过程不仅产生了主要的(R)-1,2,3,4-四氢喹啉-2-醇,而且还产生了少量的3,4-二氢-2(1H)-喹啉酮(Scheme 21a)。基于这一发现,本课题组实现了利用ZMU-T04对胺进行α-氧化,并成功制备了内酰胺类化合物。更重要的是,该反应还为抗抑郁药生物活性分子的合成提供了潜在的应用前景(Scheme 21b)[50]。
许多生物活性分子和药物都含有酰胺键结构,酰胺键形成反应是药物合成过程中重要的反应之一。本文归纳了腈水合酶、ATP依赖型酶、脂肪酶和卤醇脱卤酶等生物酶参与的酰胺合成反应。与传统化学法相比,酶促酰胺合成反应展现出反应条件温和、处理方式安全、具有化学选择性、区域选择性和立体选择性等优点,在酰胺类医药中间体绿色合成方面已有诸多应用。但有些生物催化酰胺合成策略的工业应用还面临一些瓶颈,如ATP依赖型酶介导的酰胺合成反应过程需使用昂贵的ATP试剂。随着对这些酶催化反应特性和酶自身催化性能的深入探究,有望创制出更多高活性和高稳定性的生物催化剂,用于结构多样酰胺类化合物的绿色高效合成。

