脑胶质瘤组织中苹果酸酶2、MMP-2的阳性表达及其临床意义
陈 俊,李军烽,郑 乐
脑胶质细胞瘤是起源于神经上皮组织的恶性肿瘤,包括星形胶质、少枝胶质、室管膜等组织的肿瘤[1-2]。胶质细胞瘤约占颅内肿瘤的40%。发病率较高,且由于其恶性增殖、侵袭性生长等特点,复发率、死亡率高,预后差[3-4]。临床上无论是采取放化疗还是手术治疗,都难以完全治愈。苹果酸酶2(ME2)可诱发细胞衰老,并调控细胞的代谢和增殖,促进黑色素瘤的发展,增强肿瘤细胞的侵袭能力[5]。基质金属蛋白酶-2(MMP-2)是降解细胞外基质成分的重要酶类,影响细胞的代谢、存活、迁移、增殖和分化[6]。目前已有部分关于MMP-2与脑胶质瘤的研究。本研究旨在探讨脑胶质瘤组织中ME2、MMP-2的阳性表达及临床意义。现报道如下。
1 资料与方法
1.1 一般资料 选取2019年6月—2020年6月在我院行脑胶质瘤手术切除术的97例病人(脑胶质瘤组)。纳入标准:①术前未进行过放化疗,并通过术后影像学和病理学检查确诊为脑胶质瘤[7];②无其他精神外科疾病;③签署知情同意书。排除标准:①合并其他恶性肿瘤;②精神及心理状态异常;③心、肝、肾重要器官功能不全;④心脑血管系统疾病。通过《世界卫生组织2016中枢神经系统肿瘤分级标准》对97例脑胶质瘤手术切除标本进行分级,其中Ⅰ级15例,Ⅱ级32例,Ⅲ级27例,Ⅳ级23例。并选取同期在我院行颅脑损伤去骨瓣内减压术病人25例作为对照组,病人术后通过病理检查确定为正常脑组织,脑胶质细胞无增生、坏死情况。
1.2 试剂 鼠抗人ME2单克隆抗体(北京华夏远洋科技有限公司),鼠抗人MMP-2单克隆抗体(武汉艾美捷科技有限公司),二氨基联苯胺(DAB)显色试剂盒(北京中杉九强生物技术有限公司)。
1.3 免疫组化学染色二步法 收集两组病人全部脑组织标本均经过10%中性甲醛标本固定液进行固定,常规石蜡包埋,连续切取5张4 μm的厚片,依次编码。将所有标本进行石蜡切片,脱蜡、水化,经过抗原修复后使用微波高火5 min直至其沸腾,置于室温下冷却,使用3%H2O2去离子水进行孵育10 min,将内源性过氧化物酶阻断。磷酸缓冲盐溶液(PBS)冲洗3次,每次2 min,分别滴加ME2、MMP-2一抗(1∶300稀释),置于4 ℃的环境过夜。PBS冲洗3次,每次2 min,滴加聚合物辅助剂,置于室温下进行10~20 min的孵育;PBS冲洗3次,每次2 min,再滴加辣根酶标记抗鼠/兔/山羊IgG聚合物,置于室温下进行10~20 min的孵育;PBS冲洗3次,每次2 min,使用二氨基联苯胺溶液进行2~5 min的显色;自来水冲洗干净后,使用苏木素复染1~2 min,脱水、透明、封片。对照组使用PBS代替一抗。
结果判定方法:在400倍光镜下,随机选择5个视野进行观察,计数1 000个细胞中阳性染色细胞情况,阳性细胞率=(阳性表达细胞数/1 000)×100%。比较两组ME2、MMP-2阳性细胞率。
2 结 果
2.1 两组脑组织标本ME2、MMP-2阳性细胞率比较 脑胶质瘤组不同病理分级脑组织标本ME2、MMP-2阳性细胞率均高于对照组(P<0.05),ME2、MMP-2阳性细胞率随着病理分级的增加逐渐升高(P<0.05)。详见表1。
表1 两组脑组织标本ME2、MMP-2阳性细胞率比较(±s) 单位:%
2.2 低级别(Ⅰ级+Ⅱ级)和高级别(Ⅲ级+Ⅳ级)脑胶质瘤ME2、MMP-2阳性细胞率比较 Ⅲ级+Ⅳ级脑胶质瘤ME2、MMP-2阳性细胞率明显高于Ⅰ级+Ⅱ级脑胶质瘤(P<0.05)。详见表2。
表2 Ⅰ级+Ⅱ级和Ⅲ级+Ⅳ级脑胶质瘤ME2、MMP-2阳性细胞率比较(±s) 单位:%
2.3 脑胶质瘤中ME2、MMP-2与临床病理参数的关系 不同性别、年龄、头晕情况、脑胶质瘤细胞种类、脑胶质瘤部位的ME2、MMP-2阳性细胞检出率比较,差异均无统计学意义(P>0.05),不同肿瘤大小、病理级别的ME2、MMP-2阳性细胞检出率比较,差异有统计学意义(P<0.05)。详见表3。
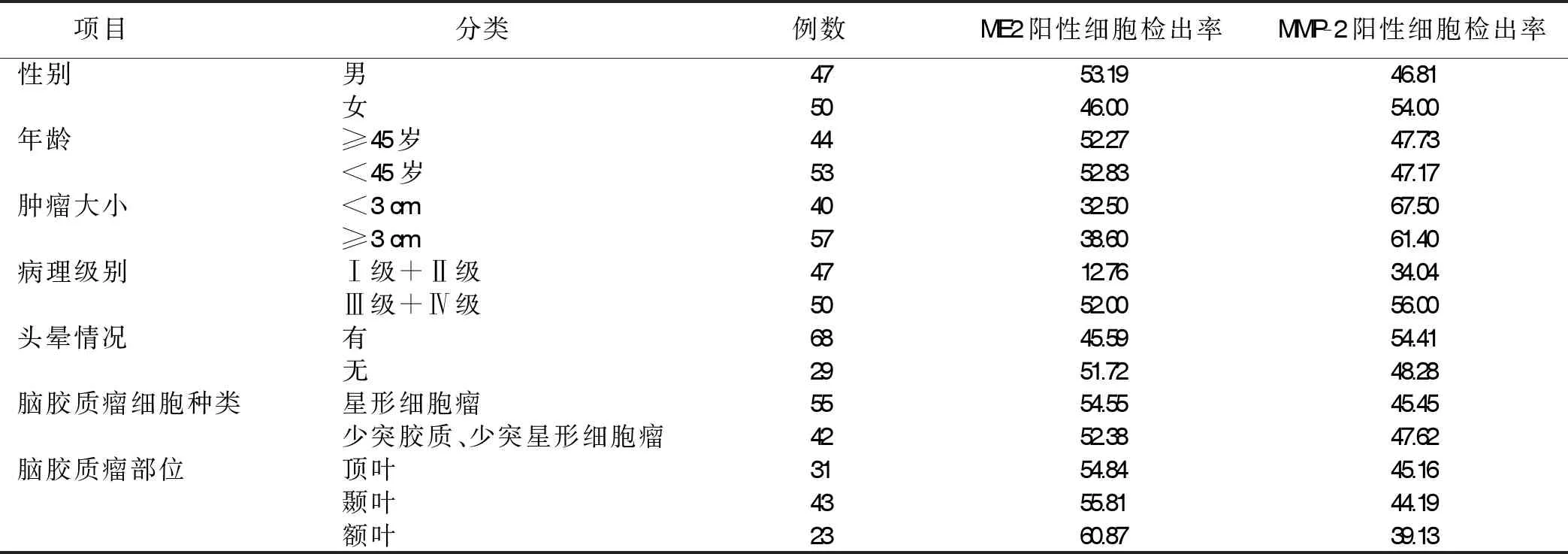
表3 脑胶质瘤中ME2、MMP-2与临床病理参数的关系 单位:%
2.4 脑胶质瘤中ME2、MMP-2和临床病理分级的相关性 Spearman相关性分析结果显示,脑胶质瘤中ME2、MMP-2的表达与临床病理分级呈正相关(r=0.751,P<0.05;r=0.680,P<0.05)。
3 讨 论
脑胶质瘤是起源于神经胶质细胞的肿瘤,是最常见的原发性中枢神经系统肿瘤。在原发性脑瘤中,胶质瘤治疗难度大,致残率、致死率极高。脑胶质瘤可导致颅内压增高和神经功能缺失,表现为头痛、恶心、呕吐、视乳头水肿、失语、运动、感觉障碍和复视等,也有部分病人是以癫痫发作及意识障碍起病[8-9]。目前临床对于脑胶质瘤以手术治疗为主,最大范围地安全切除肿瘤组织,辅以放疗和化疗,提高病人生存质量,延长生存期[10-11]。
世界卫生组织根据肿瘤的恶性程度不同,将胶质瘤分为Ⅰ~Ⅳ级,其中Ⅰ级、Ⅱ级为低级别胶质瘤,包括毛细胞星形细胞瘤、弥漫性星形细胞瘤、少突胶质细胞瘤、少突星形细胞瘤等;Ⅲ级、Ⅳ级为高级别胶质瘤,包括间变性星形细胞瘤、间变性少突胶质细胞瘤、间变性少突星形细胞瘤等[12-13]。MMP-2是由多种细胞分泌的明胶酶,由体内多种细胞合成和分泌,包括成纤维细胞、星形细胞、小胶质细胞、神经细胞、巨噬细胞等[14-15]。MMP-2能够降解多种细胞外基质,在人体内发挥着重要的生理和病理功能,具有降解变性的Ⅰ型、Ⅱ型、Ⅲ型胶原的能力,也可切割天然Ⅳ型、Ⅴ型胶原。研究发现,MMP-2能破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用[16-17]。ME2属于苹果酸酶3个亚型中的一种,具有高度保守的序列和拓朴结构,属于机体细胞代谢过程中的氧化脱羧酸,其代谢产物为丙酮酸,并诱发一系列生物化学反应,并在细胞再生过程中开始把葡萄糖成分氧化成二氧化碳,并产生三磷酸腺苷作为细胞燃料,从而调节细胞对能量的需求。于学娟等[18]研究指出ME2在多种人体恶性肿瘤中呈现高表达,使黏附因子的表达受到抑制,从而增加肿瘤细胞运动能力,使其从原发肿瘤病灶上脱离,形成游离细胞破坏细胞外基质,从而使肿瘤细胞突破结缔组织构成的屏障。
本研究结果显示,脑胶质瘤组不同病理分级脑组织标本ME2、MMP-2阳性细胞率均高于对照组(P<0.05),随着脑胶质瘤临床病理分级的增高,其阳性细胞率也随之升高,且ME2、MMP-2表达与临床病理分级呈正相关,提示ME2、MMP-2和疾病严重程度存在着密切关系。由于肿瘤细胞的能量代谢途径与正常细胞有所不同,主要依赖于糖酵解而不是氧化磷酸化途径。ME2能够催化苹果酸生成丙酮酸,使糖酵解作用增强,加速了糖酵解途径,提示ME2可能是促进胶质母细胞瘤(GBM)细胞增殖和发生发展的一个重要蛋白[19-20]。MMP-2释放生长因子,促进脑胶质瘤细胞的生长,且通过降解细胞外基质,形成脑胶质瘤细胞侵袭和转移的运行通道,从而导致脑胶质瘤细胞突破结缔组织构成的屏障[21-22]。此外,MMP-2通过加速对血管生成因子和血管内皮生长因子的合成与分泌,促进脑胶质瘤血管的形成[19,23-24]。经Spearman相关性分析显示,在脑胶质瘤组织中ME2、MMP-2与临床病理分级呈正相关,对于ME2、MMP-2与脑胶质瘤之间的关系仍需结合其他医疗中心进行长效性的研究。
综上所述,ME2、MMP-2在脑胶质瘤病人组织中有明显高表达,与临床病理分级有明显相关性,为研究脑胶质瘤的病理机制提供新思路。

