布鲁氏菌分泌蛋白BPE005的亚细胞定位及与宿主细胞互作蛋白的筛选
邱润辉,关飞虎,陶婷婷,李 佳,赵天艺,邓兴梅,史 超,孙志华,2,3,张 辉,2,3
(1.石河子大学动物科技学院,石河子 832000;2.新疆生产建设兵团动物疾病防控重点实验室,石河子 832000;3.动物健康养殖国家国际联合研究中心,石河子 832000)
Ⅳ分泌系统(T4SS)是布鲁氏菌重要的毒力因子,在布鲁氏菌感染期间,Ⅳ分泌系统可通过分泌效应蛋白干扰宿主细胞免疫信号通路,降低宿主细胞的免疫反应,抵御宿主细胞的杀菌功能,以促进布鲁氏菌在胞内的持续性感染[1-2]。目前有许多关于布鲁氏菌Ⅳ分泌系统的效应蛋白被相继报道,如BtpA可以抑制树突状细胞的成熟,破坏Toll样受体(Toll-like receptor,TLR)的信号传递,降低NF-κB信号通路活性[3];效应蛋白RicA可以促进含有布鲁氏菌的胞内体与晚期溶酶体相结合,提高胞内体的酸性环境,诱导布鲁氏菌表达、组装分泌蛋白[4-5];BspB定位于内质网和血浆膜,它可以改变宿主细胞蛋白囊泡运输途径,为布鲁氏菌的胞内寄生提供更多的营养物质,增强布鲁氏菌的胞内复制能力[6]。由此可见,分泌蛋白对于布鲁氏菌的免疫逃逸和胞内寄生具有重要意义。近年来,已通过CyaA报告系统鉴定获得布鲁氏菌分泌蛋白BPE005,但关于BPE005的相关生物学功能研究鲜见报道[7]。
酵母双杂交系统(yeast two-hybrid system)巧妙地利用了真核生物转录调控因子的组件式特性,一个完整的酵母转录因子包括DNA结合结构域(DNA binding domain,DNA-BD)和转录激活结构域(activation domain,AD)2个部分,如果把这2个结构域强制分开,任何一部分都不具备一个完整的转录因子的功能,则不能启动下游靶基因的转录。利用这一结构特点,分别将BD结构域与蛋白X融合,构建出BD-X质粒载体;AD结构域与cDNA文库融合,构建出AD-Y质粒载体;将2个穿梭质粒载体共转化至酵母体内表达。酵母菌本身无报告基因的转录活性,但是如果蛋白X和Y可以产生相互作用就会导致BD-X与AD-Y在空间上的接近,从而激活下游报告基因的表达。表达了相应报告基因的酵母菌不仅能够在特定营养缺陷型的培养基上生长,而且能对酵母细胞毒素金担子素(AbA)表现出良好的抗性[8-10]。
本研究拟分析布鲁氏菌分泌蛋白BPE005的亚细胞定位,利用小鼠单核巨噬细胞RAW264.7 mRNA的cDNA文库,通过酵母双杂交系统筛选宿主细胞内与BPE005存在相互作用的蛋白,以期为进一步研究布鲁氏菌分泌蛋白BPE005的生物学功能和布鲁氏菌的致病机制提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞及质粒 牛种布鲁氏菌S2308、大肠杆菌DH5α感受态细胞及人胚肾细胞株293T均由新疆石河子大学动物疾病防控兵团重点实验室保存;Y2HGold、Y187Yeast酵母菌株及PGBKT7、PGADT7质粒均购自上海欧易生物医学科技有限公司。
1.1.2 主要试剂 小鼠单核巨噬细胞RAW264.7 mRNA酵母双杂交AD文库菌液由新疆石河子大学动物疾病防控兵团重点实验室保存;DMEM细胞培养液、胎牛血清均购自Gibco公司;转染试剂购自Zeta Life公司;质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技(北京)有限公司;EcoR Ⅰ、BamH Ⅰ、T4 DNA连接酶均购自TaKaRa公司;Super DNA Marker购自康为世纪生物科技股份有限公司;酵母试验相关试剂(如各种缺陷型培养基、金担子素A等)购自陕西普因特生物工程有限公司。
1.2 方法
1.2.1 布鲁氏菌分泌蛋白BPE005的生物信息学分析 根据GenBank中牛种布鲁氏菌S2308的BPE005基因序列(登录号:CP046720.1),利用ProtParam在线软件(https:∥web.expasy.org/protparam)进行蛋白理化性质分析;利用ProtScale在线软件(https:∥web.expasy.org/protscale)进行蛋白亲/疏水性预测;利用SignalP-4.1在线软件(http:∥www.cbs.dtu.dk/services/SignalP-4.1)进行蛋白信号肽预测;利用PSORTⅡ在线软件(https:∥www.genscript.com/psort.html)进行蛋白亚细胞定位;利用SOPMA在线软件(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat)进行蛋白二级结构预测;利用SWISS-MODEL在线软件(https:∥swissmodel.expasy.org)进行蛋白三级结构预测。
1.2.2 酵母诱饵质粒PGBKT7-BPE005和荧光定位质粒PDSRED2-C1-BPE005的构建 以流产型布鲁氏菌S2308为模板,用BPE005的特异性引物进行PCR扩增,引物序列为:F:5′-GGAATTCC-ATGGCGCTGACGA-3′;R:5′-CGGATCCGTCA-GTCGCGGTT-3′,划线部分为EcoR Ⅰ、BamH Ⅰ酶切位点。引物由生工生物工程(上海)股份有限公司合成。
PCR反应体系20 μL:模板2 μL,上、下游引物各0.4 μL,2×TaqPCR MasterMix 12.5 μL,ddH2O 9.7 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性40 s,57 ℃退火1 min,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物与PGBKT7、BPRESRED-C1连接,构建PGBKT7-BPE005诱饵重组质粒和PDSRED2-C1-BPE005荧光定位质粒,重组质粒经双酶切鉴定后由生工生物工程(上海)股份有限公司进行测序鉴定。
1.2.3 BPE005的亚细胞定位 293T细胞接种于预先放置好干净无菌盖玻片的6孔板内,接种密度为50%。细胞完全贴壁时,将转染试剂与重组质粒PDSRED2-C1-BPE005按照1∶1混合形成转染复合物,移液器反复吹打转染复合物10~15次后移至6孔板中,轻轻混匀,置于细胞培养箱,培养24 h后取出盖玻片使用4%多聚甲醛进行固定。PBS清洗3遍,加入含有抗荧光淬灭剂的DAPI进行核染色后将盖玻片扣在载玻片上,使用扫描激光共聚焦显微镜观察BPE005在细胞中的位置。
1.2.4 诱饵基因的转化、自激活和毒性检测 活化Y2HGold酵母菌株,挑取1个大小为2~3 mm的单克隆于3 mL的YPDA中,培养8 h后吸取5 μL培养液转接至50 mL YPDA培养基中,30 ℃、240 r/min培养至D600 nm值为0.3;2 000 r/min离心5 min收集菌体,1.1×TE/LiAC溶液重悬菌体;加入预变性的Carrier DNA、1×PEG/LiAC和目的质粒缓慢混匀;30 ℃水浴30 min,加入DMSO混匀,42 ℃水浴热击15 min,2 000 r/min离心5 min收集菌体;用1 mL YPD Plus液体培养基重新悬浮,30 ℃摇床振荡培养1 h,高速离心,弃上清用0.9% NaCl溶液重新悬浮细胞;100倍稀释后涂布于含SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/-Leu/X-α-Gal的100 mm平板。
1.2.5 AD文库的滴度测定 室温水浴锅中融化1 mL AD菌液,取10 μL稀释10 000倍涂布于SD/-Leu固体培养基,观察SD/-Leu板上是否有超过200个克隆。
1.2.6 mating法双杂交文库筛选 取50 mL SD/-Trp液体培养基,30 ℃、240 r/min过夜培养至D600 nm值为0.8,经转化后含有PGBKTT7-BPE00重组质粒的Y2HGOLD 1 000 r/min离心5 min,倒掉上清液,用4~5 mL SD/-Trp液体培养基重悬细胞,使细胞密度>1×108/mL;将1 mL AD细菌液和4~5 mL BD细菌液置于2 L无菌的锥形瓶中,加入45 mL 2×YPDA(含有50 μg/mL Kan+)的液体培养基,在30 ℃摇床上30~50 r/min低速振荡培养24 h;20 h后,40×显微镜下观察杂交液是否出现三叶草形状的结合子,没有则继续培养4 h,有则离心收集细胞,并以0.9 % NaCl重悬;取40 μL重悬液稀释1 000倍,取100 μL涂布于直径90 mm的SD/-Trp/-Leu/-Ade和SD/-Trp/-Leu/-Ade/-His固体培养基上(含有1 mmol/L 3AT),30 ℃恒温培养箱培养3~5 d。
1.2.7 阳性克隆酵母质粒抽提与扩增 挑取在SD/-Trp/-Leu/-Ade/-His固体培养基上生长的白色阳性克隆,通过SD/-Trp/-Leu/-Ade/-His液体培养基培养至D600 nm值为0.8,使用酵母质粒小提试剂盒进行质粒抽提;所提质粒转化大肠杆菌DH5α感受态细胞,涂布在氨苄霉素抗性的LB固体培养基上,37 ℃过夜培养;生长的菌落接种到含有氨苄霉素抗性的的LB液体培养基中,提取文库质粒,由生工生物工程(上海)股份有限公司进行基因测序,测序结果进行BLAST比对分析。
1.2.8 Prey质粒与Bait质粒一对一互作验证 诱饵质粒与筛选得到的文库质粒进行一对一共转化,共转化的酵母感受态涂布于SD/-Trp/-Leu/-Ade/-His-AbA固体培养基上,30 ℃恒温培养箱培养3~5 d,验证诱饵蛋白和猎物蛋白的相互作用。
1.2.9 RNA聚合酶Ⅱ多肽G蛋白相互作用网络分析 根据GenBank中RNA聚合酶Ⅱ多肽G的蛋白序列(登录号:NP_002687.1),运用STRING在线工具(https:∥cn.string-db.org/cgi)分析RNA聚合酶Ⅱ多肽G蛋白的相互作用网络。
2 结 果
2.1 布鲁氏菌分泌蛋白BPE005的生物信息学分析
布鲁氏菌分泌蛋白BPE005共含有462个氨基酸残基,主要由Gly(31.0%)、Cys(31.0%)、Thr(20.8%)、Ala(17.3%)构成(图1);几乎不含有亲水区域,属于疏水蛋白(图2);C、Y、S的最大值分别为0.148、0.304、0.795,属于分泌型蛋白(图3)。亚细胞定位结果显示,BPE005蛋白位于细胞外的可能性较高,为39.1%;位于细胞核的可能性为30.4%;位于线粒体的可能性为21.7%;位于过氧化物酶体和高尔基体的可能性均为4.3%(图4)。二级结构、三级结构预测表明,BPE005蛋白内含有大量的无规则卷曲、α-螺旋和延伸链,β-转角占比较少(图5),预示BPE005可能有许多活性位点(图6)。

图1 BPE005蛋白的氨基酸组成Fig.1 Aamino acid composition of BPE005 protein

图2 BPE005蛋白亲/疏水性预测Fig.2 Hydrophilicity and hydrophobicity prediction of BPE005 protein

图3 BPE005蛋白信号肽预测Fig.3 Signal peptide prediction of BPE005 protein

图4 BPE005蛋白亚细胞定位预测Fig.4 Subcellular localization prediction of BPE005 protein

h,α-螺旋;c,无规则卷曲;t,β-转角;e,延伸链h,Alpha helix;c,Random coil;t,Beta turn;e,Extended chain图5 BPE005蛋白二级结构预测Fig.5 Secondary structure prediction of BPE005 protein

图6 BPE005蛋白三级结构预测Fig.6 Tertiary structure prediction of BPE005 protein
2.2 酵母诱饵质粒PGBKT7-BPE005和荧光定位质粒PDSRED2-C1-BPE005的构建
以牛种布鲁氏菌S2308作为模板,利用PCR反应对BPE005进行特异性扩增,扩增片段大小约为462 bp(图7A),与预期片段长度相符,表明扩增成功。PCR扩增产物与质粒PGBKT7、PDSRED2-C1经EcoR Ⅰ/BamH Ⅰ双酶切后连接并转化大肠杆菌DH5α感受态细胞,提取重组质粒进行双酶切验证,目的片段大小约为462 bp(图7B、7C),均与预期相符。阳性菌液经测序比对分析,其相似性为100%,表明质粒构建成功。

A,BPE005基因PCR扩增电泳图;B,PGBKTE-BPE005载体双酶切电泳图;C,PDSRED2-C1-BPE005载体双酶切电泳图A,Gene electrophoregram of BPE005 gene amplified by PCR;B,Electrophoregram of PGBKTE-BPE005 vector digested by double endonuclease;C,Electrophoregram of PDSRED2-C1-BPE005 vector digested by double endonuclease图7 重组质粒的构建和鉴定Fig.7 Construction and identification of recombinant plasmid
2.3 BPE005蛋白的亚细胞定位
将PDSRED2-C1-BPE005转染至293T细胞,24 h后经4%多聚甲醛固定、PBS清洗、DAPI核染色后封片,10 μm扫描激光共聚焦显微镜下观察BPE005的细胞定位情况,可以看到红光(BPE005)均位于蓝光(细胞核)之上(图8),表明BPE005是一种定位于细胞核的布鲁氏菌分泌蛋白。

图8 BPE005蛋白亚细胞定位(400×)Fig.8 Subcellular localization of BPE005 protein (400×)
2.4 诱饵基因的转化、自激活和毒性检测
分别将诱饵质粒PGBKT7-BPE005和空载质粒PGBKT7转化酵母感受态细胞Y2HGold中,涂布于SD/-Trp/X-α-Gal固体培养基上,2个平板上均有形态、大小相似的白色菌落(图9A),数量差异可能来源于转化效率,表明诱饵质粒对酵母无毒性影响。将含有PGBKT7-BPE005的Y2HGold分别涂布于SD/-Trp/X-α-Gal和SD/-Trp/-Leu/X-α-Gal,前者生长出白色菌落(图9B),后者并未有菌落生长(图9C),表明诱饵质粒无自激活现象。
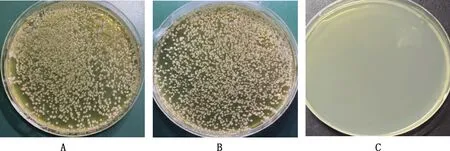
A,含有PGBKT7的Y2HGold菌株涂布于SD/-Trp/X-α-Gal固体培养基;B,含有PGBKT7-BPE005的Y2HGold菌株涂布于SD/-Trp/X-α-Gal固体培养基;C,含有PGBKT7-BPE005的Y2HGold菌株涂布SD/-Trp/-Leu/X-α-Gal固体培养基A,Strain Y2HGold containing PGBKT7 was coated on SD/-Trp/X-α-Gal solid medium;B,Strain Y2HGold containing PGBKT7-BPE005 was coated on SD/-Trp/X-α-Gal solid medium;C,Strain Y2HGold containing PGBKT7-BPE005 was coated on SD/-Trp/-Leu/X-α-Gal solid medium图9 诱饵蛋白毒性和自激活检测Fig.9 Detection of toxicity and self-activation of bait protein
2.5 AD文库的滴度测定
涂布于SD/-Leu固体培养基的稀释10 000倍的酵母AD文库菌液生长出超过200个阳性克隆(图10),表明AD文库菌液符合所需滴度,可以进行后续的酵母双杂交。

图10 文库滴度测定Fig.10 Titer determination of library
2.6 mating法双杂交文库筛选
将含有重组诱饵载体的酵母菌株与含有AD文库的酵母菌株振荡培养进行杂交,可以在40×的光学显微镜下观察到杂交细胞类似于米老鼠头像,之后将杂交菌液稀释后分别涂布于SD/-Trp/-Leu/-Ade和SD/-Trp/-Leu/-Ade/-His平板上进行第一步筛选,在SD/-Trp/-Leu/-Ade/-His平板上筛选得到11个阳性菌落(图11)。挑选阳性克隆培养后提取质粒,转化大肠杆菌DH5α感受态细胞,提取阳性文库质粒并测序,基于测序结果进行了BLAST比对分析,初步获得与布鲁氏菌分泌蛋白BPE005存在相互作用的4个蛋白:RNA聚合酶Ⅱ多肽G、补体因子H、鸟苷酸环化酶2G及颗粒蛋白(表1)。

A,光学显微镜下观察杂交细胞(40×);B,杂交后的酵母菌液涂布于SD/-Trp/-Leu/-Ade固体培养基;C,杂交后的酵母菌液涂布于SD/-Trp/-Leu/-Ade/-His固体培养基A,The hybrid cells were observed under light microscope (40×);B,The hybrid yeast liquid was coated on SD/-Trp/-Leu/-Ade solid medium;C,The hybrid yeast liquid was coated on SD/-Trp/-Leu/-Ade/-His solid medium图11 酵母双杂交筛选Fig.11 Yeast two-hybrid screening
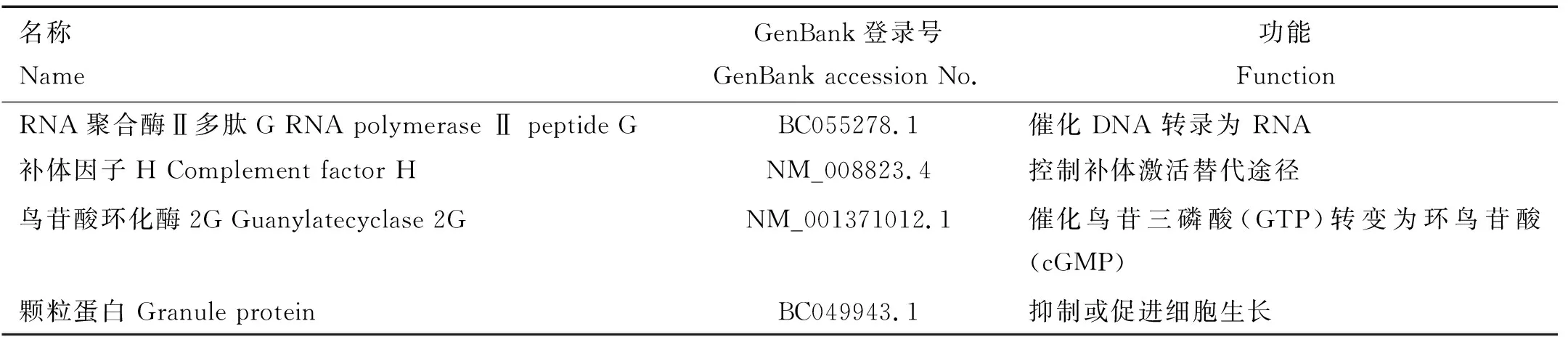
表1 BPE005的相互作用蛋白Table 1 Interacting protein of BPE005
2.7 Prey质粒与Bait质粒一对一互作验证
将诱饵质粒分别与筛选到的4个文库质粒共转化于酵母Y2HGold中,培养后的4株Y2HGold分别100倍稀释涂布于SD/-Trp/-Leu/-Ade/-His-AbA培养基,结果显示,仅同时含有RNA聚合酶Ⅱ的文库质粒和BPE005诱饵质粒的Y2HGold能在该培养基上生长(图12),说明RNA聚合酶Ⅱ和BPE005具有较强的相互作用。
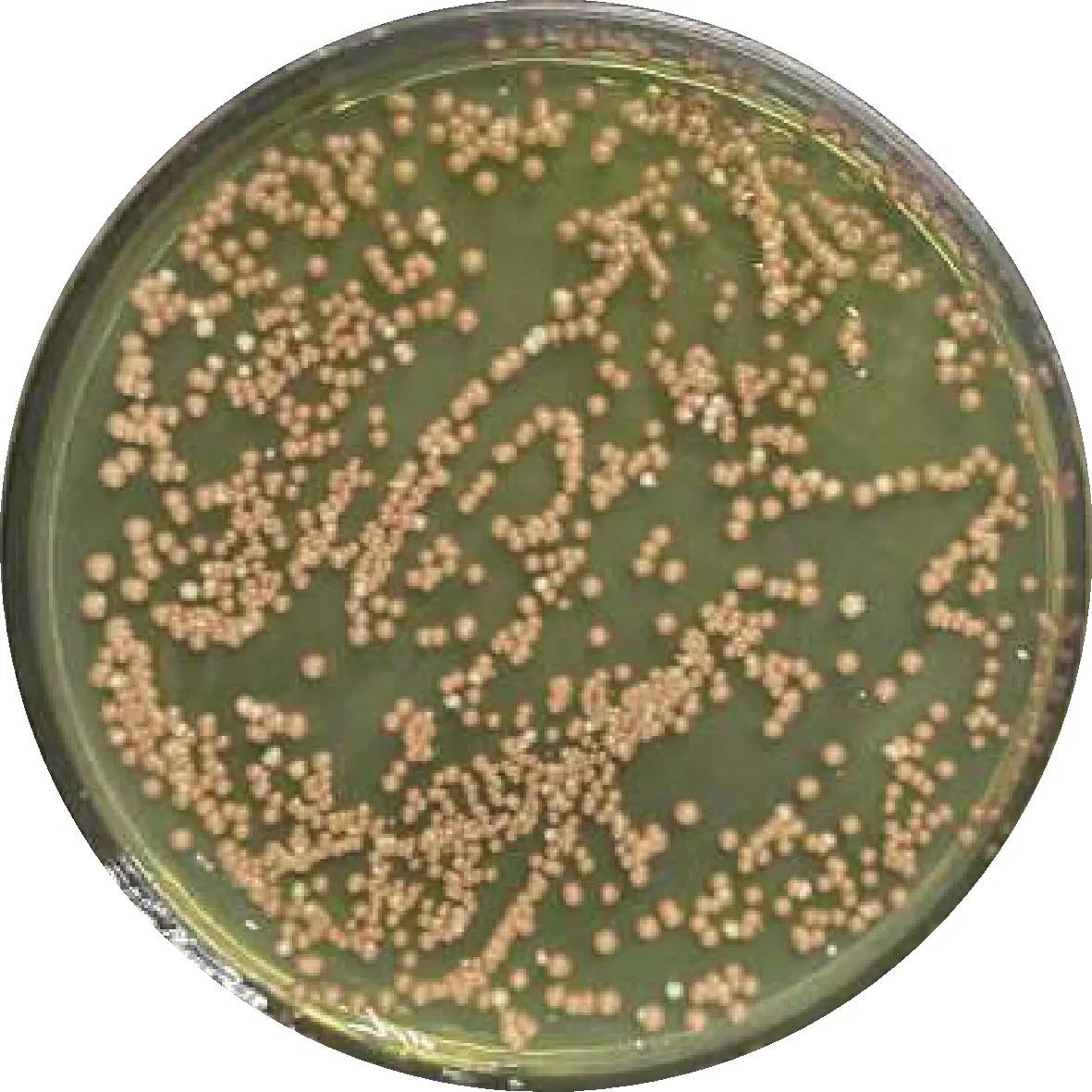
图12 酵母共转验证Fig.12 Verification of yeast co-transformation
2.8 RNA聚合酶Ⅱ多肽G蛋白相互作用网络分析
通过STRING在线软件分析RNA聚合酶Ⅱ的蛋白互作网络,结果显示,RNA聚合酶Ⅱ多肽G主要与RNA聚合酶Ⅱ多肽A(Polr2a)、RNA聚合酶Ⅱ多肽B(Polr2b)、RNA聚合酶Ⅱ多肽C(Polr2c)等11个蛋白发生相互作用(图13),它们的聚合共同组成了完整的RNA聚合酶Ⅱ。

图13 蛋白相互作用网络分析Fig.13 Protein-protein interaction network analysis
3 讨 论
布鲁氏菌作为成熟的胞内寄生菌,广泛的传播途径和成功的免疫逃逸机制使其被列为中国法律规定必须报告的二类动物疫病[11]。研究表明,布鲁氏菌不产生外毒素,没有荚膜、菌毛、质粒,缺乏内毒素特性的脂多糖,但是布鲁氏菌仍然具有较强的侵袭能力,能抵抗外界低氧、低pH、高活性氧的恶劣环境,因此研究布鲁氏菌的毒力因子和侵袭手段,是了解布鲁氏菌逃避宿主免疫应答机制所必需的[12-14]。
目前已经报道的布鲁氏菌的毒力基因有脂多糖、T4SS、超氧化物歧化酶、过氧化氢酶、环状β-1-2-葡聚糖、脲酶、细胞色素氧化酶、一氧化氮还原酶、双组分调控系统等,这些毒力基因在协助布鲁氏菌入侵和胞内生存,以及逃避宿主免疫应答方面都发挥着重要作用[15-16]。有报道称,Ⅳ型分泌系统缺失的布鲁氏菌对于体外刺激更加敏感,且无法使其丧失在胞内持续存活的能力,因此研究布鲁氏菌Ⅳ型分泌系统的功能成为当前的热点问题[17-18]。本试验对布鲁氏菌T4SS效应蛋白BPE005蛋白结构进行初步分析,发现BPE005具有多个活性结合位点,预示着BPE005可能极易与宿主细胞内的蛋白发生相互作用,继而影响宿主细胞的免疫应答途径。亚细胞定位结果发现,BPE005定位于宿主细胞的细胞核。细胞核是存在于真核细胞中的封闭式膜状胞器,内部含有细胞中大多数的遗传物质,是细胞遗传与代谢的调控中心,生命活动必需的基因复制、转录和转录初产物的加工过程均在此进行[19-20]。BPE005定位于细胞核,预示着其可能对于影响宿主细胞周期调控及遗传密码翻译具有十分重要的作用。
分泌蛋白在行使功能时往往是通过与宿主特定靶蛋白相互结合而发挥功能,本试验通过酵母双杂交系统首次鉴定出4个宿主细胞内与布鲁氏菌分泌蛋白BPE005存在相互作用的靶蛋白,分别是补体因子H、鸟苷酸环化酶、颗粒体蛋白和RNA聚合酶Ⅱ多肽G。补体因子H可通过结合补体因子C3b,抑制膜攻击复合物的形成,从而阻止细胞裂解,对补体激活中的旁路途径起到负反馈的作用[21-22]。鸟苷酸环化酶(cGMP)属于环化核苷酸的一种,可被G蛋白偶联受体激活的蛋白激酶活化,进而将胞外信号转导至细胞核[23]。颗粒体蛋白是近年来发现的一个独立的生长因子家族,由GRN基因编码。它的前体蛋白又称畸胎瘤细胞源性生长因子,能降低肿瘤坏死因子-α(TNF-α)的表达,抑制中性粒细胞的活性[24]。RNA聚合酶Ⅱ多肽G是“转录机器”的主要成分,不仅直接参与生物体RNA的合成,而且可以作为核酶催化一些重要的生化反应,在细胞的基因表达调控及生物体的生长发育中发挥着关键作用[25]。这些互作蛋白的鉴定,对后续研究BPE005的生物学功能具有十分重要的指导意义。
酵母双杂交系统在1989年由Fields在研究真核基因转录调控中首次建立,目前已成为鉴定及分析蛋白质-蛋白质间相互作用的最常用且最有效的工具之一[8]。但是双杂交系统分析蛋白间的相互作用定位于细胞核内,而许多蛋白间的相互作用依赖于核外的翻译后加工修饰,如糖基化、二硫键形成等,依赖于其他分子伴侣的辅助,这些反应在核内是无法进行的,酵母双杂交系统不能有效地筛选出这些蛋白,因此仍然有许多与BPE005存在相互作用的蛋白没有被筛选到。另外,某些蛋白自身具有激活转录功能,或表面含有对多种蛋白质的低亲和力区域,能与其他蛋白质形成稳定的复合物,这些都会引发报告基因的表达,产生“假阳性结果”。“假阳性”问题是影响酵母双杂交试验成功与否的重要因素,本试验采取酵母一对一共转验证法,以更加严格的筛选条件证明了BPE005与RNA聚合酶Ⅱ多肽G具有更强的相互作用,由于RNA聚合酶Ⅱ也定位于细胞核,推测BPE005可能是在细胞核上通过与RNA聚合酶Ⅱ相互作用从而发挥其生物作用。STRING相互作用网络分析表明,RNA聚合酶Ⅱ多肽G主要催化DNA的转录,合成mRNA和大多数snRNA、微RNA的前体,对于控制转录过程影响基因表达的模式、维持细胞生存所需的代谢过程、帮助细胞适应不同的环境具有重要意义[26]。布鲁氏菌T4SS效应蛋白BPE005是否会通过与RNA聚合酶Ⅱ多肽G的结合继而影响宿主细胞的基因表达调控,以抑制布鲁氏菌感染期间宿主细胞的免疫应答仍不清楚,研究其相互作用的生物学意义将是今后的重点方向。
4 结 论
布鲁氏菌T4SS效应蛋白BPE005定位于宿主细胞核,在宿主细胞内BPE005与RNA聚合酶Ⅱ多肽G具有较强相互作用,提示布鲁氏菌分泌蛋白BPE005将通过影响宿主细胞内的基因表达调控以抵抗宿主细胞免疫应答。

