槲皮素配伍芹菜素对顺铂诱导人胃上皮细胞损伤作用的研究
周志华 李耀伟 王志琪 李跃辉 何苗 丛梦静


〔摘要〕 目的 研究槲皮素配伍芹菜素抗順铂诱导人胃上皮细胞(GES-1)损伤作用。方法 运用分子对接技术将槲皮素和芹菜素与肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)蛋白对接。采用细胞实验方法,将GES-1细胞随机分为空白组、顺铂组、槲皮素+芹菜素组(40 μmol/L槲皮素配伍4 μmol/L芹菜素干预顺铂诱导GES-1细胞损伤)。噻唑蓝(methyl thiazolyl tetrazolium, MTT)法测定细胞存活率;Hoechst 33258染色剂测定细胞凋亡染色;线粒体膜电位探针(JC-1)测定细胞线粒体膜电位;活性氧探针(DCFH-DA)测定细胞内活性氧(reactive oxygen species, ROS)含量;微板法测定谷胱甘肽(glutathione, GSH)含量;硫微量操作法测定丙二醛(malondialdehyde, MDA)含量;钼酸铵法测定过氧化氢酶(catalase, CAT)含量;WST-1法测定超氧化物歧化酶(superoxide dismutase, SOD)含量;ELISA法测定TNF-α、IL-1β表达。结果 与空白组比较,顺铂组能升高GES-1细胞凋亡荧光度值、ROS和MDA含量、TNF-α和IL-1表达,降低线粒体膜电位、GSH、CAT、SOD含量(P<0.05或P<0.01);与顺铂组比较,槲皮素+芹菜素组能降低顺铂诱导的GES-1细胞凋亡荧光度值、ROS和MDA含量、TNF-α和IL-1表达,升高线粒体膜电位、CAT、GSH、SOD含量(P<0.05或P<0.01)。结论 顺铂能诱导GES-1细胞损伤,槲皮素配伍芹菜素能拮抗顺铂诱导GES-1细胞损伤,其作用与抑制GES-1细胞氧化应激、炎症反应和凋亡有关。
〔关键词〕 槲皮素;芹菜素;顺铂;GES-1细胞;凋亡;氧化应激;炎症反应
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.014
Effect of quercetin and apigenin on cisplatin-induced injury of human gastric epithelial cells
ZHOU Zhihua LI Yaowei WANG Zhiqi LI Yuehui HE Miao CONG Mengjing
(1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Research Center of Standardization and Functional Engineering of Traditional Chinese Medicine in Hunan Province, Changsha, Hunan 410208, China; 3. Hunan Academy of Chinese Medicine, Changsha, Hunan 410006, China)
〔Abstract〕 Objective To study the effect of quercetin and apigenin on human gastric epithelial (GES-1) cell injury induced by cisplatin. Methods Molecular docking technology was used to dock the quercetin and apigenin with tumour necrosis factor-α (TNF-α), interleukin-1β (IL-1β) proteins. Cell experiment method was used, GES-1 cells were randomly divided into blank group, cisplatin group and quercetin+apigenin group (40 μmol/L quercetin and 4 μmol/L apigenin interfered with cisplatin-induced GES-1 cell damage). Cell viability was determined by methyl thiazolyl tetrazolium (MTT) method; Hoechst 33258 was used to determine cell apoptosis staining; 5,5'6,6'-tetrachloro-1,1',3,3'-tetraethyl-imidacarbocyanine iodide (JC-1) was used to detect intracellular mitochondrial membrane potential; reactive oxygen species (ROS) were determined with 2,7-dichlorodidi-hydrofluorescein diacetate (DCFH-DA); glutathione (GSH) content was measured by microplate method; malondialone (MDA) content was measured by sulfur trace manipulation method; catalase (CAT) content was measured by ammonium molybdate method; WST-1 method was used to determine superoxide dismutase (SOD) content; the expression levels of TNF-α and IL-1β were determined by ELISA. Results Compared with blank group, cisplatin group increased fluorescence value of GES-1 cell apoptosis, ROS and MDA content, TNF-α and IL-1β expression, and decreased mitochondrial membrane potential, GSH, CAT and SOD content (P<0.05 or P<0.01); compared with the cisplatin group, quercetin+apigenin group decreased cisplatin-induced fluorescence value of GES-1 cell apoptosis, ROS and MDA content, TNF-α and IL-1β expression, and increased mitochondrial membrane potential, CAT, GSH and SOD content (P<0.05 or P<0.01). Conclusion Cisplatin can induce GES-1 cell injury, quercetin combined with apigenin can antagonize cisplatin-induced cell injury, which may be related to inhibiting cell oxidative stress, inflammatory response and apoptosis.25A77063-C2B2-471B-9E92-F11400E53F48
〔Keywords〕 quercetin; apigenin; cisplatin; GES-1 cells; apoptosis; oxidative stress; inflammatory response
化疗性胃肠损伤发生率高达90%,影响肿瘤治疗效果[1],研究中药复方或单体可改善化疗药物诱发的消化道损伤[2-3]。肺复方系湖南省中医药研究院附属医院协定方。该方由重楼、党参、女贞子、白花蛇舌草等12味中药组成,具有益气养阴、化瘀解毒、化痰散结功效[4]。前期实验研究发现[5],肺复方单用或联用顺铂可缓解气阴两虚Lewis肺癌模型小鼠神疲乏力、口干少饮的症状,增加脾脏指数。根据肺复方的方解,运用网络药理学方法测算出肺复方治疗胃炎、胃溃疡中有5味中药关键组分为槲皮素,3味中药关键组分为芹菜素,且均与肺复方化瘀解毒、益气养阴功效相关。文献报道,槲皮素和芹菜素对人胃上皮细胞(GES-1)损伤具有保护作用[6-7],两者均可降低细胞内活性氧(reactive oxygen species, ROS)、丙二醛(malondialdehyde, MDA)含量及肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)表达,升高谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)含量,从而拮抗顺铂毒性[8-9]。因此,本文为探讨槲皮素配伍芹菜素对顺铂诱导的胃黏膜损伤保护作用及机制,在GES-1细胞上开展单体化合物配伍研究。
1 材料
1.1 分子对接数据库与软件
中药系統药理数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)、PDB蛋白质结构数据库、Auto Dock Tools 4.2.1软件。
1.2 实验细胞系
人胃上皮细胞(GES-1)购于赛库生物公司,货号:CC4026。
1.3 主要试剂与仪器
顺铂(批号:P4394)购于美国Sigma公司;槲皮素标准品(批号:B20527)、芹菜素标准品(批号:B20981)均购于上海源叶生物科技有限公司;N,N-二甲基甲酰胺(DMF)(批号:D112007-100ml)购于上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO)(分析级,批号:D806645)购于上海麦克林生化科技有限公司;特级胎牛血清(批号:164210-50)、RPMI1640培养基(批号:PM150110)、PBS缓冲液(批号:PB180327)、胰蛋白酶(批号:PB180226)均购于普诺赛生物公司;GSH试剂盒(批号:A006-2-1)、过氧化氢酶(catalase, CAT)试剂盒(批号:A007-1-1)、SOD试剂盒(批号:A001-3)、MDA试剂盒(批号:A003-1-2)均购于南京建成公司;BCA蛋白试剂盒(批号:E-BC-K318-M)、TNF-α试剂盒(批号:E-EL-H0109c)、IL-1β茁试剂盒(批号:E-EL-H0149c)均购于伊莱瑞特生物科技有限公司;噻唑蓝(MTT)(批号:M8180)、Hoechst 33258染色液(批号:C0021)、线粒体膜电位试剂盒(JC-1)(批号:M8650-100T)均购于索莱宝生物科技有限公司。
3111型CO2培养箱(美国Thermo公司);1510型全波长酶标仪(美国Thermo公司);75002420型高速冷冻离心机(美国Thermo公司);990型超低温冰箱(美国Thermo公司);BX51型倒置显微镜(日本OLYMPUS公司);TS2-FL型荧光倒置显微镜(日本Nikon公司);KM-500DE型超声波清洗仪(昆山市超声仪器有限公司);SSW-420-2S型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);SHZ-C型水浴恒温振荡器(上海跃进医疗器械有限公司)。
2 方法
2.1 分子对接技术测算槲皮素和芹菜素与TNF-α、IL-1β的结合能
从PDB数据库以物种为Homo sapiens、蛋白分辨率2.0~3.0为条件,获取TNF-α、IL-1β 3D结构的PDB格式文件;TCMSP数据库获取槲皮素和芹菜素的mol2格式文件。利用Auto Dock Tool 4.2.6软件对蛋白进行去水、加氢优化,保存为pdbqt格式文件,作为受体;对槲皮素和芹菜素添加原子电荷,设置可旋转键,保存为pdbqt格式文件,作为配体。将槲皮素和芹菜素与TNF-α、IL-1β进行对接,若结合能≤-5.0 kcal/mol[10]认为配体和受体结合越稳定,可作为肺复方治疗胃炎、胃溃疡关键组分及蛋白的筛选依据。
2.2 试药的制备
顺铂、槲皮素、芹菜素储备液:取适量顺铂溶于DMF,制备浓度为80 mmol/L的储备液;槲皮素、芹菜素溶于DMSO,分别制备浓度为40、100 mmol/L的储备液,0.22 μm针头式一次性过滤器除菌后分装于200 μL的EP管中,-20 ℃条件下保存备用。
噻唑蓝储备液:将适量MTT溶解于PBS中,涡旋混匀,使之成为5 mg/mL的MTT储备液,0.22 μm针头式一次性过滤器除菌后分装于10 mL的离心管中,-20 ℃条件下保存备用。
2.3 试药浓度的确定
取对数生长期的GES-1细胞接种于96孔板中,按照每孔100 μL、每孔1×104个细胞,在5% CO2、37 ℃条件下培养,细胞生长70%~80%时,弃去培养基,设空白组、调零孔组,2、4、8、16、32、64 μmol/L顺铂组,5、10、20、40、80 μmol/L槲皮素配伍4、8、16 μmol/L芹菜素组。培养24 h后,吸出药液,加入100 μL浓度为0.5 μmol/L 的MTT,培养箱内孵育4 h,弃去MTT,加入100 μL DMSO,置于摇床低速震荡10~15 min,使用酶标仪在490 nm处测定吸光度,细胞存活率=[A给药组-A调零孔组]/[A空白组-A调零孔组]×100%。25A77063-C2B2-471B-9E92-F11400E53F48
2.4 测定槲皮素配伍芹菜素对顺铂诱导的GES-1细胞存活率的影响
根据“2.3”项培养细胞,细胞生长70%~80%时弃去培养基,空白组加入100 μL RPMI1640培养基,顺铂组根据“2.3”项选定浓度加入100 μL顺铂溶液,槲皮素配伍芹菜素组根据“2.3”项选定浓度给药,加入50 μL相应药物,培养1 h后,加入50 μL与顺铂组相同浓度的顺铂溶液,其余步骤参照“2.3”项。
2.5 检测GES-1细胞凋亡、线粒体膜电位及ROS含量
取对数生长期的GES-1细胞接种于12孔板中,按照每孔1 mL、每孔2×105个细胞,在5% CO2、37 ℃条件下培养24 h,弃去培养基,空白组加入1 mLRPMI1640培养基,顺铂组根据“2.3”项选定浓度加入1 mL顺铂溶液,槲皮素配伍芹菜素组根据“2.4”项选定浓度给药,加入500 μL相应药物,培养1 h后,加入500 μL与顺铂组相同浓度的顺铂溶液,培养24 h。按照Hoechst 33258试剂盒方法进行操作,使用荧光倒置显微镜观察GES-1细胞的定性片段化和浓缩染色来判断其凋亡程度,以荧光强度进行半定量分析[11];根据JC-1、ROS检测试剂盒说明书进行操作,使用荧光倒置显微镜观察、拍照。检测完成后均使用ImageJ软件对其进行分析。
2.6 检测GES-1细胞GSH、CAT、SOD、MDA含量及TNF-α、IL-1β表达水平
取对数生长期的GES-1细胞接种于6孔板中,按照每孔2 mL、每孔5×105个细胞,在5%CO2、37 ℃条件下培养24 h,弃去培养基,空白组加入2 mL RPMI1640培养基,顺铂组根据“2.3”项选定浓度加入2 mL顺铂溶液,槲皮素配伍芹菜素组根据“2.4”项选定浓度给药,加入1 mL相应药物,培养1 h后,加入1 mL与顺铂组相同浓度的顺铂溶液,培养24 h后参照试剂盒操作说明,采用微板法测定GSH含量,硫微量操作法测定MDA含量,钼酸铵法测定CAT含量,WST-1法测定SOD含量,并使用比色法测定蛋白浓度,采用ELISA法检测TNF-α、IL-1β水平。
2.7 统计学方法
采用SPSS 21.0统计软件对实验数据进行处理,若服从正态分布且满足方差齐性,则进行单因素方差分析,各组数据之间采用LSD多重比较;服从正态分布不满足方差齐性,则进行单因素方差分析,各组数据之间采用Games-Howell多重比较;若不服从正态分布,则进行非参数检验,计量资料以“x±s”表示。以P<0.05为差异有统计学意义。
3 结果
3.1 槲皮素和芹菜素与TNF-α、IL-1β的结合能
TNF-α、IL-1β与槲皮素结合能分别为-6.37、-6.28 kcal/mol,與芹菜素结合能分别为-7.27、-6.29 kcal/mol。
3.2 试药浓度的确定
与空白组比较,4、8、16、32、64 μmol/L顺铂作用于GES-1细胞24 h后,细胞存活率降低(P<0.05或P<0.01),且细胞存活率随顺铂浓度的升高而降低,IC50=(16.36±0.56) μmol/L,考虑细胞存活率对实验结果的影响,本实验选择16 μmol/L作为顺铂后续GES-1细胞给药浓度。5、10、20、40、80 μmol/L槲皮素配伍4 μmol/L芹菜素作用于GES-1细胞24 h后,不影响细胞存活率(P>0.05),由于80 μmol/L的槲皮素配伍芹菜素存活率出现下降趋势,故采用5、10、20、40 μmol/L槲皮素配伍4 μmol/L芹菜素作用于顺铂诱导GES-1细胞,确定槲皮素配伍芹菜素浓度。详见图1。
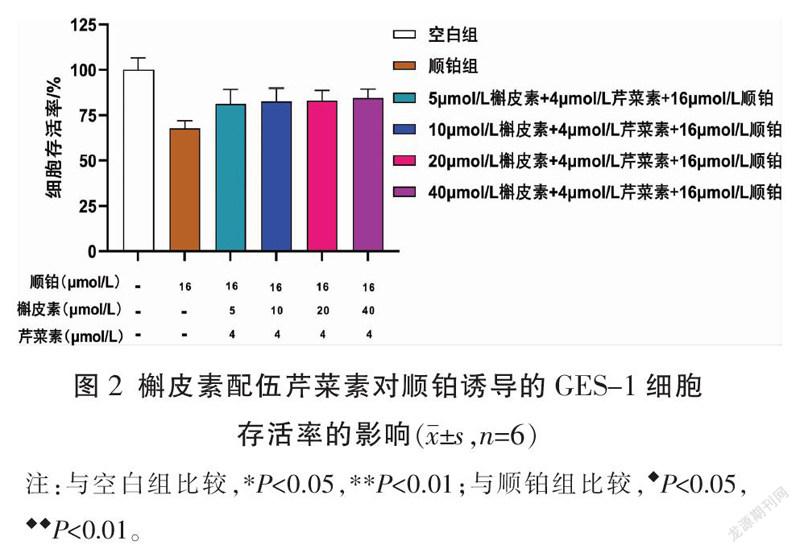
3.3 槲皮素配伍芹菜素提高顺铂诱导的GES-1细胞的存活率
与空白组比较,顺铂组的GES-1细胞存活率降低(P<0.01);5、10、20、40 μmol/L槲皮素配伍4 μmol/L芹菜素可使GES-1细胞存活率升高(P<0.05),故采用40 μmol/L槲皮素和4 μmol/L芹菜素进行后续实验。详见图2。
3.4 槲皮素配伍芹菜素抑制顺铂诱导的GES-1细胞凋亡
与空白组比较,顺铂组诱导GES-1细胞凋亡,细胞核由于凋亡浓集呈亮蓝色或核呈分叶、碎片状、边集形态,促进GES-1细胞凋亡(以荧光度值作为评价标准)(P<0.01);显微镜观察到槲皮素配伍芹菜素组细胞形态逐渐恢复正常,圆形、淡蓝色的正常细胞数量逐渐增加。与顺铂组比较,槲皮素配伍芹菜素组GES-1细胞凋亡降低(P<0.05)。详见表1、图3。
3.5 槲皮素配伍芹菜素升高顺铂诱导的GES-1细胞线粒体膜电位
与空白组比较,顺铂组GES-1细胞线粒体膜电位降低(以红绿荧光比值作为评价标准)(P<0.01);与顺铂组比较,槲皮素配伍芹菜素GES-1细胞线粒体膜电位升高(P<0.01)。详见表1、图4。
3.6 槲皮素配伍芹菜素降低顺铂诱导的GES-1细胞ROS含量
与空白组比较,顺铂组GES-1细胞内ROS含量升高(以荧光度值作为评价标准)(P<0.01);与顺铂组比较,槲皮素配伍芹菜素GES-1细胞内ROS含量降低(P<0.01)。详见表1、图5。
3.7 槲皮素配伍芹菜素对顺铂诱导的GES-1细胞氧化应激指标、炎症因子的影响
与空白组比较,顺铂组GES-1细胞内GSH、CAT、SOD含量和TNF-α、IL-1β表达升高,MDA含量降低(P<0.05或P<0.01);与顺铂组比较,槲皮素配伍芹菜素GES-1细胞GSH、CAT、SOD含量升高,MDA含量及TNF-α、IL-1β表达降低(P<0.05或P<0.01)。详见表2。25A77063-C2B2-471B-9E92-F11400E53F48
4 讨论
中药有效组分配伍遵循传统方剂的配伍理论与原则,具有成分清楚、作用靶点明确、质量可控的特点,可为中医方剂配伍研究提供研究基础[12]。经网络药理学测算出槲皮素和芹菜素是肺复方治疗胃炎、胃溃疡的关键组分,该方由重楼、党参、女贞子、半枝莲等12味药组成,其中有5味中药关键组分为槲皮素,3味中药关键组分为芹菜素。现有文献表明,肺复方组方药材的槲皮素含量高于芹菜素,对组方药材中槲皮素和芹菜素的含量进行计算得出槲皮素和芹菜素比例范围是15∶1~8∶1[13-16]。故本实验选择槲皮素配伍芹菜素作为研究对象,结合已有研究表明,槲皮素给药GES-1细胞浓度小于100 μmol/L[6],芹菜素给药GES-1细胞浓度小于20 μmol/L[17]以及对槲皮素配伍芹菜素给药浓度的探索,确定40 μmol/L槲皮素配伍4 μmol/L芹菜素在GES-1细胞上对肺复方抗顺铂诱导的胃黏膜损伤作用进行研究。
文献表明,顺铂的细胞毒性作用主要与ROS参与氧化应激、炎症反应及细胞凋亡有关[8-9]。ROS包含超氧阴离子、过氧化氢和羟自由基,顺铂可诱导上述自由基的形成从而诱发细胞毒性[18]。本研究结果显示,顺铂能降低GES-1细胞存活率,升高细胞内ROS含量;槲皮素配伍芹菜素可提高顺铂诱导的GES-1细胞存活率,降低细胞内ROS含量,证实槲皮素配伍芹菜素能拮抗顺铂诱导的GES-1细胞损伤,其作用与抑制顺铂诱导ROS生成的细胞毒性有关。
ROS包含多种自由基,机体存在GSH、CAT、SOD等抗氧化酶系,可清除过度氧化反应所产生的自由基。有学者指出,顺铂诱导胃肠损伤与抑制抗氧化酶有关[19],且抗氧化酶系含量降低及过氧化作用产物MDA升高常作为顺铂诱导氧化损伤的重要标志物[20]。本研究结果显示,槲皮素与芹菜素配伍干预顺铂诱导的GES-1细胞后,GSH、CAT、SOD含量降低,MDA含量升高。实验结果证实,槲皮素配伍芹菜素通过升高抗氧化酶系含量,降低过氧化作用产物,改善GES-1细胞中氧化应激反应,起到保护胃黏膜的作用。
胃黏膜组织中出现大量的炎症细胞是胃肠黏膜损伤特征之一,而炎症细胞产生多种炎症介质则进一步加重胃黏膜损伤[21]。TNF-α、IL-1β是核因子κB(nuclear factor-kappa light chain enhancer of B cells, NF-κB)通路上的关键蛋白,与细胞膜表面受体TNFR和IL-1R结合可激活NF-κB通路,促进炎症因子TNF-α和IL-6的生成,导致胃黏膜炎症的发生发展,从而加重胃溃疡 [22]。分子对接结果表明,槲皮素和芹菜素与TNF-α、IL-1β蛋白结合能力强,本次实验表明,槲皮素配伍芹菜素通过降低顺铂诱导的GES-1细胞中TNF-α和IL-1β表达,改善GES-1细胞中炎症反应。
细胞内的ROS过多会影响GES-1细胞线粒体功能,线粒体是传递凋亡信号的主要细胞器,其膜电位的改变是细胞凋亡发生的标志之一[23]。本研究以细胞凋亡染色、线粒体膜电位为细胞凋亡指标,检测槲皮素配伍芹菜素对顺铂诱的GES-1细胞凋亡的影响。实验结果表明,槲皮素与芹菜素配伍后减少顺铂诱导的GES-1细胞凋亡数量,降低凋亡细胞荧光强度,升高GES-1细胞线粒体膜电位,证实槲皮素配伍芹菜素可能通过减少GES-1细胞凋亡,升高线粒体膜电位,从而保护顺铂诱导损伤。
综上所述,肺复方治疗胃炎、胃溃疡的关键组分槲皮素配伍芹菜素可拮抗顺铂诱导GES-1细胞的损伤,作用环节涉及降低GES-1细胞中ROS含量,缓解顺铂引起GES-1细胞凋亡、氧化应激和炎症反应。肺复方可能作用于ROS和NF-κB通路缓解铂类药物引起的胃黏膜损伤保护胃,其改善顺铂诱导胃黏膜损伤的具体机制仍需进一步探究。
参考文献
[1] 广东省药学会.铂类药物临床应用与不良反应管理专家共识[J].今日药学,2019,29(9):577-585.
[2] 杜 静,张启龙,李贵生,等.小半夏汤对化疗致胃肠黏膜炎模型大鼠胃肠组织NF-κB、IL-1β、TNF-α mRNA和蛋白表达水平的影响[J].山东中医杂志,2018,37(12):1020-1026.
[3] 姜少萍,于 晶,林 鹏,等.姜黄素对顺铂所致胃组织ICC损伤的保护作用及机制[J].现代生物医学进展,2019,19(5):838-841.
[4] 李跃辉,彭艳梅,王志琪,等.基于QbD理念的肺复方颗粒醇提工艺研究[J].湖南中医杂志,2021,37(1):155-159.
[5] 周志华,李耀伟,王志琪,等.肺复方联合顺铂对气阴两虚Lewis肺癌荷瘤小鼠的影响[J].湖南中医杂志,2022,38(3):165-170.
[6] HU X T, DING C, ZHOU N, et al. Quercetin protects gastric epithelial cell from oxidative damage in vitro and in vivo[J]. European Journal of Pharmacology, 2015, 754: 115-124.
[7] KUOCH, WENGB C, WU C C, et al. Apigenin has anti-atrophic gastritis and anti-gastric cancer progression effects in Helicobacter pylori-infected Mongolian gerbils[J]. Journal of Ethnopharmacology, 2014, 151(3): 1031-1039.
[8] 彭媛媛,馬于林,林明莹,等.槲皮素保护顺铂诱导的H9c2细胞损伤的作用机制[J].武汉大学学报(医学版),2019,40(4):524-528.25A77063-C2B2-471B-9E92-F11400E53F48
[9] HE XX, LI C M, WEI Z K, et al. Protective role of apigenin in cisplatin-induced renal injury[J]. European Journal of Pharmacology, 2016, 789: 215-221.
[10] HSINKY, GHOSHS, KITANOH. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922.
[11] 业 康,韩月丹,毛培江,等.制草乌配方颗粒与饮片煎剂对H9c2心肌细胞毒性的比较研究[J].中国现代应用药学,2019,36(13): 1622-1626.
[12] 张伯礼,王永炎.方剂关键科学问题的基础研究:以组分配伍研制现代中药[J].中国天然药物,2005,3(5): 258-261.
[13] 胡雁萍,赵 迪,李焕茹,等. UPLC-Q-Exactive Orbitrap高分辨质谱定量分析不同产地、炮制前后女贞子中9种成分的含量[J]. 天然产物研究与开发,2021,33(8):1308-1319.
[14] 王 勇,杨秀荣,张 丽,等. HPLC法同时测定白花蛇舌草中槲皮素和东莨菪内酯的含量[J].中国药师,2019,22(9):1761-1763.
[15] 付 娟,杨世海,黄林芳.超高效液相色谱法同时测定黄芪中6种黄酮类成分的含量[J].中国药学杂志,2013,48(11):916-919.
[16] 夏云岭,张振凌,张洪坤,等. HPLC法同时测定半枝莲饮片中4种黄酮类成分的含量及主成分分析[J].中国药房,2019,30(20):2839-2844.
[17] 蒋 迪,刘 飞,黄秋林.芹菜素选择性抑制人胃癌细胞活力和诱导细胞凋亡[J].湖南师范大学学报(医学版),2010,7(3):11-13.
[18] BOCK F J, TAIT S. Mitochondria as multifaceted regulators of cell death[J]. Nature Reviews Molecular Cell Biology, 2019, 21(2):85-100.
[19] GEYIKOGLU F, ISIKGOZ H, ONALAN H, et al. Impact of high-dose oleuropein on cisplatin-induced oxidative stress, genotoxicity and pathological changes in rat stomach and lung[J]. Journal of Asian Natural Products Research, 2017, 19(12): 1214-1231.
[20] LI W, YAN M H, LIU Y, et al. Ginsenoside Rg5 ameliorates cisplatin-induced nephrotoxicity in mice through inhibition of inflammation, oxidative stress, and apoptosis[J]. Nutrients, 2016, 8(9): 566.
[21] GRAINGER J R, KONKEL J E, ZANGERLE-MURRAY T, et al. Macrophages in gastrointestinal homeostasis and inflammation[J]. PflügersArchiv-European Journal of Physiology, 2017, 469(3/4): 527-539.
[22] 張录梅,周熙祥,张秋菊,等.温胃舒胶囊通过抑制核因子κB(NF-κB)通路减轻慢性胃炎大鼠胃黏膜损伤[J].细胞与分子免疫学杂志,2020,36(4):297-303.
[23] ALY H A A, EID B G. Cisplatin induced testicular damage through mitochondria mediated apoptosis, inflammation and oxidative stress in rats: Impact of resveratrol[J]. Endocrine Journal, 2020, 67(9): 969-980.
(本文编辑 苏 维)25A77063-C2B2-471B-9E92-F11400E53F48

