卡维地洛对溃疡性结肠炎大鼠脂质过氧化产物和炎症因子的影响
彭 昭,吴 娜,牛志涛,高会斌,李 多
(河北北方学院附属第一医院消化内科,河北 张家口 075000)
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(CD)和溃疡性结肠炎(UC),是一种反复发作、缓解与活动交替的慢性结肠炎症,长期罹患可增加结肠癌患病风险[1]。亚洲人群发病率为3~15例/10万,且发病率逐年升高[2]。氧化应激和炎症反应在UC的发病和黏膜不可逆性损伤中具有重要作用,减少氧化应激和增加抗氧化作用可能是一种有效治疗UC方法。卡维地洛能降低消化性溃疡大鼠胃液分泌。我们拟使用乙酸(acetic acid,AA)诱导溃疡性结肠炎大鼠模型,给予卡维地洛干预,探讨其抗氧化机制,以期为UC治疗提供参考。
1 材料与方法
1.1 材料
选取30只12周龄雄性大鼠为实验对象,体质量250~280 g,实验条件为室温24~25℃,湿度55%,昼夜节律为12 h光照/黑暗。自由饮水和自由进食鼠粮。实验中所有步骤均符合动物实验伦理委员会要求,获得动物实验伦理委员会批准。
1.2 方法
30只大鼠随机分成5组,每组6只,分组:①空白对照组(Cont);②乙酸处理组(AA);③卡维地洛预处理组(CarV),使用卡维地洛30 mg·kg-11次·d-1灌胃预处理;④卡维地洛治疗组(CarV+AA),使用卡维地洛30 mg·kg-11次·d-1灌胃对UC大鼠干预;⑤美沙拉嗪治疗组(MES+AA),使用美沙拉嗪100 mg·kg-11次·d-1灌胃对UC大鼠干预。建构UC大鼠模型后,所有治疗组均进行7 d治疗,其他组使用等量盐水替代,然后断头处死大鼠,取结肠组织5~6 cm,生理盐水冲洗并称重,取1 cm结肠组织固定于4%甲醛溶液用于组织病理学检查,余下结肠组织-80℃冰箱保存待用。
1.2.1 UC大鼠造模
根据Mousavizadeh提供的实验方法[3],将大鼠以3%戊巴比妥腹腔麻醉(40 mg·kg-1),取头低位尾高位,使用直径为2.7 mm的聚丙乙烯导管经肛门缓慢插入结肠4 cm并注入5%AA 4 mL,给药后水平放置2 min,防止漏液。每日评估大鼠疾病活动指数,DAI=(体质量下降分数+大便粘稠度+便血程度)/3,DAI值大于3为造模成功,记录造模时间。造模成功后开始进行药物干预。Cont、CarV组使用等体积生理盐水进行同样操作。
1.2.2 结肠黏液含量测定
取1 cm大鼠结肠组织称湿重后将其浸泡于1%阿尔新蓝溶液(pH 5.0)24 h,然后将其捞出,0.16 mol·L-1蔗糖溶液冲洗多余染料,0.5 mol·L-1MgCl2溶液提取结肠壁黏液络合染料。将蓝色提取液与乙醚按1∶1比例混合摇匀后,4 000 rpm离心10 min,取上清液置于分光光度计在波长为580 nm处测定吸光度。计算湿结肠提取阿尔新蓝的量(μg·mg-1)。
1.2.3 结肠中炎症因子测定
使用双抗体夹心ELISA法检测炎症因子白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、前列腺素E2(PGE2)水平,方法:取结肠组织1 cm,4 ℃预冷PBS漂去组织血渍,滤纸吸干残留PBS,称重,加入裂解液匀浆(在冰上),将得到的匀浆液用液氮反复冻融3次,室温静置30 min,4 ℃ 15 000 rpm离心1 h,取上清严格按照试剂盒步骤进行检测,以pg·mg-1蛋白计量。一氧化氮(NO)采用硝酸还原酶法测定:取结肠组织100 mg,按照重量比1∶9加入生理盐水进行组织匀浆,将得到的匀浆液用液氮反复冻融3次,室温静置30 min,4 000 rpm离心30 min后取上清0.5 mL严格按照试剂盒进行检测,NO以mmol·g-1蛋白计量。
1.2.4 结肠组织中脂质过氧化物(LPO)测定
自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛,可引起蛋白质、核酸等大分子交联聚合,且具有细胞毒性,可反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度。采用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)测定结肠组织中LPO代谢产物丙二醛(MDA)含量。取大鼠结肠组织500 mg,液氮冻存后碾成粉状,0 ℃加入裂解液500 μL,强力震荡5 s,4 ℃ 6 000 rpm离心10 min后取上清10 μL,加入工作液后60 ℃恒温孵育60 min,冷却后,用分光光度法在532 nm处测定上清液的吸光度。结果以nmol·mg-1蛋白计量。
1.2.5 结肠组织的病理学评估
结肠组织横切面用10%甲醛溶液固定,电脑生物包埋机自动进行脱水、透明程序;蜡块包埋,按照厚度4 μm切片,脱蜡至水,样本HE染色,2名病理医师观察。主要观察黏膜形态,包括黏膜溃疡、充血、坏死、水肿、细胞浸润和杯状细胞增生等。
1.3 统计学方法

2 结 果
2.1 结肠湿重及黏液含量比较
CarV组与Cont组结肠湿重及黏液含量差异无统计学意义(P>0.05),AA组大鼠结肠平均湿重(mg·cm-1)明显高于Cont组(P<0.01),Carv+AA组和MES+AA组大鼠结肠平均湿重明显低于AA组(P<0.01)(图1A)。与Cont组相比,AA组大鼠结肠黏液含量减少(P<0.01),Carv+AA组、MES+AA组大鼠结肠黏液含量高于AA组(P<0.01)(图1B)。
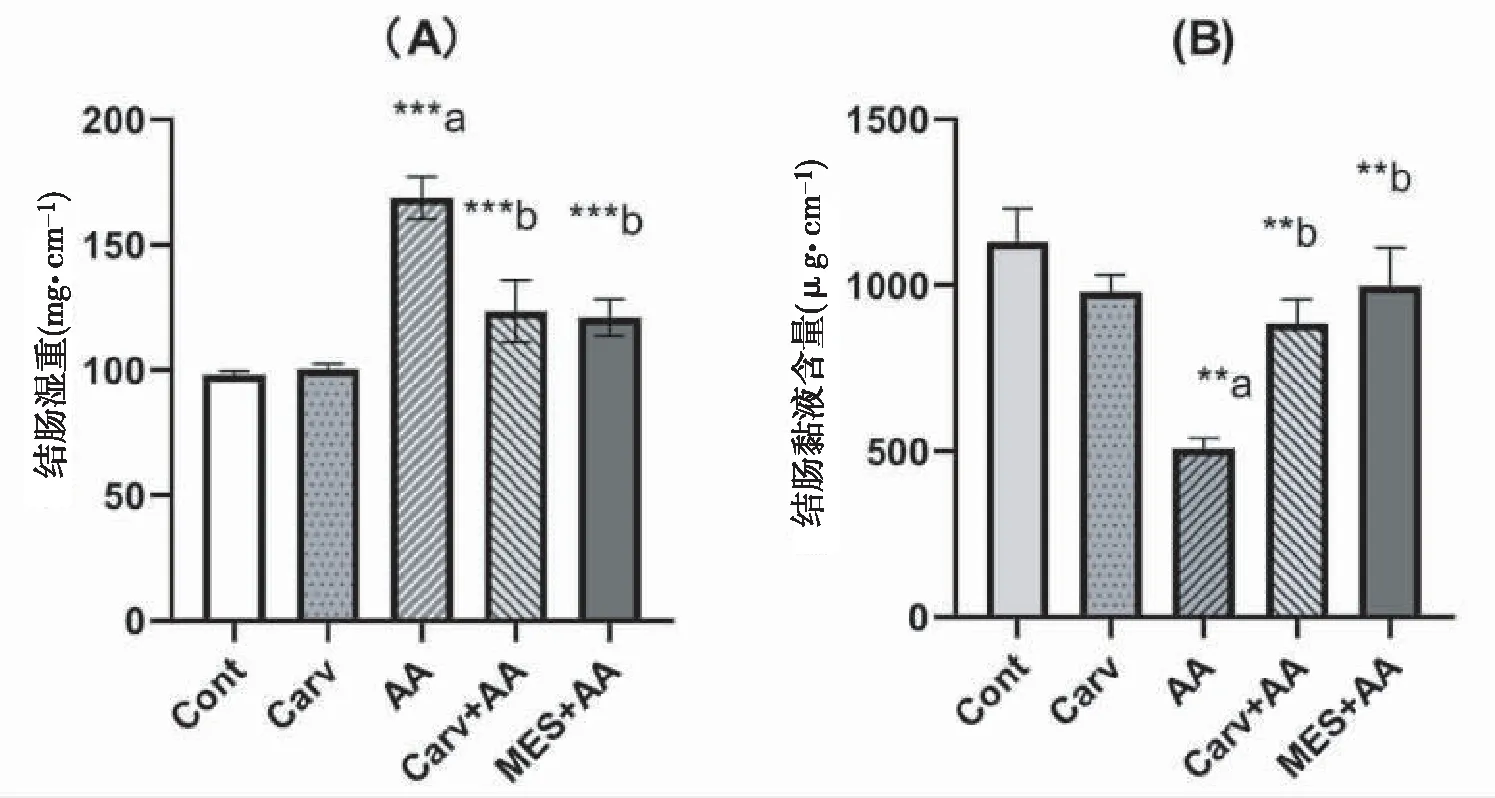
注:组间比较*P<0.05,**P<0.01,***P<0.0001;a表示与Cont组比较,b表示与AA组比较。
2.2 卡维地洛对UC大鼠结肠黏膜TNF-α、IL-1β、IL-6及PGE2、NO的影响
给药24 h后,AA组结肠组织中炎症因子TNF-α、IL-1β、IL-6水平较Cont组升高(P均<0.01),Carv+AA组较AA组减低(P<0.01,P<0.05,P<0.01)(图2 A~C)。AA组结肠中PGE2水平和NO水平较Cont组均升高(P<0.01,P<0.05);与AA组相比,Carv+AA组PGE2和NO水平显著降低(P均<0.05)(图2 D~E)。
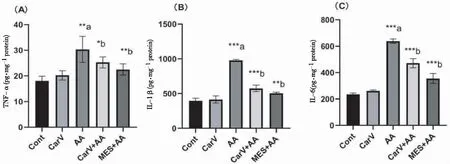
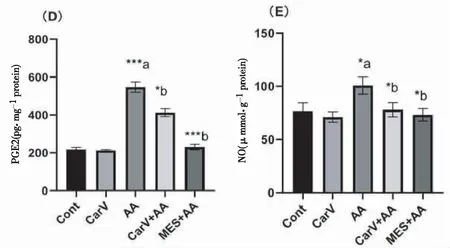
注:组间比较*P<0.05,**P<0.01,***P<0.0001;a表示与Cont组比较,b表示与AA组比较。
2.3 卡维地洛对UC大鼠结肠黏膜MDA水平的影响
AA组MDA水平较Cont组明显升高(P<0.01),MES+AA组MDA水平较AA组明显减低(P<0.01),CarV+AA组MDA水平较AA组差异无统计学意义(P>0.05)(图3)。

注:组间比较*P<0.05,**P<0.01,***P<0.0001;a表示与Cont组比较,b表示与AA组比较。
2.4 卡维地洛对UC大鼠肠黏膜病理改变的影响
光镜下对大鼠结肠横截面进行组织病理学观察,Cont组大鼠黏膜未见坏死及炎症浸润。AA组可见弥漫性坏死、水肿及炎症细胞浸润,以中性粒细胞为主,伴有杯状细胞增生。Carv+AA组可见上皮细胞轻度愈合,伴中度坏死和炎症,杯状细胞较AA组减少。MES+AA组较AA组肠道黏膜明显愈合和改善,较CarV+AA组改善更为明显(表1)。

表1 卡维地洛对UC大鼠肠黏膜病理改变的影响
3 讨 论
已知多种免疫、遗传和环境因素均参与UC的发病和进展,主要临床表现有黏液脓血便、发热及体质量减轻,病理学改变为肠黏膜腺窝内炎性渗出增加。氧化应激和炎症反应可共同导致中性粒细胞、单核细胞产生大量氧自由基,引起UC发病和黏膜不可逆性损伤。在UC模型中,循环吞噬系统内可检测到大量活性氧簇(ROS)[4],可能引起炎症和免疫反应,直接或间接损害肠上皮细胞,启动炎症信号级联反应导致结肠黏膜完整性受损,从而引发UC[5]。在IBD中,促炎细胞因子水平升高在影响疾病严重程度中起关键作用[6]。ROS和活性氮(RNS)产生过量可导致LPO增加,组织蛋白变性,核酸序列突变[7]。LPO作为氧化应激产物可降低细胞抗氧化能力。减少氧化应激和增加抗氧化作用可能是一种有效治疗UC方法[8]。
AA诱导的UC大鼠实验模型在病理组织学上与人UC病理改变相似,主要影响远端结肠的非透壁性炎症,导致黏膜及黏膜下层坏死、水肿、中性粒细胞浸润及溃疡形成。AA质子化形式释放出细胞内的质子引起大量细胞内酸化导致自由基产生增加,加重氧化损伤,表现为黏膜损害。本研究采用第三代非选择性β-肾上腺素受体拮抗剂卡维地洛对UC大鼠模型进行干预,结果显示卡维地洛可有效抵抗氧化应激和炎症反应从而达到保护结肠黏膜的目的。卡维地洛是一种有多重作用的神经体液拮抗剂,具有非选择性β阻滞、α阻滞和抗氧化特性,常用于治疗高血压。近期研究表明其对短暂性脑缺血发作有神经保护作用;在急性心梗模型中,对心肌细胞及血管内皮细胞均有保护作用;另外,卡维地洛还可抑制细胞凋亡、抗炎、保护线粒体、阻滞钙离子通道;在心血管缺血和再灌注模型中,卡维地洛还表现出清除自由基,减少LPO产生,通过其抗氧化性对心肌产生保护作用[9]。在其中发挥抗氧化作用的是咔唑啉,其抗氧化作用是维生素E的10倍。
氧化应激在IBD相关肠道损伤中增加自由基的产生和抑制内源性抗氧化防御系统起关键作用[10],可引起受损区域白细胞浸润,导致肠道屏障完整性受损,包括细胞因子、花生四烯酸代谢产物等炎症介质释放,还可导致活性氧簇增加[11]。本研究中,AA增加结肠湿重与结肠溃疡形成、坏死、杯状细胞增生、炎症浸润相关。结肠黏膜屏障功能缺陷是炎症性肠病特征之一,AA显著改变了保护性结肠黏液的含量[12],黏液层可增强化学损伤上皮细胞修复[13]。本研究结果显示,卡维地洛治疗组UC大鼠给药后增加的结肠重量减少,病理学观察结肠炎症减轻;卡维地洛处理后对UC大鼠肠壁黏液也有抑制作用,可能与卡维地洛抗氧化和抗炎作用有关。有研究表明,卡维地洛可减少酸的分泌,降低LPO产物,增强由坏死引起的抗氧化作用[14]。
促炎介质在IBD发病机制中起至关重要的作用,可调节黏膜免疫系统,通过中性粒细胞和巨噬细胞浸润改变上皮完整性引起结肠黏膜损伤。粒细胞和其他白细胞迁移到发炎的黏膜和浅表溃疡导致促炎细胞因子过量产生,相关研究结果支持促炎细胞因子可作为判断疾病严重程度的指标[15]。本研究中,AA组大鼠结肠组织中IL-1β、TNF-α和IL-6明显增加,光镜下见上皮细胞坏死、水肿、中性粒细胞浸润,PGE2和NO水平增加,与相关研究结果一致[16]。PGE2和NO水平分别受细胞酶COX-2和iNOS调控,而这两种酶在UC活动期均增高[17]。本研究中,卡维地洛治疗组较AA组大鼠结肠促炎细胞因子水平显著降低。有报道卡维地洛在犬慢性缺血模型中具有抗炎和促血管生成作用,卡维地洛可下调许多炎症介质和细胞因子表达,与本研究结果一致。
综上,卡维地洛可降低乙酸诱导的UC大鼠模型肠黏膜损伤,可能因其抗炎作用和抗氧化特性,推测卡维地洛的抗炎作用可能是通过抑制炎症介质和细胞酶介导的。

