SATB1与胃癌关系的研究进展*
彭辛欣, 刘浩楠, 肖 焘
(1中山大学附属第七医院,广东 广州 510080;2南昌大学医学院,江西 南昌 330031;3南昌大学第一附属医院胃肠外科,江西 南昌 330006)
胃癌作为一种多因素、多过程的恶性肿瘤,有着较高的发病率和死亡率,对人类健康造成严重威胁。依据国际癌症研究机构(International Agency for Research on Cancer,IARC)[1]公布的数据,2018年全球胃癌发病数位列常见恶性肿瘤第五位,同时也是全球第三大癌症死亡病因,亟需手段改善胃癌的预防、早期诊断和治疗策略,而实现这些均有赖于胃癌相关基础研究的进展。
现有研究已证实,转录调控蛋白能够调控包括人肿瘤细胞在内的真核细胞基因转录过程。这些蛋白的调节作用不仅影响染色体基因组表达的数量,还能影响基因表达的时空秩序,进而导致真核细胞生物的生长发育异常。特殊AT富集序列结合蛋白1(special AT-rich sequence-binding protein 1,SATB1)的基因位于人类第3 号染色体第3 短臂的23 区,可编码含有763 个氨基酸的蛋白质[2-3]。SATB1 与核基质中的碱基非配对区(base-unpairing region)结合后可使染色质折叠形成环状结构[4],还可通过调节组蛋白乙酰化和甲基化等多种途径对1 000 多个基因的表达进行调控[5-6]。SATB1 最早于2008年被发现与乳腺癌的转移密切相关,其后又在皮肤基底癌、消化系统肿瘤、泌尿系统肿瘤、妇科肿瘤等多种恶性肿瘤组织中被发现过表达并被认为能够调控肿瘤细胞的增殖与侵袭行为[7]。近年来SATB1 被报道参与胃癌的多个病程阶段,而且与胃癌的临床诊治密切相关,具备潜在的临床转化价值。因此,本文将从胃癌的发生、进展、结局、转归、诊断、治疗等方面,完整介绍SATB1 与胃癌的最新研究进展,并总结现有研究成果,为胃癌的基础与临床研究提供新线索。
1 SATB1与胃癌的发生
胃癌的发病因素较多,如环境因素、年龄和性别、遗传因素、幽门螺杆菌(Helicobacter pylori,HP)感染、血清胃蛋白酶原、饮食习惯等[8]。当前研究发现SATB1 在胃组织中异常表达与胃黏膜萎缩、肠上皮化生及HP 感染直接相关,此外还可能与家族肿瘤史等因素相关。
1.1 SATB1 表达异常与胃癌发生 2012年Zuk 等[9]发现当胃黏膜发生萎缩和肠上皮化生时,SATB1 mRNA 的表达显著升高。而Hedner 等[10]发现原发肿瘤伴肠上皮化生时,SATB1的表达水平较无肠上皮化生时更低。因此,SATB1在肠上皮化生中的作用仍有争议,尤其是其参与胃黏膜肠上皮化生的机制仍需补充研究。值得注意的是,Nakayama 等[11]在利用反转录病毒载体转染尾型同源盒蛋白(caudal homeobox protein,CDX)缺陷型胃癌细胞促进CDX 表达时发现,SATB1的表达水平也随之上升。鉴于CDX-2异常表达被认为与胃黏膜肠上皮化生密切相关,这提示SATB1 可能以中间因子形式参与胃黏膜肠上皮化生分子机制,进而导致胃癌发生。此外,Zuk等[9]对消化不良患者的胃黏膜进行研究时发现,当患者有胃癌家族史背景时,HP 感染与胃体标本中SATB1 mRNA 表达水平升高存在明确相关性。提示SATB1在HP诱导胃癌发生的机制中可能饰演了相关角色(图1)。
1.2 SATB1 与胃癌发生的分子机制 2013年Tracz等[12]发现,当有胃癌家族史的消化不良患者感染HP且出现胃黏膜可逆的组织病理变化时,SATB1 和c-Myc 表达水平显著升高。但无论患者是否有胃癌家族史,HP 清除前后的c-myc基因表达并无明显变化。目前已知当染色体易位、基因重排或扩增引起DNA损伤时,c-myc基因被激活,其编码的蛋白过表达可引起肿瘤形成[13],因此进一步研究SATB1与c-Myc的关系有利于深入了解胃癌发生的分子机制(图1)。
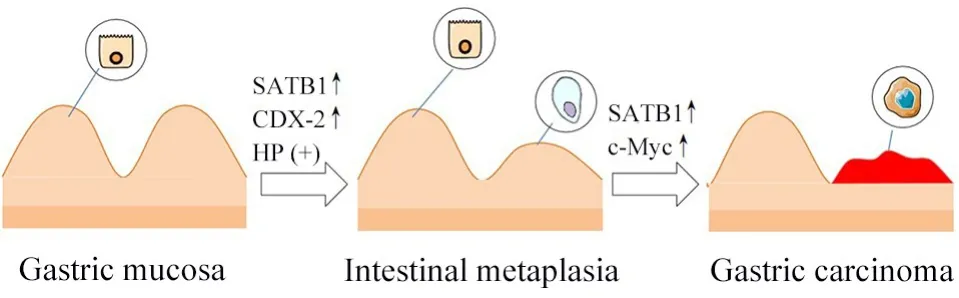
Figure 1. SATB1 is up-regulated in different stages of gastric carcinogenesis.图1 SATB1在胃癌发生的不同阶段表达上调
2 SATB1与胃癌进展
胃癌的疾病进展方式主要有直接浸润、淋巴转移、血行转移和腹膜种植性转移,上述转移方式都与胃癌细胞的侵袭与增殖能力密切相关,现有研究证实SATB1 能够增强胃癌细胞的侵袭能力,提高胃癌细胞的增殖活性。
2.1 SATB1 异常表达与胃癌进展 大量研究发现SATB1 在胃癌组织和细胞中的表达存在异常升高现象,而且SATB1 在不同细胞株中的表达情况也有所差别。成超等[14]发现胃癌组织中SATB1 mRNA 的表达显著上调,且与其蛋白表达水平具有较好的一致性;罗林艳等[15]观察到SATB1 蛋白及mRNA 在胃癌组织中的表达水平高于癌旁组织,而且SATB1 在胃癌组织中表达上调与肿瘤大小、浸润深度、TNM 分期及分化程度密切相关;刘科[16]的研究还进一步发现SATB1在高侵袭性的AGS 胃癌细胞中表达水平高于低侵袭性的SGC-7901 细胞;而张丽娜[17]还观察到SATB1在MGC-803细胞中的表达增高可促进胃癌细胞增殖,促进细胞迁移。
此外,有多项研究结果表明SATB1 可能与其他相关因子共同参与胃癌的疾病进展。Cheng 等[18]发现SATB1 与乙酰肝素酶的表达与肿瘤浸润深度、淋巴结转移及远处转移相关。SATB1 和乙酰肝素酶同为阴性患者的5年生存率高于二者同为阳性的患者,SATB1 可能与乙酰肝素酶共同促进胃癌的侵袭转移(图2)。杨飞等[19]发现缺氧诱导因子1α 与SATB1 在胃癌组织中的表达与浸润深度、淋巴结转移相关(图2B)。胃癌组织中SATB1 的表达水平还与HER2 有关,Yuan 等[20]对60 例胃癌样本检测后发现SATB1 与HER2 表达呈正相关,二者皆与远处转移相关(图2A)。
众所周知,淋巴结转移是胃癌的一种重要转移方式,研究发现环加氧酶2(cyclooxygenase-2,COX-2)和核因子κB(nuclear factor-κB,NF-κB)在胃癌组织中的异常表达与淋巴结转移有关,且SATB1 与二者呈正相关[21-22]。而Chen 等[23]和Liu 等[24]的研究表明,在胃癌细胞系SGC7901中,COX-2、NF-κB和上皮钙黏素(E-cadherin)之间存在调节关系,抑制COX-2或干扰NF-κB 的表达可使E-cadherin 表达上调,且COX-2 是NF-κB 的上游信号,这提示SATB1 可能与COX-2 和NF-κB 共同调节E-cadherin 的表达,通过调控上皮-间充质转化(epithelial-mesenchymal transition,EMT)影响胃癌细胞的淋巴结转移(图2B)。
综上所述,SATB1 可增强胃癌细胞的增殖与侵袭能力促进胃癌的疾病进展,而且SATB1 与多种肿瘤相关蛋白表达正相关,可能与这些肿瘤相关因子联动促进胃癌侵袭转移。
2.2 SATB1 与胃癌进展的分子机制 目前SATB1与胃癌进展的分子机制研究主要集中于EMT和胃癌细胞凋亡。

Figure 2. SATB1 cooperated with heparanase,HER2,HIF-1α,COX-2 and NF-κB to promote the progression of gastric cancer. A:hematogenous metastasis;B:lymphatic metastasis.图2 SATB1协同乙酰肝素酶、HER2、HIF-1α、COX-2和NF-κB促进胃癌进展
EMT 是胃癌进展中的重要环节,可由PI3K/Akt信号通路介导,在此过程中上皮细胞黏附连接丢失,其关键蛋白E-cadherin 转化为间充质细胞标志物Ncadherin[25]。路春阳等[26]的研究表明,胃癌细胞中SATB1 和N-cadherin 的mRNA 和蛋白表达水平均上调,N-cadherin 在胃癌细胞AGS中表达水平随SATB1的上调而增加。现有研究提示长链非编码RNA(long noncoding RNA,lncRNA)UCA1(urothelial carcinoma-associated 1)与Akt 可能是SATB1 影响EMT的关键中介因子。
Sun等[27]发现,SATB1在胃癌组织中通过与miR-495-3p 和lncRNA-UCA1 协同作用,共同促进胃癌的侵袭转移,由此可推测SATB1 参与胃癌侵袭转移的分子机制可能与EMT 相关(图3)。此外,2019年张丽娜等[17]发现,在MGC-803 细胞中沉默SATB1或使SATB1 过表达,胃癌细胞增殖活性及Akt 和p-Akt 蛋白水平均出现相应的降低或升高。而Akt 是一种丝氨酸/苏氨酸蛋白激酶,作为PI3K 的下游分子参与该信号通路,可通过上调核转录因子等诱导EMT[28]。这提示SATB1 或可介导PI3K/Akt 通路通过EMT 促进胃癌的侵袭转移(图3)。除此外,SATB1还接受其他细胞因子调控进而影响胃癌进展,Han 等[29]在研究miR-1224 时发现,miR-1224 可能通过调控SATB1表达影响胃癌细胞侵袭转移能力,而且Wnt/βcatenin通路可能为其调控的下游机制。
细胞凋亡异常也是胃癌进展的重要分子机制基础,刘科等[16]的研究发现当沉默SATB1的表达后,AGS 胃癌细胞增殖活性减弱,出现G0/G1期阻滞,凋亡比例增加,细胞侵袭能力下降。这说明SATB1 可能作用于细胞的G0/G1期,抑制其表达可促进胃癌细胞凋亡,进而影响胃癌细胞的侵袭转移能力。

Figure 3. The pathways of SATB1 affecting epithelial-mesenchymal transition.图3 SATB1影响上皮-间充质转化的通路
3 SATB1与胃癌的诊断和治疗
3.1 SATB1 与胃癌的诊断 胃癌当前的主要诊断方法包括电子胃镜、X 线钡餐及CT 检查,相比之下,体液诊断更为简便。袁春銮等[30]的研究表明,胃癌组织与外周血中SATB1 mRNA 表达呈正相关,检测胃癌患者外周血中SATB1的表达可能在一定程度上间接反映胃癌组织中SATB1 的表达状况。SATB1 或可作为筛选胃癌高危转移患者的潜在指标。
3.2 SATB1 与胃癌的治疗 胃癌的治疗策略以外科手术为主,但对于不能进行根治手术的患者则有赖于综合治疗。现有研究表明,SATB1 可与多柔比星、CD44 抗体或哌立福新共同用于胃癌治疗,且SATB1与化疗和靶向药抵抗耐药机制有关。2014年Peng 等[31]研究发现与单独传递相比,通过热敏磁性阳离子载药系统共传递多柔比星及SATB1shRNA,在体内和体外均能更强地抑制胃癌细胞的增殖活性。Yang 等[32]的研究表明利用CD44 抗体与SATB1siRNA 共同构建的免疫脂质体能抑制SATB1 的表达,并优先消除CD44+的胃癌起始细胞,其治疗效果优与非靶向脂质体。秦玉萍等[33]的研究表明利用SATB1siRNA 转染凋亡抵抗AGS 细胞能抑制其SATB1 的表达,同时能抑制凋亡抵抗AGS 细胞的增殖活性,而且下调SATB1 能增强哌立福新介导的细胞生长抑制的作用。这说明抑制SATB1表达可阻止胃癌细胞的增殖和侵袭,SATB1 或可成为新的治疗靶点,可能与其他化疗、靶向药物以及免疫抗体一齐发挥协同抗肿瘤作用。
肿瘤细胞的化疗耐药可能导致治疗失败,探究化疗药耐药机制有助于改善胃癌患者的生存。Sun等[34]发现,SATB1 表达水平与胃癌耐药情况呈正相关,其促进多药耐药的机制为抑制长春新碱在胃癌细胞中的蓄积并阻止其诱导胃癌细胞凋亡。此外,SATB1 还与靶向药物肿瘤抵抗耐药机制密切相关。Jenke 等[35]发现,在使用c-Met 抑制剂引发胃癌细胞抵抗耐药时会出现HER3 表达水平的显著升高,但在经SATB1siRNA 预处理后HER3 表达出现补偿性的降低,而且PKC 可能参与了SATB1 导致的HER3代偿性上调。因此推断,干扰SATB1/PKC 相关的信号通路可能有助于防止胃癌细胞在c-Met 抑制剂使用后出现肿瘤耐药,而联合HER3/MET 抑制可作为克服MET抑制剂耐药的胃癌治疗策略[35-36]。
4 SATB1与胃癌的预后
多项对胃癌患者生存情况的研究表明,SATB1阳性表达时患者的远期预后不佳。苗雨莉等[37]指出在胃癌患者中,SATB1 阴性组整体生存情况优于SATB1 阳性组,差异有统计学意义。而刘淮东等[38]发现,SATB1 阳性患者的中位总生存时间较阴性患者更短,且肿瘤转移抑制因子KISS1 与SATB1 的表达呈负相关;袁春銮等[39]发现SATB1 阴性表达患者的中位总生存期长于阳性表达者;Hedner等[10]认为,SATB1 对于行根治性切除术的患者是一个独立的预后标志,并与更短的总生存时间和无复发生存时间有关。此外,meta 分析也证实胃癌患者总生存期较差与SATB1高表达有关[40]。
综上所述,SATB1 阳性表达或高表达患者在中位生存时间、无复发生存时间与总生存时间等各项生存指标上均不佳,提示SATB1 可作为胃癌独立预后因素为临床应用。
5 总结
胃癌作为一种常见消化道恶性肿瘤,肿瘤侵袭转移能力强,容易发生早期转移,临床上常出现门诊患者确诊后其病程已处中晚期,对于这类患者一部分可以施行转化治疗创造手术机会,但仍有不少患者只能行姑息性治疗。近年来分子靶向治疗在恶性肿瘤中的应用为许多患者带来明显生存获益,但目前临床常见的分子靶向治疗药物在胃癌的应用效果上并不理想。因此,无论是研发新的靶向治疗药物,还是改善胃癌化疗药物耐药,都离不开胃癌的分子机制研究。值得注意的是,在通览现有SATB1 与胃癌相关文献后,我们发现SATB1 与胃癌的发生、发展、诊断、治疗以及结局预后密切相关,可能为胃癌发生发展的分子机制研究提供重要线索。
首先,SATB1 可能参与了胃黏膜的肠上皮化生,并在HP 感染与肿瘤家族史诱导的胃癌发生机制中饰演了相关角色;其次,SATB1 被明确认定能够调控胃癌细胞的增殖与侵袭能力,与胃癌的淋巴结转移密切相关。值得注意的是,SATB1 对EMT 的调控和SATB1 抑制胃癌细胞凋亡可能是SATB1 参与胃癌转移分子机制中的重要环节。而SATB1在胃癌转移中的正向调控因子背景可能是其影响患者预后的关键基础,因此SATB1 可被认定为胃癌患者预后的独立危险因素。最后,需要特别指出的是,最新研究提示SATB1 在胃癌的治疗领域具有潜在的应用价值。SATB1 不仅与胃癌的化疗耐药相关,还与c-Met 抑制剂类靶向药物的抵抗耐药机制密切相关。部分研究还发现在化疗、靶向治疗或是免疫治疗的同时,施加沉默SATB1表达的处理措施可以显著提高药物的抗肿瘤效果。综上所述,SATB1 作为一种转录调控蛋白,全程参与了胃癌发生发展过程,尤其在胃癌转移机制中可能扮演了重要角色。
纵览SATB1 与胃癌的相关研究,自2010年起目前已逾十年,研究历程主要分为三个历史阶段。2010年~2013年间,SATB1 胃癌相关研究尚且粗浅,主要还集中在现象研究层面,从SATB1 与临床病理资料关系到SATB1在体外实验中对胃癌细胞株的增殖、凋亡及生物学行为进行相关研究,虽然未能阐明机制,但呈现了SATB1在胃癌研究中的价值;第二个阶段(2014~2017年),部分学者开始对SATB1 与一些信号通路的重要相关因子结合起来研究,试图为SATB1 与胃癌相关的分子机制研究寻找有潜力的研究路径。值得注意的是在这个阶段已有部分学者开始探索SATB1 在胃癌药物治疗中的临床应用价值,但这一阶段系统化的机制研究尚未出现;第三阶段(2018年至今),研究者开始对SATB1 在胃癌的分子机制中作用开始系统性的研究,尤其是在药物治疗领域开始出现一些高水平的研究成果,这也充分证明SATB1在胃癌相关分子机制研究上的临床转化价值。从整体研究现状看,鉴于SATB1 的核转录调控因子身份,目前尚未从核转录调节的方向去厘清SATB1 在胃癌相关分子机制中的作用。未来在这一方向上完成原创性的系统研究可能更具有深远的影响和科学价值,相信相关研究成果将有助于在胃癌药物研发上实现突破性的进展。

