不同氮素形态对湿地小叶章氮吸收和N2O排放的影响
付晓玲,倪红伟,刘赢男,王建波,王继丰
(1黑龙江省科学院自然与生态研究所,哈尔滨 150040;2黑龙江省林业科学院,哈尔滨 150081)
0 引言
氮素(nitrogen,N)是土壤-植物系统不可缺少的矿质元素之一,在植物生长过程中具有不可替代的作用,是植物重要且极难管理的营养元素[1],被称为“生命元素”[2]。氮的有效性直接影响着植物对土壤氮素的吸收和利用,而能被植物根系吸收的有效氮源主要是硝态氮和铵态氮,植物对生长环境中不同形态氮素的吸收存在较大的差异,不同形态氮素对植物各形态指标[3]和N2O排放均有着较为显着的影响。对油茶的研究表明,铵态氮和硝态氮混合处理最有利于油茶各组织器官吸收氮素[4]。枇杷(Eriobotrya japonica Lindl)有明显的喜铵特性,枇杷根系对铵态氮的吸收大于硝态氮[5]。对枳橙(Citrus sinensis)的研究表明,全硝态氮培养好于全铵态氮培养,枳橙属于喜硝态氮植物[6]。夏淑杰等[7]研究发现施加铵态氮有易于N2O的排放,累积排放量是硝态氮的2倍左右。梁东丽等[8]研究也发现施氮后短期内铵态氮排放的N2O量显著高于硝态氮处理。不同形态氮对植物生长和吸收的的影响主要集中于农作物的研究,关于湿地植物对不同形态氮吸收的研究鲜见报道。
三江平原是中国目前湿地类型最全、保持最完好的原始湿地,生物多样性十分丰富,也是具有重要代表性和国际意义的湿地生态系统[9-10]。小叶章(Calamagrostis angustifolia)是三江平原具有典型性和代表性植物[11-12]。鉴于此,本研究以三江平原典型湿地植物—小叶章湿地为研究对象,采用野外原位控制实验,同位素示踪研究铵态氮、硝态氮以及铵硝混合条件下,湿地植物小叶章对氮素吸收以及N2O排放情况,探讨不同形态氮素在植物-土壤-大气系统中的分配策略,对研究全球气候变化趋势和全面真实地评价湿地N2O排放的影响因素具有重要理论和现实意义。
1 研究材料和试验方法
1.1 研究地概况
本实验在黑龙江省科学院自然与生态研究所三江平原湿地生态定位研究站—洪河国家级自然保护区内。洪河国家级自然保护区位于中国东北黑龙江省三江平原的东北部,总面积218.35 km2。研究区为温带季风气候,多年平均降水量为585 mm,主要集中在7—9月份[13]。土壤类型主要有草甸土、白浆土和沼泽土等。以湿生和沼生的禾本科、莎草科植物为优势种,局部地区有岛状森林出现。优势植物有小叶章(C.angustifolia)、漂筏苔草(C.pseudo-curaica)、狭叶甜茅(Glyceria spiculosa)、毛果苔草(Carex lasiocarpa)等。其中优势群落小叶章群落高度达到70~120 cm,盖度达到80%~95%,生物量达到358~450 g/m2。
在实验站内选择建群种和优势种—小叶章为研究对象,盖度达85%以上。主要伴生植物有小白花地榆(Sanguisorba parviflora)、翻白蚊子草(Filipendula intemedia)、泽芹(Sium suave)等。
1.2 实验设计
氮素形态处理通过施用15N标记的NH4Cl(区组一)(A)、15N标记的KNO3(区组二)(N)和双标记的NH4NO3(区组三)(NA)(丰度均为99%,由上海化工研究院生产)来实现,施氮时间为5月末,区组面积5 m×5 m,每个区组施氮量为0 gN/m2(对照)和4 gN/m2(与当地土壤中氮含量接近)、每个区组3个重复,样地四周用PVC板进行防护(如图1)。
N2O排放通量观测采用静态暗箱-气相色谱法。实验前期埋设底座,底座采用不锈钢制成,长×宽×深=50 cm×50 cm×20 cm,底座上端有深2 cm、宽2 cm的凹槽,用于水封防止漏气。底座固定到样地后就不再取下,直到整个实验的结束。
样地设置完毕,施氮之前大约有15天的稳定时间,经过15天的稳定期后,施加标记氮。
1.3 样品采集
(1)植物样品采集与分析。植物取样采用收获法,样方面积50 cm×50 cm,5次重复。采样时间为施加氮素后的第0.5、1、1.5、2、2.5、3、4、5、10、20、30、60、90、120、150天。地下部分取0~15 cm深度的土壤和根全部取出,样品带回实验室,将地下部分用水冲洗干净,只保留植物根。将植物地上、地下部分置于80℃烘箱中烘干称重后磨碎(<0.85 mm)装袋。植物地上、地下部分15N含量用元素分析仪(Thermo Flash EA1112,美国)-稳定性同位素质谱联用仪(GV IsoPrime JB312,英国)测定。
(2)N2O气体收集。N2O气体收集利用静态箱。在不同处理区域安置50 cm×50 cm底座,用尺寸为50 cm×50 cm×50 cm的顶箱和延长箱结合的采样箱系统进行气体采样,采样时间为每天10:00—14:00时,采样的频率为施加氮素后的第0.5、1、1.5、2、2.5、3、4、5、10、20、30、60、90、120、150天。N2O中15N含量用气体同位素质谱仪(BT-981S)测定。
1.4 测定指标和方法
1.4.115N吸收量的计算 将施氮处理过的样品采集后,将植株分成叶、茎、根3份,样品送至中国农业大学测定。15N的吸收量参照孙世君等[14]方法计算见式(1)。
Ndff指植株器官从外源氮中吸收分配到的15N量对该器官全氮量的贡献率,反映了植株器官对外源15N的吸收征调能力。其中0.3663%为自然丰度。
器官15N吸收量(mg/g,DW)=全氮含量(mg/g,DW)×Ndff(%)
1.4.2 N2O通量的计算 N2O排放通量的定义为单位时间、单位面积观测箱内排放的被测气体质量的变化。将样品采集后待测定。
可用公式(2)表示。
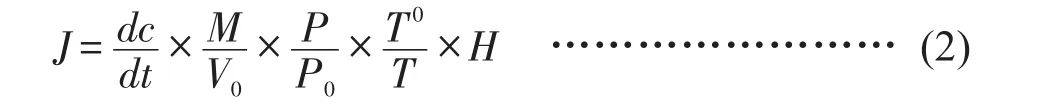
式中:J-气体通量[mg/(m2·h)];
-采样时气体浓度随时间变化的直线斜率;
M-被测气体的摩尔质量;
P-采样点的气压;
T-采样时绝对温度;
V0、P0、T0-分别为标准状况下气体摩尔体积、空气气压和绝对温度;
H-水面以上采样箱高度。
J为正值时表示释放,负值表示吸收。15N2O[mg/(m2·h)]=0.01
1.5 稳定同位素比率测定及数据分析
用Elementar Isoprime 100同位素质谱仪(中国农业大学,中国)测定δ15N。数据采用Sigmaplot 10.0和Microsoft Excel 2010做图,数据分析采用SPSS19.0 for Windows软件进行分析处理。小叶章叶、茎、根中Ndff和对15N吸收量以及N2O中的δ15N值数据均采用方差分析(ANOVA),检验不同处理间小叶章各器官吸收15N的显著性,采用最小显著差数(LSD)法进行各处理间双重比较。
2 结果与分析
2.1 不同氮素形态处理对小叶章茎、叶、地下生物量及根冠比的影响
表1为小叶章最大生物量月份(7月)的生物量数值。由此表可知,不同氮素形态对小叶章生长指标具有显著差异。叶生物量依次为处理A>NA>N>CK;A处理的叶生物量显著高于N和NA。A处理茎生物量最大,比对照(CK)提高了35.68%。NA处理地下生物量显著高于A和CK,与地下生物量相同,NA处理根冠比最大,是对照的1.82倍,A和N处理较对照分别提高了18.32%和46.53%。

表1 不同形态氮处理下小叶章茎、叶以及地下生物量
2.2 不同氮素形态处理对小叶章叶、茎、地上以及根氮含量的影响
由图2可知,不同形态处理小叶章叶氮含量最高,茎最低,除了混合氮处理外,地上和根相差不大,说明施氮后,大部分氮都被植物叶和根吸收,用于植物的生长发育。经T检验,不同处理氮含量显著高于对照(P<0.05),不同处理之间氮含量差异不显著(P<0.05)。因此说明,不同形态氮处理之间对小叶章器官中氮含量影响很小。

图2 不同氮素形态处理对小叶章叶、茎、地上以及根氮含量的影响
2.3 不同氮素形态处理对小叶章叶、茎、地上以及根Ndff的影响
由图3看出,不同氮素形态处理下小叶章叶、茎以及地上Ndff随取样时间的变化趋势均呈现抛物线型。经方差分析,小叶章叶、茎以及地上Ndff均表现为处理A>N>NA>CK,并且各处理极显著高于对照(CK)(P<0.01),进一步经过T检验得知,各处理之间达到显著差异(P<0.05),因此说明,单一氮源有利于植物地上器官对外源N的吸收,且地上器官对单一铵态氮处理吸收能力最大(P<0.05)。
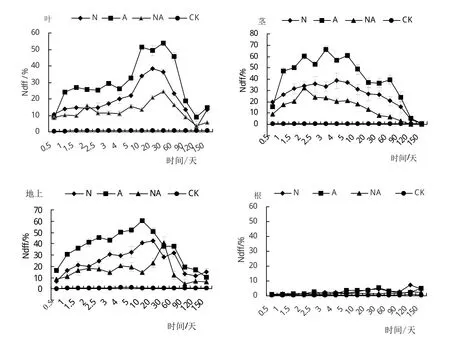
图3 不同氮素形态处理对小叶章叶、茎、地上以及根Ndff的影响
不同氮素形态处理对小叶章根Ndff影响随取样时间延长波动很小,几乎与对照持平(图3)。经T检验分析,N和A处理间,根Ndff随取样时间延长差异不显著(P>0.05),但N和NA、A和NA处理间,根Ndff随取样时间延长达到极显著差异(P<0.01),各处理均极显著高于对照(P<0.01),说明混合氮源和单一氮源均有利于根对外源氮的吸收,且根对单一氮源的吸收能力显著高于混合氮源,对单一的铵态氮和硝态氮吸收能力相差不大(P>0.05)。
2.4 不同氮素形态处理对小叶章叶、茎、地上以及根15N含量的影响
由图4看出,不同氮素形态处理下小叶章叶、茎以及地上15N含量随取样时间呈现先升高后降低的变化趋势,而根中15N含量随取样时间波动很小,且叶中15N含量最多,茎次之,根中含量最少。经方差分析,小叶章叶、茎、地上以及根15N含量均表现为处理A>N>NA>CK,并且各处理极显著高于对照(CK)(P<0.01),处理之间达到显著差异(P<0.01)。经T检验分析,处理N和处理A之间差异不显著(P>0.05),其他处理之间达到显著差异(P<0.01)。因此说明,植物体吸收的氮大部分被叶吸收进行光合作用促进生长发育,植物各器官主要吸收外源氮中的单一氮源(硝态和铵态),且吸收的铵态氮高于硝态氮,但差异不明显(P>0.05)。
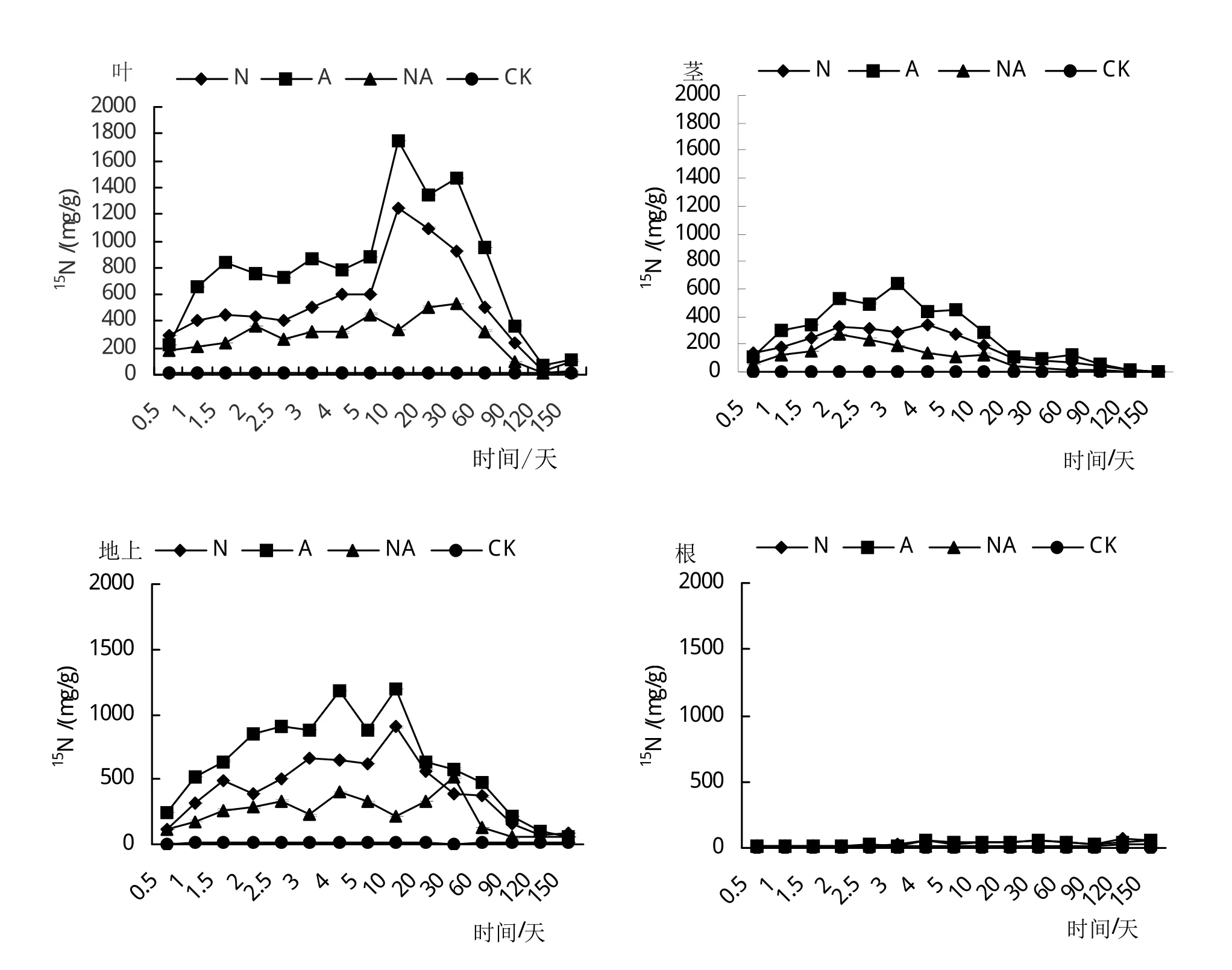
图4 不同氮素形态处理对小叶章叶、茎、地上以及根15N含量的影响
2.5 不同氮素形态处理对湿地N2O排放的影响
由图5可以看出,处理N湿地N2O排放量最多,处理A和处理NA相差不大。经方差分析,处理N、处理A和处理NA显著高于对照(CK)(P<0.05)。经T检验分析,处理N显著高于处理A和处理NA(P<0.05),处理A和处理NA之间差异不显著(P>0.05)。因此说明,施加外源氮能促进湿地N2O排放量,且施加硝态氮使湿地N2O排放量最多。另外上文得出结论:植物主要吸收外源氮中的铵态氮,意味着硝态氮大部分储存在土壤中,经过土壤微生物作用,排放到大气中,也进一步证明了硝态氮促进了N2O排放。
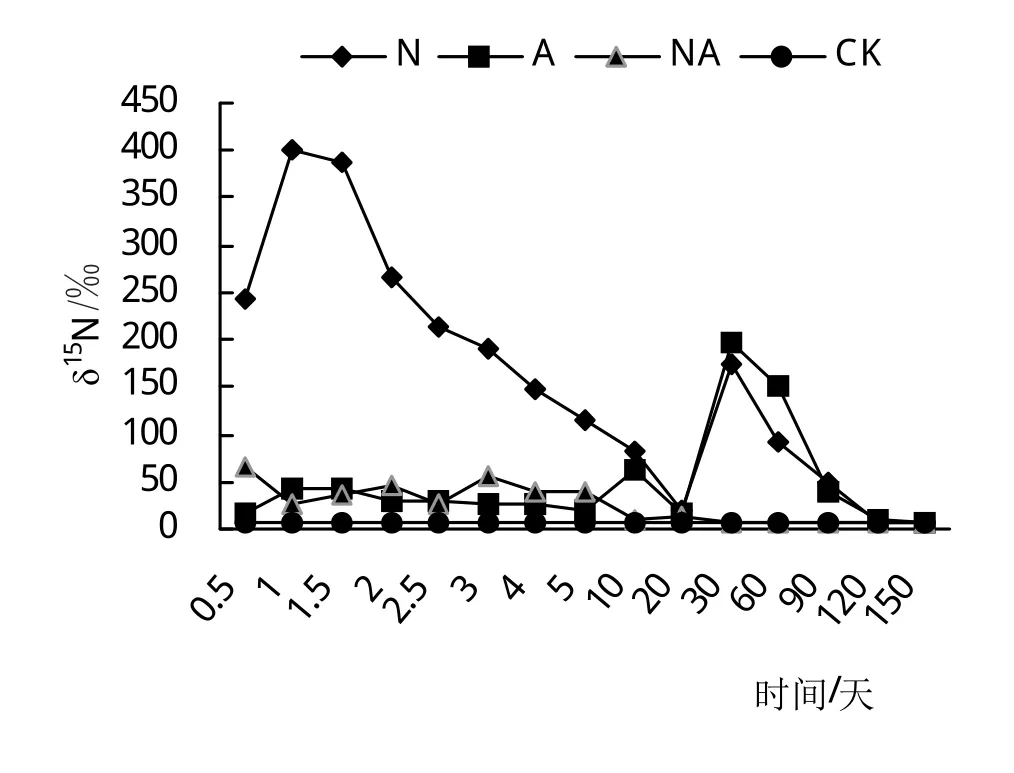
图5 不同氮素形态处理对湿地N2O排放的影响
3 讨论
氮素是植物体内不可缺少的元素。氮素的种类和配比对植物的产量和品质有着重要的影响,施用不同形态的氮素可显著(P<0.05)影响植株的生长发育及其对养分的吸收和利用[15]。研究表明,当土壤中含有混合氮源(NH+4-N和NO-3-N)时,大部分旱地作物生长状况和干物质积累比单一氮源更好[16]。外源氮素的形态会影响植株全氮的积累转运,从而使植物对于外源氮素的吸收发生改变。而本研究表明不同氮素形态对小叶章生长指标具有显著差异。铵态氮处理下,小叶章叶和茎的生物量最大,混合氮源处理下,小叶章地下生物量最大,且混合态氮根冠比最大。不同形态氮处理小叶章叶吸收氮最多,其次是根。
氮是陆地生态系统植物光合作用和初级生产过程中最受限制的元素之一[17],有机氮是土壤氮库的主体(占95%以上),植物可吸收利用的氮主要来源于土壤有机氮的矿化[18],土壤有机氮矿化对于植物的生长过程极为重要,其矿化速率的高低直接影响土壤的供氮能力。无机氮主要以NH+4-N和NO-3-N存在,可为植物直接利用。湿地土壤无机氮的含量通常维持在很低的水平上,因而常常是土壤中最主要的限制性养分,其含量高低直接影响着湿地生态系统的生产力[19]。本研究利用同位素示踪技术发现不同形态氮素对小叶章地上、地下部分氮吸收都有一定程度的促进作用,且小叶章不同器官对铵态氮的吸收量最大,这与李树斌等[20]研究一致。氮素形态很大程度上影响了植物根系对硝态氮和铵态氮的吸收特性,在相同施氮量下,植物根系吸收的硝态氮远大于铵态氮,大部分铵态氮都被土壤吸附着,且施氮量越多土壤吸附的铵态氮越多。但土壤吸附的示踪氮很少,一般占总示踪氮1%~2%,其中吸附的大部分为示踪铵态氮。研究发现土壤中的示踪氮随生长季节无明显变化。
湿地生态系统N2O排放主要取决于土壤中硝化与反硝化过程。而该过程受土壤温湿度、土壤中NH4+-N、NO3--N以及土壤微生物强烈的影响[21-24]。因此,土壤中NH4+-N和NO3--N的供应状况与N2O排放密切相关[25],Bremner等[26]研究发现土壤中施入(NH4)2SO4和尿素后,土壤中的硝化细菌通过硝化作用产生了N2O,且(NH4)2SO4和尿素在土壤中的硝化作用远大于施KNO3的土壤。Cartaxana等[27]对欧洲塔霍河盐沼沉积物N2O排放的研究则发现,添加NO-3可增加沉积物的N2和N2O浓度。Muñoz-Hincapié等对波多黎各红树林(Rhizophora mangle)沉积物的研究也发现,随着NH4+-N和NO3--N含量的增加,N2O排放通量逐渐增加。本研究发现:湿地沼泽化草甸为弱的N2O排放源,硝态氮处理N2O排放量最多,此结论与夏淑洁等[7]对经济作物棉花所做研究得出的结论一致,均取决于硝化与反硝化过程,并可能受到时间、土壤温湿度以及土壤营养成分含量的影响[28]。本研究还得出铵态氮和混合态氮处理对湿地N2O排放量差异不明显。
自然湿地空间变化差别也较大,由于自然湿地类型多样,广泛分布于世界各地,其N2O排放常因所研究的地域和环境条件的差异而不同。如不同纬度地区湿地N2O排放通量呈:北部天然湿地<温带天然湿地<热带天然湿地[29];福建九龙江河口海岸红树林湿地不同地点N2O排放通量的空间差异明显[30]。有研究表明,同地区不同类型天然湿地N2O排放通量不尽相同[31]。而且N2O排放随季节变化不同[32-35]。因此,从氮素形态的时空分布格局角度亟待深入研究。

