石墨炉原子吸收分光光度法测定米粉中铝的含量
郝文莉 朱桂丹 南 峰 李 静
(1.昌吉学院化学与化工学院 新疆 昌吉 831100;2.中国人民解放军32319部队 新疆 疏勒 844200;3.昌吉学院人事处 新疆 昌吉 831100)
铝是是地壳中含量最丰富的金属元素。单质铝无毒,不会对环境和生物体造成伤害。铝以其良好的延展性、导热性、高反射性和耐氧化性而被广泛使用在食品包装、电线电缆工业、反射镜和天然气管道制造工业中。然而饮食中铝含量过高会引起骨质软化、骨营养不良。因为人体血液中的铝含量过高,会降低人体对磷的吸收,从而使骨钙含量降低,引起骨软化、骨折。同时,铝也是一种神经毒素,铝离子可穿透血脑屏障,铝离子进入大脑后,会导致渗析性脑病,有研究发现阿尔茨海默、关岛神经紊乱、帕金森综合症等都与铝在体内的蓄积有关。[1-2]铝在人体内引起的毒性是长期而缓慢的,不易被察觉,一旦发生毒性反应,后果是严重的、不可逆转的,因此人们应高度重视铝的摄入量。
米粉是人们常吃的食物之一,粉丝在加工过程中,需要添加0.5%的明矾(KAl(SO4)2·12H2O)来增加粉丝的韧性,因此长期的食用铝含量高的粉丝,会使铝在人体内蓄积,影响人体健康,因此使用简便的方法准确地测定米粉中铝的含量具有重要意义。
1 实验方法
1.1 标准曲线的绘制
于7只50mL容量瓶中,分别准确加入0µL、1.00µL、2.00µL、4.00µL、8.00µL、16.00µL、32.00µL铝标准使用液,用1%的硝酸定容至刻度。以试剂空白为参比溶液,在309.28nm最大吸收波长下测定溶液吸光度。
1.2 铝含量的测定
样品预处理:将米粉剪成不超过0.3cm的碎片后放在称量器皿中在85℃烘箱中干燥2h,冷却后取出。
用分析天平准确称取2.00g粉丝置于瓷坩埚中,加入0.5 mL水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL 1%的硝酸溶液溶解灰分,再转移至100mL容量瓶中,用1%的稀硝酸定容至刻度[3-5]。吸取5.00mL米粉样品溶液于50mL容量瓶中,用1%的硝酸定容至刻度,在波长309.28nm下测定溶液吸光度,最后根据标准曲线求出对应浓度。
1.3 铝含量的计算公式
A=0.00961+0.01618X
A:测定的吸光度值
X:米粉样品溶液的浓度。

M:样品中铝含量mg/kg。
C:仪器测的样品含量,由曲线方程得ug/L。
2 结果与讨论
2.1 最佳条件实验
2.1.1 基体改进剂种类
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入0.5 mL水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL 1%的硝酸溶液溶解灰分[3],转移至100mL容量瓶中,用1%的硝酸定容至刻度,将铝样稀释10倍,用配置好的1%的基体改进剂将铝样配制成相同浓度的溶液测定,选出最佳基体改进剂,实验结果见表1。
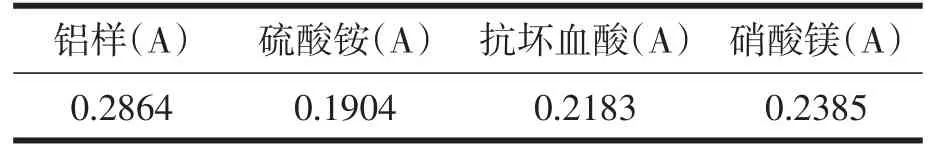
表1 基体改进剂的种类与吸光值
许多文献报道,在测定不同物质中的铝含量时,加入 MgNO3、(NH4)2S04、抗坏血酸等物质作为基体改进剂。在本文中,我们也尝试了添加不同浓度的上述三种物质。结果表明,虽然灵敏度有所提高,但测定结果并不稳定。吸光度值波动较大,石墨管消耗也很大。改变为不添加任何基体修饰剂后,测量值和背景吸收值相对稳定。石墨管的使用寿命亦相对延长,灵敏度亦达到了测定要求[6]。故本实验不采用基体改进剂。
2.1.2 升温程序的选择
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入0.5 mL水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL 1%的硝酸溶液溶解灰分[3],转移至100mL容量瓶中,用1%的硝酸定容至刻度,用1%的硝酸将铝样稀释10倍,定容至刻度。测相应吸光度值,实验结果见图1、图2、图3。

图1 原子化温度与吸光度

图2 原子化时间与吸光度

图3 灰化温度与吸光度
由图1可知,温度越低原子化越不完全,随着温度的升高,原子化程度加大,当温度过高时,易被离子化,故本实验选择的最佳原子化温度为2600℃。
由图2可知,原子化时间为2s时,其测得的吸光值最佳,故本实验选择的最佳原子化时间为2s。
由图3可知,灰化温度800℃时效果最佳,故本实验选择的最佳灰化温度为800℃。
2.1.3 熔样时间的选择
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入少许蒸馏水,将其放置于电炉炭化至不再冒烟,再将其放入马弗炉(540℃)中灰化,最后将灰化后的样品溶解,用1%的硝酸定容。利用米粉样品溶解时间的不同测定相应的吸光度,来选取溶样的时间,实验结果见图4。

图4 熔样时间的影响
由图4可得,熔样时间为4h时其吸光值最佳,故本实验在熔样时间为4h完成测定。
2.1.4 熔样方法的选择
2.1.4.1 干法熔样
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入少量水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL1%的硝酸溶液溶解灰分,转移至100mL容量瓶中,用1%的硝酸定容至刻度。再吸取5mL至50mL容量瓶中,用1%的硝酸定容至刻度,测其吸光在标准曲线上找出相对应的浓度,计算出铝的含量为5.8270mg/kg。
2.1.4.2 湿法熔样
准确称取预处理后的米粉样品2.0g置于凯氏定氮瓶中,并加入2mL浓硝酸,再取一支凯氏定氮瓶,仅加入2mL浓硝酸,将两只凯氏定氮瓶置于电炉上加热数分钟,直至米粉样品溶解,冷却后将其移至100mL容量瓶中,用1%的硝酸定容至刻度,再吸取5mL至50mL容量瓶中,用1%的硝酸定容至刻度,测其吸光度,在标准曲线上找出相对应的浓度,计算出铝的含量为3.8439mg/kg。
由实验结果表明,干法熔样比湿法熔样的浓度高,测得的铝含量较高。
2.1.5 酸度的影响
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入少量水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL1%的硝酸溶液溶解灰分,转移至100mL容量瓶中,用1%的硝酸定容至刻度,分别用0.1%、0.5%、1.0%、1.5%、2.0%、2.5%的硝酸将铝样稀释10倍,定容至刻度。通过测定其不同的吸光值来选定最佳酸度,实验结果见图5。
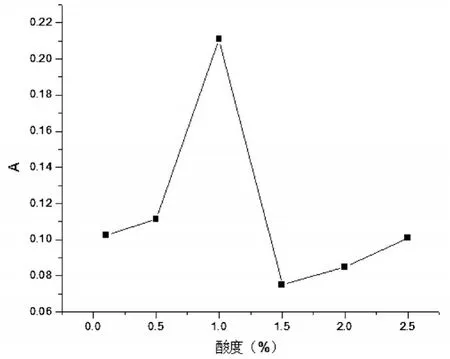
图5 酸度对吸光度的影响
由图5可得,当用1%的硝酸时,吸光度最大,并且石墨炉的上样酸度不能超过3%,故本实验选用1%的硝酸为宜。
2.2 样品分析
2.2.1 标准曲线的绘制
准确配制0µg/L、1.00µg/L、2.00µg/L、4.00µg/L、8.00µg/L、16.00µg/L、32.00µg/L铝标准溶液,以试剂空白为参比溶液,在309.28nm最大吸收波长下测定溶液吸光度。实验结果见图6。得回归方程:Y=0.00961+0.01618X,r=0.99912

图6 铝的标准曲线
2.2.2 米粉样品中铝含量的测定及精密度考察
准确称取预处理后的米粉样品2.0g置于瓷坩埚中,加入少量水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL1%的硝酸溶液溶解灰分,转移至100mL容量瓶中,用1%的硝酸定容至刻度,用1%的硝酸将铝样稀释10倍,定容至刻度。测相应吸光度值,平行测定7组,从标准曲线上查得相应的浓度,从而求出铝的含量,计算得:标准偏差为1.0152µg/L,相对标准偏差为6.808µg/L。
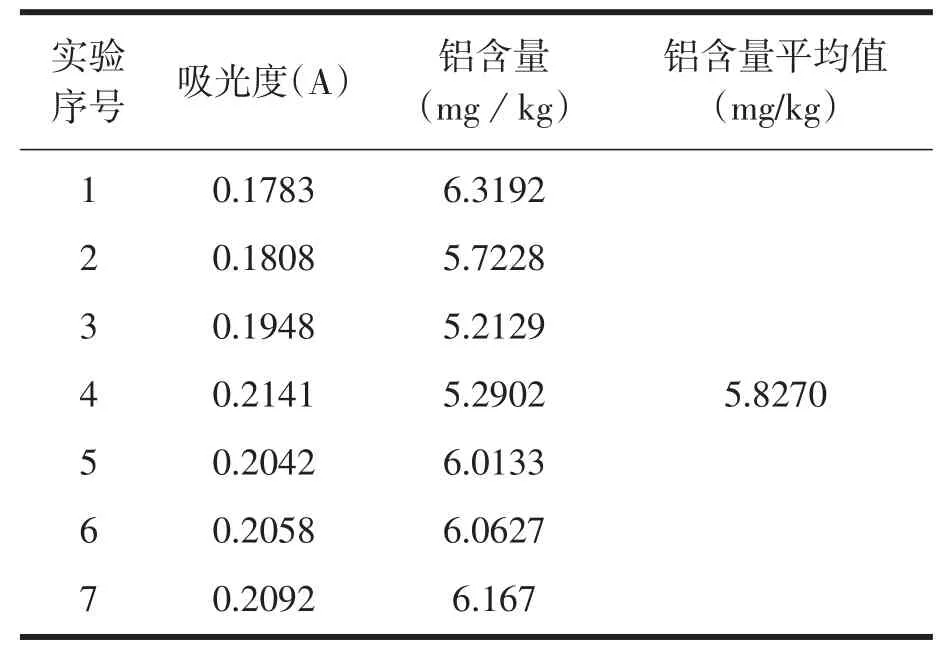
表2 米粉样品中铝含量的吸光值及浓度
2.2.3 加标回收实验
准确称取预处理后的米粉样品2.0g于瓷坩埚中,加入少量水浸润后于万用电热器上慢慢炭化至不再冒烟,再于540℃马弗炉中灰化4h,冷却取出后用10mL1%的硝酸溶液溶解灰分,取1000µg/mL 的铝标准溶液8mL、16mL、32mL,各置于6个100mL容量瓶中(共18个),并将灰分用1%的硝酸溶解至容量瓶中,定容至刻度,在309.28nm波长下测其吸光度,对照工作曲线,查得浓度,如表3、表4、表5。
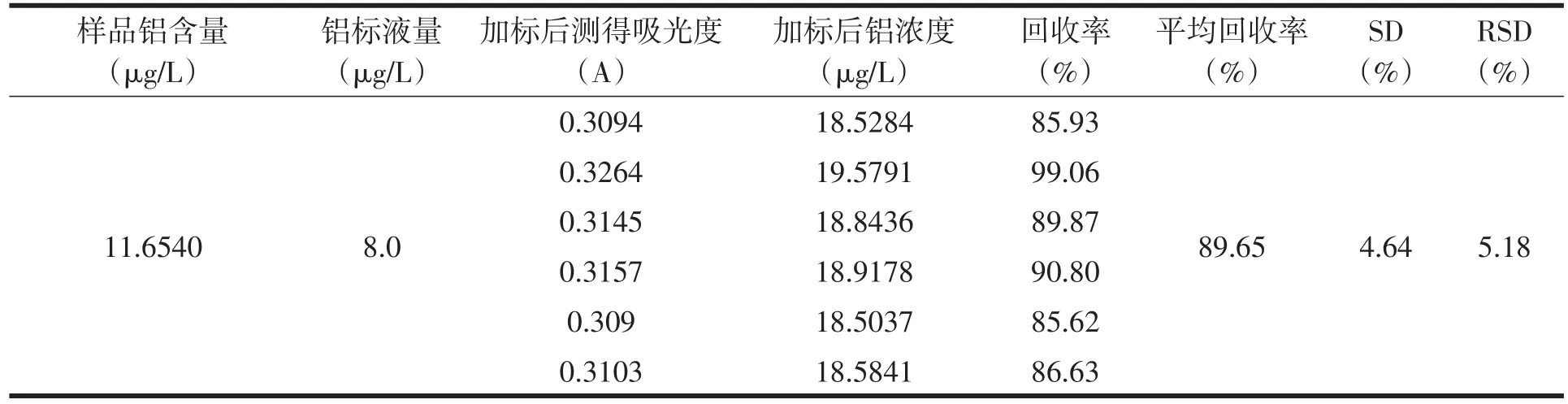
表3 加标回收实验的测定(小于50%)
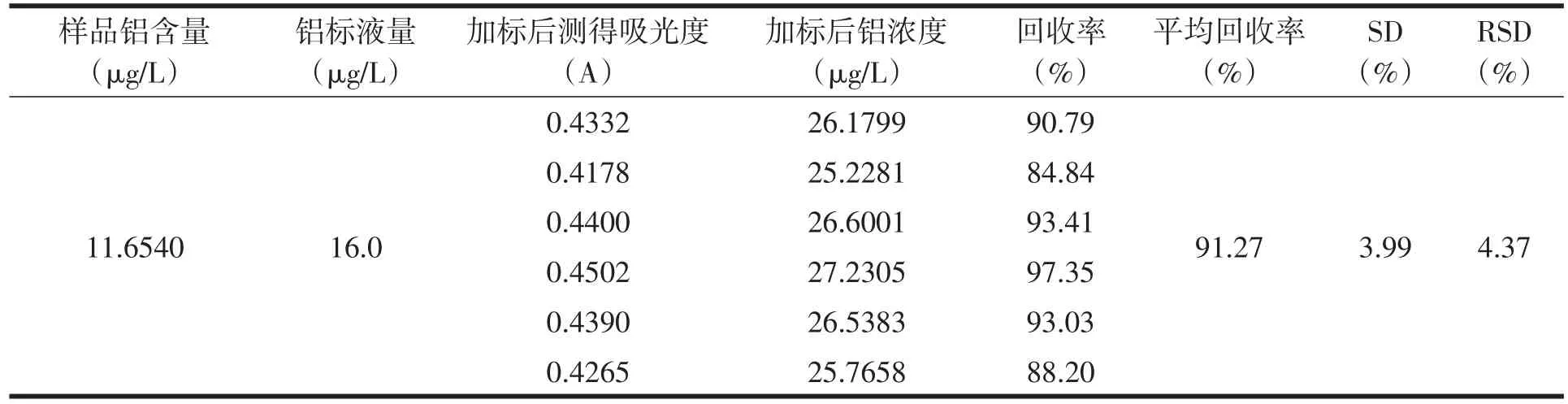
表4 加标回收实验的测定(等于50%)

表5 加标回收实验的测定(大于50%)
由表可得,铝的平均回收率在89.65%—92.03%范围内。
2.2.4 方法检出限的测定
在最佳条件下对用空白溶液和铝标准溶液进行重复测定20次,按3倍标准偏差除以标准曲线的斜率[7],得出方法的检出限为1.9839µg/L。

表6 空白样的浓度

注:原子化温度2600℃、原子化时间2s、灰化温度800℃、熔样时间4h、酸度1%。
2.2.5 市售米粉中铝含量的测定
分别各取7份散称米粉、龙口粉丝、古松粉丝样品经123步骤处理后,以1%的硝酸溶液为参比,在309.28 nm波长下,对米粉中的铝含量分别进行测定,结果分别见于表7、表8。
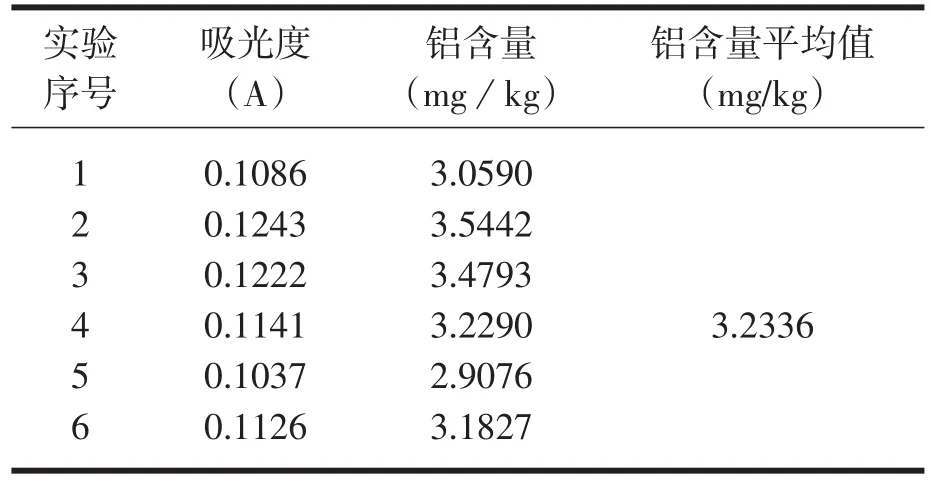
表7 龙口粉丝中铝含量的测定

表8 古松粉丝中铝含量的测定
由表可得,散称米粉、龙口粉丝、古松粉丝中铝含量均较高,其中散称中铝含量最高,其次是龙口粉丝、古松米粉中铝含量相对较少。
3 结论
本文采用石墨炉原子吸收分光光度法测定米粉中铝的含量,先将米粉样品炭化,再用马弗炉灰化,用1%的硝酸定容后,在309.28nm波长下测定吸光度,并以加标回收实验验证,结果表明:米粉中铝含量为5.827mg/kg,未超过国家标准(100mg/kg)。[8]
当原子化温度为2600℃、灰化温度为800℃、原子化时间为2s、酸度为1%、融样时间为4h时,米粉中铝的回收率最高为92.03%,其中温度和酸度对测定米粉中的铝含量影响较大,原子化时间、融样时间对测定米粉中铝含量也有一定程度的影响,通过本文对米粉中痕量铝含量的研究,使人们对食品安全又有了进一步的了解。
本法操作简单、回收率较高、实验结果灵敏度高、选择性好、快速、应用范围广等优点,因而建立了米粉中痕量铝的简便测定方法。

