利拉鲁肽联合甘精胰岛素与基础餐时强化治疗对新诊断2型糖尿病的临床分析
庄具东,韩业群
枣庄市峄城区人民医院内分泌科,山东枣庄 277300
近年来,随着我国生活质量不断完善,加之人们饮食结构的改变,使我国成人2型糖尿病(T2DM)发病率呈逐年上升趋势[1]。相关数据统计,我国T2DM发病率可达到12.8%,其中新诊断T2DM患者有6.8%[2]。而新诊断T2DM患者,若糖化血红蛋白(HbA1c)>9.0%或空腹血糖(FPG)>11.1mm01/L,且存在明显高血糖症状,需开展胰岛素(INS)强化治疗[3]。而利拉鲁肽则能够有效弥补上述治疗方案的局限性,其属于一类胰高血糖素样肽-1(GLP-1)类似物,也是一类新型降糖药物,可促进葡萄糖依赖性INS分泌,控制INS高血糖素分泌,减少INSβ细胞凋亡,促进其增殖,进而能够延缓胃排空,控制高血糖素分泌,达到降低餐后血糖目的[4]。而甘精INS主要抑制空腹血糖,二者联合应用可起到协同作用,有助于稳定新诊断T2DM患者胰岛β细胞功能,促使血糖长期维持稳定状态[5]。鉴于此,该文选取2020年6月—2021年4月期间40例新诊断T2DM患者实施利拉鲁肽+甘精INS治疗进行分析,现报道如下。
1 资料与方法
1.1 一般资料
将80例新诊断T2DM患者作为该次研究对象,按随机数表法将其分为研究组、对照组,各40例。研究组男19例,女21例;年龄35~79岁,平均(59.11±4.50)岁;体质指数(BMI)25~37 kg/m2,平均(29.41±2.26)kg/m2。对照组男20例,女20例;年龄36~78岁,平 均(59.15±4.62)岁;BMI 24~37 kg/m2,平 均(29.41±2.41)kg/m2。两组一般资料差异无统计学意义(P>0.05),具有可比性。经医院伦理委员会批准该次研究。
纳入标准[6]:①患者临床资料完整;②尚未实施降糖药物的新诊断T2DM(诊断时间<1个月),HbA1c>9.0%或FPG>11.1mm01/L;③患者及家属均知情该次研究,且签署知情同意书。
排除标准[7]:①伴有动脉粥硬化性心血管疾病者;②使用降脂药者;③丙氨酸氨基转移酶或天冬氨酸氨基转移酶大于正常上限3倍;④预估肾小球滤过率<60 mL/(min·1.73 m2);⑤既往伴有急性INS炎或甲状腺髓样癌者;⑥孕妇或哺乳期者;⑦无法顺利完成研究,中途退出者。
1.2 方法
两组患者入院第2天睡前均开始注射甘精INS(国药准字J20120031,规格:3 mg),起始剂量为0.15μ/kg,若FPG未达标,则每日睡前甘精INS增加2 U,2 hPG控制目标为5.0~8.0 mmol/L。研究组入院第3天开始注射利拉鲁肽(国药准字J20110026,规格∶3 mg),剂量为0.6 mg,若任意2 hPG在入院第5天仍未达到最佳控制效果,则入院第6天利拉鲁肽量上升至1.2 mg,若任意2 hPG在入院第8天仍未达标,则入院第9天利拉鲁肽剂量上升至1.8 mg,若出现胃肠道不耐受,需退回原始剂量,3 d后再尝试增加。对照组入院第3天,三餐前开始注射门冬INS(国药准字S20100049,规格:3 mg),起始量为0.3μ/(kg·d),三餐依据1∶1∶1进行分配,若患者餐后血糖尚未达标,需隔日将相应餐前门冬INS增加2 U直至血糖达标。两组患者在血糖达标后,持续维持原有治疗措施,坚持4周治疗,强化治疗结束后,停止所有降糖药物,继续运动、饮食控制。若诱发低血糖,相应INS减少2~4 U。若开始强化治疗4周后,血糖尚未表达,则需退出研究,依据指南实施针对性治疗。血糖达标天数计算方案:从入院第2天为起始,以5个点毛细血管血糖均达标为结束时间。出现中枢神经系统症状、无法自行干预的低血糖事件,则归纳为严重低血糖。有低血糖症状,可自行处理,血糖值<3.8 mmol/L为轻度血糖。
1.3 观察指标
①观察两组治疗前、治疗后4周血脂水平:总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及空腹INS(FINS)水平,以上指标通过脂酶法进行测定,血肌酐选择苦味酸比色法进行测定,均选择Olympus AU2700全自动生化仪检测;INS选择化学发光免疫法检测,选择ADVIA Centaur自动化学发光免疫分析仪进行检测。②观察两组治疗前、治疗后4周血糖指标:FPG、餐后2 h血糖(2 hPG)变化。③观察两组治疗前、治疗后4周体质量、体质指数(BMI)水平,BMI=体质量/身高2。④观察两组治疗前、治疗后4周稳态模型评估INS抵抗指数(HOMAIR)、稳态模型评估β细胞功能指数(HOMA-β),其中HOMA-IR=FPG×FINS/22.5,HOMA-β=20×FINS/(FPG-3.5)。
1.4 统计方法
采用SPSS 21.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,组间差异比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血脂变化对比
两组治疗前血脂水平差异无统计学意义(P>0.05),治疗后研究组TC、TG、LDL-C、FINS水平明显低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者血脂比较[(±s),mmol/L]
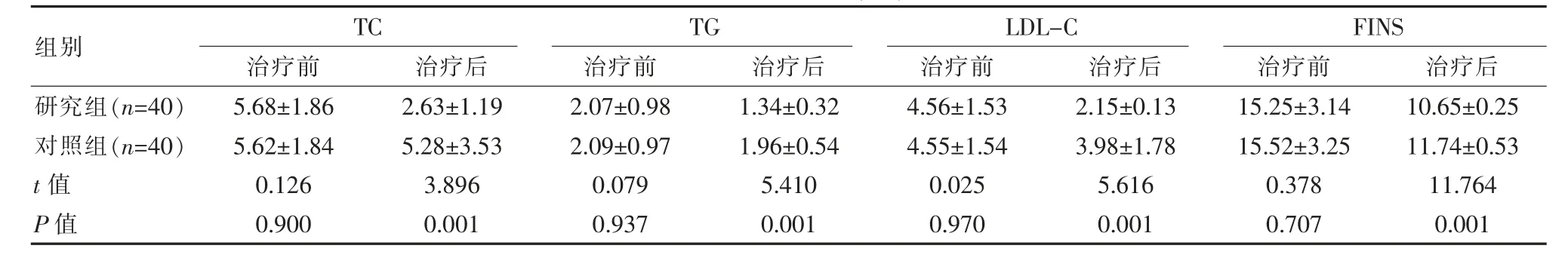
表1 两组患者血脂比较[(±s),mmol/L]
组别研究组(n=40)对照组(n=40)t值P值TC治疗前 治疗后5.68±1.86 5.62±1.84 0.126 0.900 2.63±1.19 5.28±3.53 3.896 0.001 TG治疗前 治疗后LDL-C治疗前 治疗后2.07±0.98 2.09±0.97 0.079 0.937 1.34±0.32 1.96±0.54 5.410 0.001 4.56±1.53 4.55±1.54 0.025 0.970 2.15±0.13 3.98±1.78 5.616 0.001 FINS治疗前 治疗后15.25±3.14 15.52±3.25 0.378 0.707 10.65±0.25 11.74±0.53 11.764 0.001
2.2 两组患者血糖指标比较
两组治疗前FPG、2 hPG血糖指标比较差异无统计学意义(P>0.05),治疗后研究组血糖指标明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者血糖指标比较[(±s),mmol/L]
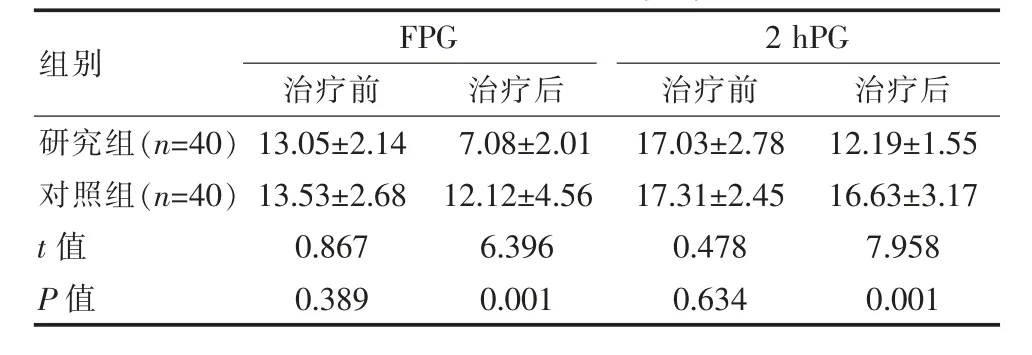
表2 两组患者血糖指标比较[(±s),mmol/L]
组别FPG治疗前 治疗后2 hPG治疗前 治疗后研究组(n=40)对照组(n=40)t值P值13.05±2.14 13.53±2.68 0.867 0.389 7.08±2.01 12.12±4.56 6.396 0.001 17.03±2.78 17.31±2.45 0.478 0.634 12.19±1.55 16.63±3.17 7.958 0.001
2.3 两组患者体质量、BMI指标比较
两组治疗前体质量、BMI指标比较差异无统计学意义(P>0.05),治疗后研究组体质量、BMI明显低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者体质量、BMI指标比较(±s)
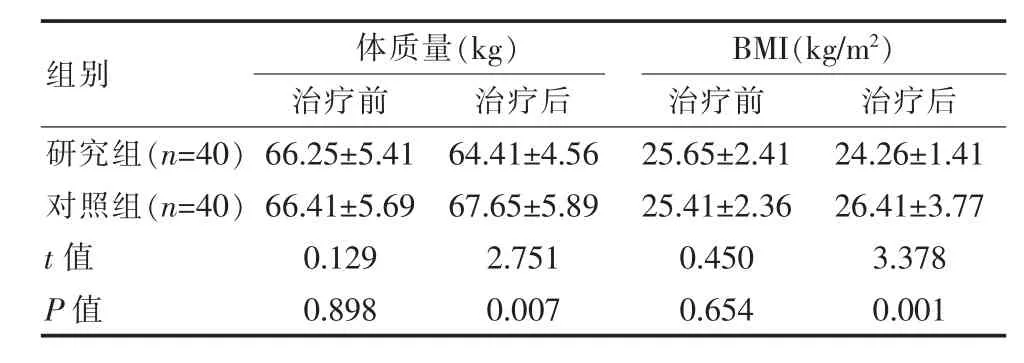
表3 两组患者体质量、BMI指标比较(±s)
组别体质量(kg)治疗前 治疗后BMI(kg/m2)治疗前 治疗后研究组(n=40)对照组(n=40)t值P值66.25±5.41 66.41±5.69 0.129 0.898 64.41±4.56 67.65±5.89 2.751 0.007 25.65±2.41 25.41±2.36 0.450 0.654 24.26±1.41 26.41±3.77 3.378 0.001
2.4 两组患者HOMA-IR、HOMA-β指标比较
两组治疗前HOMA-IR、HOMA-β指标比较差异无统计学意义(P>0.05),治疗后研究组HOMAIR、HOMA-β指标明显低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者HOMA-IR、HOMA-β指标比较(±s)
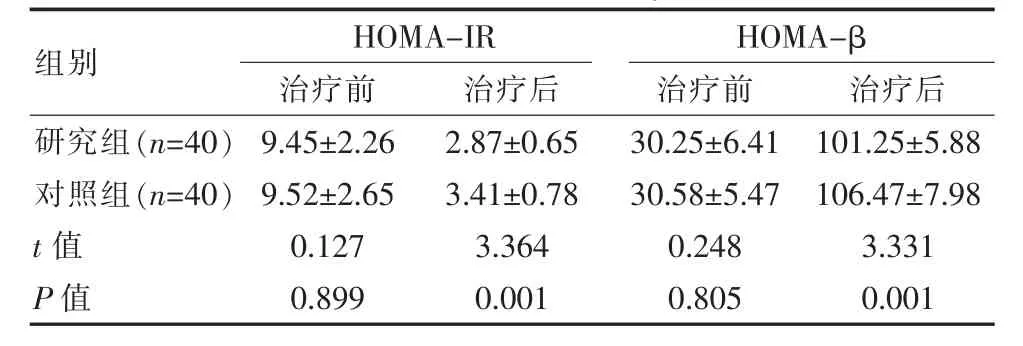
表4 两组患者HOMA-IR、HOMA-β指标比较(±s)
组别HOMA-IR治疗前 治疗后HOMA-β治疗前 治疗后研究组(n=40)对照组(n=40)t值P值9.45±2.26 9.52±2.65 0.127 0.899 2.87±0.65 3.41±0.78 3.364 0.001 30.25±6.41 30.58±5.47 0.248 0.805 101.25±5.88 106.47±7.98 3.331 0.001
3 讨论
现阶段,临床已将T2DM归纳为常见的多发性代谢性疾病,该疾病主要与机体自身INS抵抗和INS细胞功能障碍,造成INS分泌缺陷有关[8-9]。而针对新诊断T2DM患者,一般通过短期INS强化进行治疗,全面促进血糖控制在正常或接近正常,能够去除高血糖毒性对胰岛细胞损伤,修复β细胞功能,同时能够促进诸多患者取得1年以上的临床缓解,即使未取得最佳治疗效果,也能够有利于简化后续治疗方案[10-11]。
但临床研究发现,INS强化治疗伴有不同程度的缺陷,具体如下:①低血糖发生次数逐渐增加;②INS强化治疗通常伴随着体质量增加,而提高INS抵抗。而利拉鲁肽则能够弥补上述方案的局限性,其属于一类GLP-1类似物,主要在胰高糖素样肽基础上,利用人工技术合成、提取,促进INS分泌物质,不仅能维持天然人胰高胰素样肽-1功效,还具有半衰期长等优势,以降低餐后血糖为主要目标,且与甘精INS联合治疗,可达到一定互补性,有效避免低血糖发生,达到减轻体质量效果[12]。相关研究发现,口服降糖药控制欠佳患者,通过利拉鲁肽+甘精INS治疗后,其HbA1c控制效果明显优于基础-餐时INS注射方案治疗[13-14]。而该文研究发现,治疗后研究组血糖指标明显低于对照组,且体质量、BMI明显低于对照组(P<0.05),分析原因:可能与利拉鲁肽上调心肌、骨骼肌、脂肪细胞的葡萄糖转运蛋白-4,促进上述组织增加葡萄糖利用、摄取存在一定联系[15]。同时INS替代治疗能够促进β细胞规避超负荷分泌,取得一定短暂休息,有利于恢复β细胞功能[16]。该文研究发现,经强化治疗后,两组HOMA-β均获得一定好转,分析原因:GLP-1能够控制β细胞凋亡,促进β细胞增殖,诱导α细胞、胰腺泡细胞、胰腺导管分化为β细胞,进而促进胰岛β细胞数量增加[17]。相关研究发现,甘精INS降糖效果显著,且作用持久,在诸多患者体内可持续作用24 h以上,无明显峰值和波动状况,能够有效稳定机体INS水平,进而为机体奠定生理基础INS量[18]。而利拉鲁肽则能够全面缓解T2DM患者餐后血糖上升现象,且在患者胰岛β细胞受损状况下,配合该药物不仅能够提供餐时INS,还可稳定INS生理需求量[19]。故利拉鲁肽可全面规避因INS剂量过度,而造成INS抵抗、高INS血症、低血糖、体质量增加等风险[20]。
综上所述,利拉鲁肽+甘精INS治疗新诊断降T2DM可获得满意疗效,值得临床应用及推广。

