黄酮类化合物微生物合成途径构建与优化研究进展
朱睿睿,赵玉成,秦民坚
(中国药科大学中药学院,江苏,南京211198)
黄酮类化合物是一类以二苯基色原酮为基本骨架的植物次生代谢产物,通常以苷与苷元的形式广泛存在于植物体内,可为植物的生存与繁殖提供一定的进化优势[1]。此外,黄酮类化合物具有抗氧化、抗炎镇痛[2]、抗心脑血管疾病[3]、抗肿瘤、保肝护肝[4]和抗病毒[5]等多种药理活性,在医药领域具有广阔的应用前景。
黄酮类化合物以2-苯基色原酮为基本母核,由两个芳香环(A 环与B 环)通过中间三碳结构(C 环)连接而成。如图1 所示,黄酮类化合物可根据A 环与B环之间的三碳原子结构是否成环、取代、氧化以及键饱和度等差异归类为查尔酮、异黄酮、黄酮醇等类以及各类的二氢衍生物[6-7]。黄酮类化合物在植物中有多种生物学功能,如影响花的颜色与气味,吸引昆虫授粉同时提高观赏价值[8-9];对抗各种生物与非生物胁迫,如抵御紫外线[10]、防止微生物感染和食草动物吞食[11-12]。黄酮类化合物在人类慢性疾病方面也具有一定的治疗作用,包括癌症、糖尿病、阿尔茨海默症等[13-17],同时在功能食品中的应用也越来越广泛[18]。
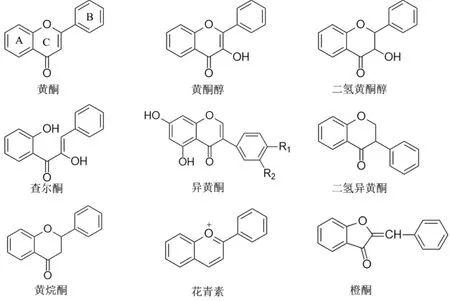
图1 黄酮类化合物基本骨架Fig.1 The structure of several flavonoids
黄烷酮是黄酮类化合物合成的直接前体,由苯丙氨酸与酪氨酸通过苯丙素途径合成[19]。如图2所示,葡萄糖在系列酶的催化下,生成苯丙素途径起始底物苯丙氨酸与酪氨酸[19-20],随后分别在苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)与酪氨酸解氨酶(Tyrosinase,TAL)的催化下转化为类黄酮中间体。例如,苯丙氨酸依次在PAL、肉桂酸4-羟化酶(Cinnamate 4-hydroxylase,C4H)和4-香豆酰辅 酶A 连 接 酶(4-Coumarate:coenzyme A ligase,4CL)的作用下转化为黄酮类化合物合成前体对香豆酰辅酶A,随后与三分子丙二酰辅酶A(Malonyl-CoA)在查尔酮合成酶(Chalcone synthase,CHS)的作用下生成类黄酮生物合成途径的起始底物——查尔酮[21],进而在一系列酶的作用下生成多种黄酮类化合物[22]。

图2 黄酮类化合物生物合成的详细步骤Fig.2 Detailed steps of flavonoid biosynthesis
植物提取作为黄酮类化合物的主要生产方式,操作工艺复杂,且产物常为混合体系,纯化过程会增加生产成本,还会造成产品损失与活性降低[23-25]。现有研究表明通过化学合成能实现部分黄酮类化合物的全合成[26-28],但常伴随极端的反应条件,如高温、强酸与强碱,对环境影响较大,阻碍了化学合成方法规模化和商业化应用[28-29]。另外,通过化学合成产生的黄酮类化合物通常会产生两种立体异构体混合物,需经过结构修饰,如糖基化和手性合成以形成具有生物活性的(2S)-黄酮[30-31]。
1 微生物合成体系
1.1 大肠杆菌合成体系
随着合成生物学与代谢工程的发展,利用微生物细胞工厂生产黄酮类产物已引起广泛关注[25,32-33]。通过重组宿主构建异源体系合成黄酮类化合物与其他方法相比生长周期短、易培养、废弃物少、能耗低、可批量生产。其中,酿酒酵母与大肠杆菌的各种遗传操作与代谢修饰已得到充分的研究,被认为是目前最成熟的真核表达系统与原核表达系统。
大肠杆菌作为微生物细胞工厂具有高培养密度、高生长速率、以及易实施性等优势,是目前微生物生产平台的首选[32-34]。Huwang 等人[35]将来自三个不同物种的PAL、4CL与CHS基因转入大肠杆菌宿主中,成功生成了柚皮素与乔松素,首次实现黄酮类化合物在微生物中的合成。该研究发现天蓝色链霉菌中的4CL,能催化肉桂酸与4-香豆酸分别生成肉桂酰辅酶A与4-香豆酰辅酶A[35]。后续的研究中,利用大肠杆菌成功生成了多种黄酮类化合物,包括圣草酚、柚皮素、乔松素、黄芩素和野黄芩素等,表1 总结了近五年在大肠杆菌中合成黄酮类化合物的相关研究。

表1 大肠杆菌合成黄酮类化合物的相关研究Tab.1 Research on the synthesis of flavonoids production in E. coli
由于大肠杆菌缺乏真核生物特有的膜系统,无法满足细胞色素P450 单加氧酶(CYP450s)的膜定位要求,也不能对蛋白进行翻译修饰和正确折叠,因此需要氧化还原搭档负责电子转移[50]。大肠杆菌从头合成黄酮类化合物时,涉及多种CYP450 酶,这些酶活性较低,选择性较差[51]。为解决CYP450家族基因在大肠杆菌中表达困难的问题,研究人员尝试多种方法试图提高其催化活性与特异性,如融合工程[52]、定向进化方法[19]、蛋白工程[41]和底物工程[53],虽然在一定程度上解决了低效率的问题,但效果甚微[29]。在后续研究中,引入来自细菌非P450的加氧酶和羟化酶取代植物细胞色素P450酶,可能是解决该问题的方法之一。
1.2 酵母合成体系
酿酒酵母作为一种公认的安全菌株,适合大规模生产,在制药和生物技术行业已得到广泛的应用[54-55]。酿酒酵母作为一种有完整膜结构和多个细胞器的真核生物,能为生物合成提供不同环境,且能对蛋白进行翻译修饰与正确折叠。此外,酿酒酵母对恶劣的工业条件还具有很高的耐受性[56]。RO和Douglas 首次证实了对香豆酸是通过PAL、C4H与CPR基因共表达实现在重组酵母中的生产[57-58],但产率较低。之后的研究中,酪氨酸和来自Rhodos⁃pidrium toruloides中的TAL基因被用来代替苯丙氨酸和C4H基因,使对香豆酸的产率有所提高[59]。Ro‑driguez 等 人[60]引 入Flavobacterium johsoniaeu中 的TAL基因并敲除苯基丙酮酸脱羧酶ARO10基因和丙酮酸脱羧酶PDC5基因,通过过表达DHAP 合成酶ARO4基因、分支酸变位酶ARO7基因和莽草酸激酶AroL基因,减少了对香豆酸合成过程中副产物的生成,使对香豆酸的产量达到1.93 ± 0.26 g/L,为生产黄酮类化合物提供了一个有力的平台宿主[60-61]。
Koopman 等人[62]结合产物途径优化、密码子优化、改善前体供给和减少副产物生成等方法,证明了酿酒酵母菌株可以利用葡萄糖从头生产柚皮素。在批量培养体系中,柚皮素的含量超过了400 μmol/L,相较于之前的大肠杆菌菌株,产量增长了4 倍以上[61-63]。Rodriguez等人[64]在前期香豆酸生产菌株的研究基础上,通过过表达4CL、CHS、CHI与CHR等基因,实现了柚皮素、甘草素、山奈酚、5-去氢山奈素、槲皮素和非瑟酮的从头合成。因此,构建高产的酵母菌株是进一步合成黄酮类化合物的重要途径,表2 总结了近几年来黄酮类化合物在酵母菌株中的合成进展。

表2 酿酒酵母合成黄酮类化合物的相关研究Tab.2 Research on the synthesis of flavonoids production inS. cerevisiae
2 微生物合成黄酮类化合物的优化策略
随着合成生物学与代谢工程的迅速发展,已实现了多种黄酮类化合物的微生物合成,但生产效率低、规模小,无法实现目标产物的高效合成。本文将从前体与辅因子优化、关键酶高效与靶向表达、代谢通道构建与微生物共培养技术等方面进行讨论,为黄酮类化合物的高效生产提供优化策略。
2.1 黄酮类化合物生物合成前体的优化
代谢通量不平衡是难以实现微生物高效合成黄酮类化合物的主要因素之一。作为黄酮类化合物合成前体,酪氨酸、苯丙氨酸与丙二酰辅酶A,同时也是维持细胞生长的必需前体[72],因此目标产物合成常受到前体供给不足的限制[73-74]。通过合理改造代谢途径,平衡细胞生长和产物合成之间的碳通量,并引导其流向黄酮类化合物合成途径是实现其高效合成的重要前提条件。
通过直接添加前体化合物作为初始底物在一定程度上能够提高目标黄酮类化合物产量[43,45-46,75],但无法避免内源性途径的竞争消耗,且中间产物积累对微生物宿主也有毒性。通过基因缺失、过度表达与基因组整合等方法,调控微生物代谢网络,将碳源转化为黄酮类化合物合成前体,可提高目标产物的产量[48-49,76-78]。例如,过表达或突变乙酰辅酶A合酶和乙酰辅酶A羧化酶增加酶活性来提高丙二酰辅酶A含量[41,79-80]。此外,可添加脂肪酸抑制剂浅蓝菌素(Cerulenin)或抑制β-酮脂酰ACP 合成酶FabB和FabF基因的表达,延缓丙二酰辅酶A 的自然降解,抑制脂肪酸合成过程对丙二酰辅酶A的消耗[81]。
构建动态调控元件微调细胞生长和产物合成之间的碳通量是提高微生物合成效率的另一种思路[42,82-84]。Wu 等人[82]通过反义RNA 对大肠杆菌脂肪酸通路进行调控,使黄酮类化合物合成通路中丙二酰辅酶A含量增加,结果(2S)-柚皮素的生产效价提高了431%。通过CRISPR 干扰敲除脂肪酸生物合成基因fabB、fabI和fabF,增加细胞内丙二酰辅酶A 的浓度,使白藜芦醇的产量提高到188.1 mg/L,相比对照菌株提高了6倍[83]。此外,选择耶氏酵母属、念珠菌属、油脂酵母属和红酵母属等可积累大量丙二酰辅酶A 的微生物作为黄酮合成的宿主[29,85-87],也可以在一定程度上改善前体供应不足的问题。
2.2 黄酮类化合物生物合成辅因子优化
辅因子的供应对黄酮类化合物合成途径关键酶的活性表达有重要影响,从而进一步影响目标产物产率。细胞自身产生的腺嘌呤核苷三磷酸(Ade‑nosine triphosphate,ATP)能够保证细胞自身各项生命活动,但异源黄酮合成途径对ATP 的需求会超过细胞原有的产出。因此,增加黄酮生物合成通路中的ATP 供应十分重要。在Tao 等人[32,88]的研究中采用CRISPR 干扰技术筛选了与ATP 合成相关的候选基因,发现上调metK基因和proB基因能增加ATP含量,使乔松素产量提高至165.31 mg/L,比对照菌株高10.2倍。另外,还原型辅酶Ⅱ(NADPH)辅因子作为合成代谢的供氢体,不仅参与细胞体内羟化反应,也是Ⅱ类P450酶重要辅助因子[89]。通过加强戊糖磷酸途径代谢通量,改善细胞内的NADPH 水平,能够提高P450 酶的活性。Zhao 等人[90]将生产儿茶酸菌株中的pgi基因(编辑葡萄糖-6-磷酸异构酶)和ppc基因(编码PEP 羧化酶)敲除,提高细胞内NADPH 的水平,使儿茶酸的产量比对照菌株相比高出943%。根据黄酮类化合物合成途径酶活性表达的条件,优化FAD(黄素腺嘌呤二核苷酸)[91]、亚铁血红素[92]等辅助因子的供应[32],均可在一定程度上提升黄酮类化合物的产量。
2.3 优化途径酶的高效表达与靶向性
过度表达黄酮类化合物合成途径酶增加代谢通量,不仅会导致低效碳利用,还会给细胞带来代谢负担[93-94]。因此,提高限速酶活性实现目标化合物高效合成的同时平衡基因表达保持最佳细胞生长状态也十分重要。例如,为筛选较高活性的4CL,通过TtgR 调控系统设计感知4CL 产物积累量的生物传感器[94-95],识别体内定向进化后活性增强的4CL突变体,使柚皮素的产量有所增加[95]。
此外,在大肠杆菌中实现黄酮类化合物高效合成,需改善合成途径中与内质网相关的植物细胞色素P450 单加氧酶的功能表达。通过对宿主大肠杆菌进行改造、优化反应体系以及利用来自细菌的非P450 单加氧酶和羟化酶对P450 酶进行替换,可改善黄酮类化合物生物合成途径的限速反应。对于其他异源基因在宿主菌中的低效表达,通过选择合适的启动子、优化密码子以及通过优化UTR(mRNA降解过程中发挥作用)提高mRNA 稳定性等方法,均能在一定程度上提高基因的表达率。
微调关键酶基因不同组成成分(如启动子强度、核糖体结合位点强度)可以有效平衡基因表达水平[96],但当目标黄酮类产物合成通路涉及多条靶基因时,实现关键酶基因平衡表达耗时耗力[32]。在一项研究中,通过构建基因启动子的所有组合,通过迭代高通量筛选,彻底调整微生物中柚皮素的生物合成途径,最终柚皮素的产量可达到191.9 mg/L[42]。除了要考虑途径酶的平衡表达,还要考虑酶的催化环境和靶向性。例如,利用酵母菌株生产淫羊藿苷时,若在细胞质中表达,通路中甲基转移酶GmOMT2 会因细胞质pH 低而失活,将该酶重新定位至酿酒酵母线粒体(pH高于细胞质)后,首次实现了以葡萄糖为原料合成淫羊藿苷[71]。
2.4 优化黄酮类化合物合成代谢通道
天然黄酮类化合物是植物为抵抗外源刺激与微生物侵染而产生的次生代谢产物,对微生物宿主细胞存在一定的毒性。因此,通过采用代谢通道技术,将反应物从一个活性位点直接转移至另一个活性位点,实现底物向黄酮类化合物的高效转化,可有效降低细胞代谢负担、毒性中间体积累以及防止底物扩散[97-98]。设计蛋白支架,控制酶促反应的空间区域,可实现底物的充分利用和酶的高效表达[99]。例如,在Zhao 等人[90]的研究中,采用组合策略,将儿茶素合成途径中的F3H、DFR 和LAR 等酶的结构域构建成特定的合成蛋白支架,实现代谢通道结构,使儿茶素的产量增加了155.6%。在甲戊酸、葡糖二酸等物质生物合成过程中引入蛋白支架,也在一定程度上提高了产量[99]。然而,目前合成蛋白支架在黄酮类化合物生物合成方面鲜有应用,但与其相似的方法却已有所涉及。将黄酮类化合物合成途径酶组装为复合体,虽然不是真正的支架复合体,但原理都是将酶强制靠近,减少中间体的积累,消除路径瓶颈[100]。例如,通过开发黄芩素两个途径酶的序列自组装酶反应器,在大肠杆菌中成功实现了蛋白-肽相互作用[101],优化了黄芩素的生物合成途径,使黄芩素和野黄芩素等产物产率都有所提升[101]。
2.5 微生物共培养技术生产黄酮类化合物
黄酮类化合物合成菌株代谢途径复杂,传统的微生物代谢工程主要使用单一的菌株构建黄酮类化合物生产平台,使菌体负荷过大,目标产物的产量也受到限制。因此,可通过共培养技术构建高效的合成通路,提高生产性能[102]。例如,Jones 等人将花青素合成途径涉及的15 个外源基因整合到4 个不同的大肠杆菌菌株中,获得的混合菌株培养体系能够从葡萄糖从头生成阿福豆素和翠菊苷。共培养可以克服单一物种的固有限制,同时利用大肠杆菌和酿酒酵母生产黄酮类化合物[102]。P450 酶在大肠杆菌中很难实现功能表达,Wang等人[71]将淫羊藿苷合成途径分为酿酒酵母部分与大肠杆菌部分,不仅可以发挥大肠杆菌快繁的优势,同时也能利用酿酒酵母完整的胞内酶系统,实现膜蛋白酶的成功表达。微生物共培养体系在缓解菌体代谢负担、避免中间产物负反馈作用以及为不同的酶营造适宜生长环境等方面均优于单一菌株培养体系,但仍然无法避免不同菌株之间无亲和性、底物竞争性、代谢中间体转运困难等问题[103]。代谢产物运输的限制和难以保持稳定可靠的共培养体系是该方法广泛应用的主要挑战[38]。因此,进一步优化现有的共培养体系或寻求新的策略来克服这一问题十分重要。
2.6 其他问题
近20年来,多种代谢工程技术和策略已用于黄酮类化合物的微生物合成,然而部分相关酶功能尚不清晰,已知功能的酶数量有限。随着研究的不断深入,已有研究通过对现有的酶进行定向进化,以期获得特定活性的酶。例如,Wu 等人[104]通过计算机快速测试蛋白空间序列,筛选出具有预期活性的酶突变体,为新酶的发现提供了新的方法,但实现对蛋白质从头设计还是具有一定的挑战性。在最近的研究中,通过调节分子间和分子内相互作用,开发出了酶从头合成的新方法,极大地促进了生物合成新途径的构建[105]。
3 总结与展望
黄酮类化合物作为一种在人类健康与医疗领域具有巨大应用潜力的植物次生代谢产物,对其进行微生物合成途径的研究具有重要科研意义与经济价值。但传统生产方法成本高、提取工艺复杂,产品效价与收率低,难以大规模生产应用。随着黄酮类化合物合成途径酶的鉴定与验证,以及分子生物学与合成生物学的快速发展,黄酮类化合物微生物合成途径得到了深入的研究,并取得大量成果,但仍然无法满足工业化需求。为进一步优化现有合成体系,需要不断寻找新的策略以及技术克服黄酮化合物微生物合成中面临的问题与挑战。
黄酮类化合物的从头合成途径较长,因此,微生物共培养技术与动态调控技术可能是今后研究中提高产率的主要策略。通过扩大共培养技术中微生物的种类,并根据各种微生物的生理生化特点与培养特性,对代谢途径进行合理分工,均能在一定程度上提高黄酮类产物的产量。利用高通量筛选与动态调控技术,调控菌株间的相互作用与各反应步骤之间的动态平衡,有望实现从头高效合成黄酮类化合物。我们相信,随着研究逐渐深入与技术不断发展,终能实现微生物合成黄酮类化合物的工业化生产。

