两种诱导方案治疗儿童急性髓系白血病的效果分析
李 艳,郭 雷,卢立慧,常 颖,王文鹏,李 宣,高吉照
(徐州医科大学附属医院儿科,江苏 徐州 221002)
急性髓系白血病(acute myeloid leukemia,AML)属于造血系统恶性肿瘤,是儿童时期常见的高度异质性的恶性肿瘤性疾病,其具有病情危重、进展迅速等特点,由于髓系造血干细胞的无限克隆,导致患儿表现出全身性贫血、局部出血及发热等症状。目前AML的治疗仍是血液病治疗领域的难点,其中柔红霉素结合阿糖胞苷方案(DA)为AML的标准化疗方案,该方案能够对白血病细胞的生长和扩散产生抑制,从而缓解病情,延长生存时间,但化疗期间发生感染、出血等不良反应的风险较高,因此临床应用受限[1]。依托泊苷为半合成的鬼臼乙苷类抗肿瘤药物,其作用于肿瘤细胞的拓扑异构酶Ⅱ,能够抑制拓扑异构酶Ⅱ连接酶的活性,诱导DNA双链断裂,从而引发癌细胞凋亡,具有抑制肿瘤细胞增殖、促肿瘤细胞凋亡的双重抗肿瘤效果,已被广泛用于淋巴瘤、白血病及多种实体肿瘤中[2]。基于此,本研究旨在探讨两种不同诱导方案对AML患儿血小板及血管内皮生长因子(VEGF)、血管内皮生长因子受体(VEGFR)、碱性成纤维细胞生长因子(BFGF)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月至2019年10月徐州医科大学附属医院收治的84例AML患儿为研究对象,采用随机数字表法将其分为对照组和观察组,每组42例。对照组中男患儿21例,女患儿21例;年龄8~12周岁,平均(10.36±0.23)周岁;病程1~12个月,平均(6.12±0.65)个月。观察组中男患儿20例,女患儿22例;年龄7~13周岁,平均(10.22±0.25)周岁;病程2~13个月,平均(6.26±0.75)个月。两组患儿一般资料比较,差异无统计学意义(P>0.05),组间可进行对比。纳入标准:符合《血液病诊断及疗效标准(第3版)》[3]中关于AML的诊断标准者;患儿确诊时年龄 < 18周岁;初次诊断为AML者等。排除标准:对本次研究使用药物存在过敏史者;合并严重先天性心脏病或肝肾功能障碍者;合并其他严重感染性疾病者;不愿配合治疗者等。本研究获得院内医学伦理委员会批准,且患儿法定监护人均签署知情同意书。
1.2 化疗方法 监测入院后患儿各项生命指标变化,包括血常规、血液生化检测等。对照组患儿进行DA方案化疗:第1~3 天予以注射用盐酸柔红霉素(瀚晖制药有限公司,国药准字H33020925,规格:20 mg/支)静脉注射40 mg/m2,1次/d;第1~7 天予以注射用盐酸阿糖胞苷(国药一心制药有限公司,国药准字H20083649,规格:100 mg/支)静脉注射,100~200 mg/m2,1次/d。观察组患儿进行柔红霉素+阿糖胞苷+依托泊苷(DAE)方案化疗:在对照组患儿化疗的基础上,于第1~5 天予以依托泊苷注射液[齐鲁制药(海南)有限公司,国药准字H20143143,规格:5 mL∶0.1 g]静脉注射100 mg/m2,1次/d。两组患儿均以28 d为1个周期,共治疗2个周期。对化疗后骨髓抑制期(停止化疗后7~14 d)和恢复期(停止化疗后21~28 d)实施骨髓穿刺评估。若患儿第1周期获得完全缓解,则应用缓解/巩固治疗,后期根据患儿法定监护人意愿采取自体造血干细胞移植;若患儿第1周期未获得完全缓解但原始细胞比例降低60%以上则再进行1个周期化疗;若第2周期化疗获得完全缓解,则进行巩固治疗,若第2周期仍未获得缓解,则治疗失败,而后进行挽救治疗。巩固治疗方案:低危患儿进行2个疗程治疗,第1个疗程:1~2 d予以注射用盐酸米托蒽醌(江苏恒瑞医药股份有限公司,国药准字H32020964,规格:5 mg/支)静脉注射10 mg/m2,联合阿糖胞苷静脉注射3 d,每次静脉注射2 g/m2,1次/12 h;第2个疗程:于1~3 d静脉注射依托泊苷150 mg/m2,联合阿糖胞苷3 g/m2静脉注射3 d,1次/d。中危或高危患儿:基于低危患儿2个疗程的基础上同时进行1~2 d静脉注射阿糖胞苷,每次3 g/m2,1次/12 h;联合培门冬酶注射液(江苏恒瑞医药股份有限公司,国药准字H20090015,规格:5 mL∶3 750 IU)2 500 IU/m2,于第4剂阿糖胞苷注射后3 h进行肌注,共1次。均以28 d为1个周期,共进行2个周期的巩固治疗,并随访2年。
1.3 观察指标 ①比较两组患儿的治疗效果。根据患儿中性粒细胞、血红蛋白及血小板计数水平评估,其中中性粒细胞正常值为(1.8~6.3)×109/L;血红蛋白正常值:男性120~160 g/L、女性110~150 g/L;血小板计数正常值为(100~300)×109/L。将治疗效果分为:完全缓解(患儿中性粒细胞、血红蛋白及血小板计数均恢复至正常范围);部分缓解(患儿中性粒细胞、血红蛋白及血小板计数有所恢复,但未达正常范围值);未缓解(患儿中性粒细胞、血红蛋白及血小板计数均未改善)[3]。总有效率=完全缓解率+部分缓解率。②比较两组患儿中性粒细胞、血红蛋白、血小板计数恢复正常值时间。取两组患儿清晨空腹静脉血3 mL,中性粒细胞、血红蛋白及血小板计数均采用全自动血液细胞分析仪检测。③比较两组患儿化疗前、化疗2个疗程后血清VEGF、VEGFR、BFGF水平。血液采集方式同②,按照3 000 r/min转速离心10 min,离心半径为10 cm,获取血清,保存于-20 ℃环境下,采用酶联免疫吸附实验法检测血清VEGF、VEGFR、BFGF水平。④统计两组患儿随访期间不良反应发生情况,包括骨髓抑制、血红蛋白减少、感染等。
1.4 统计学方法 使用SPSS 25.0统计软件进行数据分析,计数资料以[例(%)]表示,使用χ2检验;计量资料以(±s)表示,使用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 治疗效果 观察组患儿临床总有效率(59.52%)显著高于对照组(38.10%),差异有统计学意义(P<0.05),见表1。

表1 两组患儿治疗效果比较[例(%)]
2.2 中性粒细胞、血红蛋白、血小板计数恢复正常值时间 观察组患儿中性粒细胞、血红蛋白、血小板计数恢复正常值时间均显著短于对照组,差异均有统计学意义(均P<0.05),见表 2。
表2 两组患儿中性粒细胞、血红蛋白、血小板计数恢复正常值时间比较(±s, d)

表2 两组患儿中性粒细胞、血红蛋白、血小板计数恢复正常值时间比较(±s, d)
组别 例数 中性粒细胞恢复正常值时间血红蛋白恢复正常值时间血小板计数恢复正常值时间对照组 42 18.35±2.36 18.39±2.18 17.33±1.05观察组 42 12.21±2.35 13.02±2.16 12.27±1.03 t值 11.948 11.340 22.295 P值 <0.05 <0.05 <0.05
2.3 血管生成因子水平 与化疗前比,化疗2个疗程后两组患儿血清VEGF、VEGFR、BFGF水平均显著降低,且观察组显著低于对照组,差异均有统计学意义(均P<0.05),见表 3。
表3 两组患儿血管生成因子水平比较(±s)

表3 两组患儿血管生成因子水平比较(±s)
注:与治疗前比较,*P<0.05。VEGF:血管内皮生长因子;VEGFR:血管内皮生长因子受体;BFGF:碱性成纤维细胞生长因子。
组别 例数 VEGF(pg/mL) VEGFR(pg/mL) BFGF(ng/mL)治疗前 化疗2个疗程后 治疗前 化疗2个疗程后 治疗前 化疗2个疗程后对照组 42 362.11±27.18 255.61±20.58* 2 512.33±156.48 1 697.60±212.19* 2.55±0.33 2.13±0.12*观察组 42 368.22±26.59 201.29±20.30* 2 514.12±154.89 1 211.22±223.09* 2.50±0.34 1.99±0.11*t值 1.041 12.178 0.053 10.238 0.684 5.574 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 不良反应 随访期间观察组患儿血红蛋白减少、贫血发生率均显著低于对照组,差异均有统计学意义(均P<0.05);两组患儿骨髓抑制、感染、肝肾功能损伤发生率比较,差异均无统计学意义(均P>0.05),见表4。
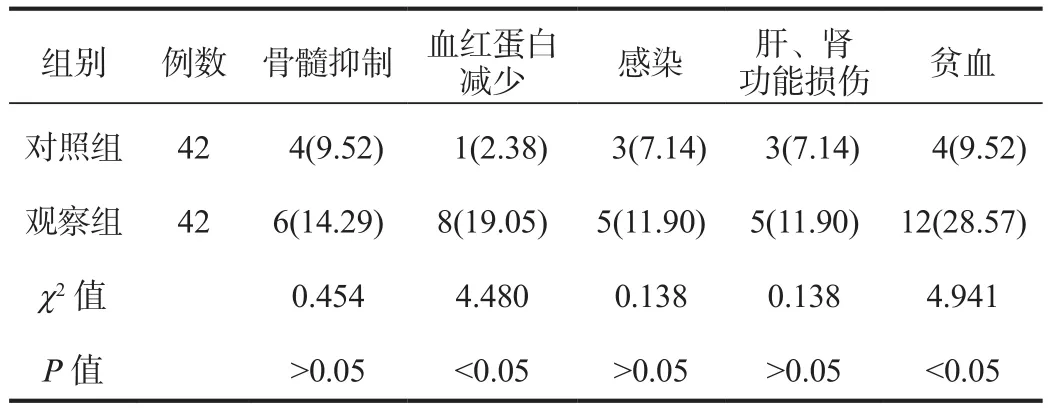
表4 两组患儿不良反应发生率比较[例(%)]
3 讨论
AML是由于骨髓中白细胞克隆性、恶性增殖,对机体正常造血功能形成显著抑制,从而对其他组织器官造成损伤的恶性肿瘤,其主要表现为贫血、发热、出血、感染,以及脏器代谢异常等,严重者会危及患儿生命。目前临床对于其病因和发病机制尚未完全了解,有研究者认为,AML主要是由于环境因素和遗传等因素引起[4]。儿童AML的治疗仍是临床研究的难点,如何提高患儿缓解率、延长生存期、改善生存质量是临床持续关注的重点。
DA为治疗AML的标准化疗诱导方案,在AML诱导缓解期能够获得良好的完全缓解率。柔红霉素作用于核酸合成过程,可与DNA结合,发挥抗肿瘤的效果[5];阿糖胞苷为细胞S增殖期的嘧啶类抗代谢药物,可有效抑制肿瘤细胞增殖[6]。虽然这一标准化疗方案的应用对于AML患儿的临床缓解率较高,但部分AML患儿在化疗期间可能出现骨髓抑制、血小板降低等不良反应,影响整体治疗效果,因此临床需要更为合理的诱导化疗方案以提高治疗效果,并改善患儿预后。依托泊苷能够干扰DNA拓扑异构酶Ⅱ的活性,而在拓扑异构酶Ⅱ插入DNA中能够发挥细胞断裂反应,从而对DNA修复产生影响,因而依托泊苷可间接抑制肿瘤细胞的增殖和生长,故在DA标准化疗方案的基础上结合依托泊苷进行治疗,可进一步提高其临床疗效,改善患儿的临床症状[7]。此外,依托泊苷配合标准化疗方案可通过改变肿瘤表观遗传学,而达到化疗增敏、抗肿瘤效果,而且其化疗不良反应轻微,应用相对安全[8]。本研究结果显示,观察组患儿临床总有效率显著高于对照组,中性粒细胞、血红蛋白、血小板计数恢复正常值时间均显著短于对照组;观察组患儿血红蛋白减少、贫血发生率均显著低于对照组,提示使用DAE方案治疗AML患儿,与DA化疗方案相比较疗效更好,能够有效缩短患儿血小板计数恢复时间,且化疗期间无明显不良反应发生,安全性较好。
血管生成调控因子是评估AML患儿血管形成活跃情况的灵敏指标,其中VEGF为促血管生成主要调控因子,在AML患儿机体中呈高表达,高水平VEGF不仅会刺激白血病细胞自身增殖,而且对于刺激血管内皮增生、新生儿血管生成方面有积极意义[9];VEGF、VEGFR均能够促进体内微血管生成,且相互结合后可刺激白血病细胞快速增殖,从而恶化病情[10];BFGF在正常生理状态下仅以微量存在,对促进细胞分裂和刺激血管生长有着关键作用,但机体发生癌变时,增强了肿瘤细胞中BFGF基因活性,通过自分泌使其水平升高,从而促进肿瘤快速生长[11]。依托泊苷作为一种抗血管生成药物,通过对VEGFR信号转导产生抑制作用,抑制血管内皮生长因子的表达,从而有效抑制肿瘤细胞生长能力,延缓病情进展[12-13]。本研究结果表明,化疗2个疗程后观察组患儿血清VEGF、VEGFR、BFGF水平均显著低于对照组,表明DAE方案治疗AML患儿可明显降低血管生长因子水平,改善患儿临床症状。
综上,使用DAE方案治疗AML能够有效降低血管生长因子水平,改善患儿临床症状,缩短患儿骨髓造血恢复时间,且化疗期间无明显不良反应发生,安全性较好,值得临床推广。

