免疫亲和层析法制备马破伤风免疫球蛋白F(ab′)2
包正琦,段丽娟,戴于栋,孙伟,杨凯,高建军
兰州生物制品研究所有限责任公司,甘肃 兰州 730046
马破伤风免疫球蛋白F(ab′)2是由破伤风类毒素(tetanus toxoid,TT)免疫马所得血浆,经胃酶消化后采用硫酸铵盐析、超滤和柱色谱等工艺纯化制成的液体免疫球蛋白F(ab′)2制剂,用于预防和治疗破伤风梭菌引起的感染[1]。与破伤风抗毒素制备工艺比较,马破伤风免疫球蛋白F(ab′)2增加了一步柱色谱纯化工艺。柱层析工艺作为现代常用的蛋白质纯化技术手段,其纯化过程快速简单、易于放大和控制,已广泛用于生物制品行业。亲和层析(affinity chromatography,AC)是基于目的产物与其固相介质上的配体能够特异性结合和可逆结合的性质而分离获得目的产物的层析技术[2]。免疫亲和层析(immunoaffinity chromatography,IAC)是亲和层析的一种,是利用生物体内存在的抗原、抗体之间高度特异性亲和力进行分离的方法[3]。亲和层析法由于具有高选择性和快速性而成为使用最广泛的抗体纯化方法之一,随着层析介质和固定化方法的发展,免疫亲和层析法在生命科学中已成为一种较有价值的技术[4-6]。
本实验将TT 免疫马所得的血浆经胃酶消化、加温变性、硫酸铵盐析、明矾吸附、超滤,再经免疫亲和层析法纯化制备马破伤风免疫球蛋白F(ab′)2,并对其关键质量指标进行测定,以评价免疫亲和层析制备马破伤风免疫球蛋白F(ab′)2的可行性及所制备产品的质量。
1 材料与方法
1.1 血浆 TT 免疫马血浆由张掖市长丰生物科技有限公司提供。
1.2 主要试剂及仪器 SDS、丙烯酰胺、N,N′-亚甲基双丙烯酰胺均购自美国Sigma 公司;N,N,N′,N′-四甲基乙二胺、过硫酸铵、甲醇、考马斯亮蓝、NaHCO3、NaCl、HAc、HCl、H2SO4、CuSO4、K2SO4、乌酸钠、NaOH及Tris-HCl 均购自国药集团化学试剂有限公司;宽分子量蛋白质marker 购自宝生物工程(上海)有限公司;TT(批号:HP201208001)由兰州生物制品研究所有限责任公司第一研究室提供;CNBr activated Sepharose 4FF、Superdex 200 Increase 10/300 GL 凝胶介质及ATKA purifier 蛋白快速纯化系统均购自美国GE 公司。
1.3 免疫亲和介质制备 称取140 g CNBr activated Sepharose 4FF 干粉介质,用560 mL 1 mmol/L HCl溶液充分溶解,倒入层析柱中,1 mmol/L HCl 溶液冲洗10 ~ 20 个柱体积。用含0.5 mol/L NaCl 的0.1 mol/L NaHCO3(pH 8.3)置换TT 的缓冲体系后,与上述介质混合,室温振荡2 h;装柱,用含0.5 mol/L NaCl 的0.1 mol/L NaHCO3(pH 8.3)冲洗5~10 个柱体积,采用0.1 mol/L Tris-HCl(pH 8.0)低流速冲洗层析柱5 ~ 10 个柱体积,封闭未结合位点。再依次用含0.5 mol/L NaCl 的0.1 mol/L Tris-HCl(pH 8.0 ~ 9.0)洗涤5 ~ 10 个柱体积,含0.5 mol/L NaCl 的0.1 mol/L HAc(pH 3.0 ~ 4.0)洗涤3 ~ 6 个柱体积,即完成介质的偶联与装柱。
1.4 纯化方法 马血浆经胃酶消化、加温变性、硫酸铵盐析、明矾吸附后,用平衡液(50 mmol/L PB +0.15 mol/L NaCl,pH 7.0)超滤浓缩至原血浆体积的20%,获得3 批破伤风抗毒素,批号分别为M-20160302、M-20160303、M-20160304,再进行柱层析纯化。装好的层析柱用平衡液平衡至少3 ~ 5 个柱体积,至UV 达到基线,开始上样,上样体积为3 个柱体积,经平衡液平衡至UV 达到基线,再用洗脱液(0.25 mol/L HAc)进行洗脱,UV 大于100 mAU 时开始收集洗脱峰,收集至UV 降至100 mAU 以下结束。用1 mol/L NaOH 溶液调节洗脱液pH 至6.5,超滤浓缩,用0.22 μm 滤芯除菌,获得相应3 批马破伤风免疫球蛋白F(ab′)2原液,批号分别为S-20161013、S-20161028、S-20161103。平衡和上样过程的线性流速均为150 cm/h,洗脱过程的线性流速为250 cm/h。
1.5 质量检测
对3 批破伤风抗毒素及相应3 批马破伤风免疫球蛋白F(ab′)2进行质量检测。
1.5.1 蛋白质含量 按照《中国药典》三部(2020版)[1]附录通则0731 蛋白质含量测定法第一法检测制品的蛋白质含量,破伤风抗毒素及马破伤风免疫球蛋白F(ab′)2的蛋白质含量应分别不高于100 和50 mg/mL。
1.5.2 分子大小分布 采用分子排阻色谱法测定样品的聚合物含量及F(ab′)2含量[7],色谱柱为Superdex 200 Increase 10/300 GL 凝胶过滤预装柱,流动相为50 mmol/L PB+0.15 mol/L NaCl(pH 7.0)。样品蛋白浓度为2~2.5 mg/mL,进样量为60 μL,检测波长为280 nm,线性流速为30 cm/h,检测时长为70 min,按照面积归一化法计算色谱图中F(ab′)2、完整IgG 和聚合物的相对含量。破伤风抗毒素及马破伤风免疫球蛋白F(ab′)2的聚合物总和均应不高于5%。
1.5.3 纯度 参照《中国药典》三部(2020 版)[1]附录通则0541 电泳法中的第五法,采用7.5% SDSPAGE 分析样品的纯度,破伤风抗毒素及马破伤风免疫球蛋白F(ab′)2的IgG 含量应不高于5%,F(ab′)2含量应不低于70%。
1.5.4 效价 按照《中国药典》三部(2020 版)[1]附录通则3508 破伤风抗毒素效价测定法测定效价,马破伤风免疫球蛋白F(ab′)2和破伤风抗毒素的效价均应不低于2000 IU/mL。
1.5.5 比活性 每1 g 蛋白质所含的抗体总效价即为比活性。按照《中国药典》三部(2020 版)[1]提供的公式计算马破伤风免疫球蛋白F(ab′)2和破伤风抗毒素的比活性[比活性(IU/g)= 效价(IU/mL)/ 蛋白质含量(mg/mL)× 1000]。破伤风抗毒素及马破伤风免疫球蛋白F(ab′)2的比活性应分别不低于45000和75000 IU/g。
1.6 稳定性评价 将1.4 项制备的马破伤风免疫球蛋白F(ab′)2按1 mL/瓶分装,置(25± 2)℃保存,于保存1、2、3、6 个月时取样,分别按1.5.3 项方法测定效价。
2 结果
2.1 质量检测结果
2.1.1 蛋白质含量 S-20161013、S-20161028、S-20161103 批马破伤风免疫球蛋白F(ab′)2的蛋白质含量分别为20.4、19.5、20.2 mg/mL,均值为20.03 mg/mL;M-20160302、M-20160303、M-20160304 批破伤风抗毒素的蛋白质含量分别为46.1、45.3、45.4 mg/mL,均值为45.6 mg/mL。前者的蛋白质含量均远小于后者,降低了56%。
2.1.2 分子大小分布 3 批马破伤风免疫球蛋白F(ab′)2和3 批破伤风抗毒素的F(ab′)2含量均值分别为91.84%和91.02%,含量变化较小;聚合物含量均值分别为1.22%和2.92%,前者比后者下降了59%。见表1。3 批马破伤风免疫球蛋白F(ab′)2的分子大小分布图谱重合度较高,见图1。
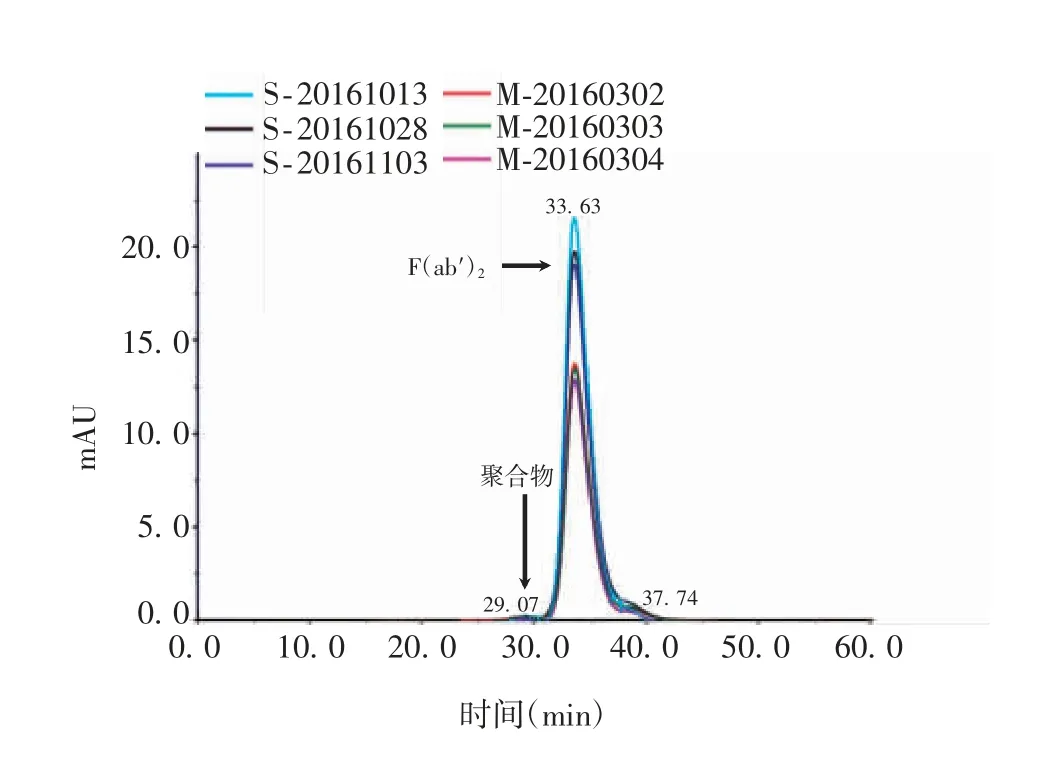
图1 马破伤风免疫球蛋白F(ab′)2 和破伤风抗毒素的分子大小分布图谱Fig.1 Molecular size distribution map of equine tetanus immunoglobulin F(ab ′)2 and TAT
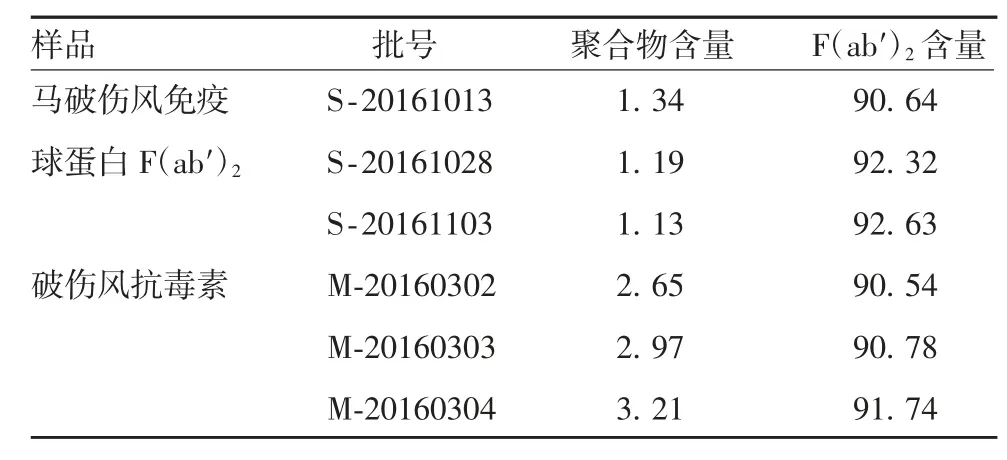
表1 分子大小分布的检测结果(%)Tab.1 Detection result of molecular size distribution(%)
2.1.3 纯度 经7.5% SDS-PAGE 分析,3 批马破伤风免疫球蛋白F(ab′)2和3 批破伤风抗毒素于相对分子质量约100000 处可见F(ab′)2条带,但前者比后者的小分子杂质含量少。S-20161013、S-20161028、S-20161103 批马破伤风免疫球蛋白F(ab′)2的F(ab′)2含量分别为90.7%、91.5%、94.3%,M-20160302、M-20160303、M-20160304 批破伤风抗毒素的F(ab′)2含量分别为89.2%、89.5%、90.8%;两者的IgG 含量均为0。见图2。
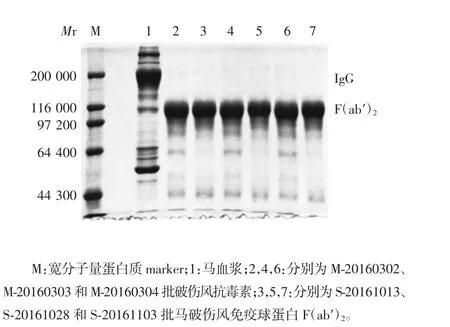
图2 马破伤风免疫球蛋白F(ab′)2 及破伤风抗毒素的SDS-PAGE 分析Fig.2 SDS-PAGE profile of equine tetanus immunoglobulin F(ab′)2 and TAT
2.1.4 效价 S-20161013、S-20161028、S-20161103批马破伤风免疫球蛋白F(ab′)2的效价分别为3800、3500、3900 IU/mL,均值为3733 IU/mL;M-20160302、M-20160303、M-20160304 批破伤风抗毒素的效价分别为2500、2600、2500 IU/mL,均值为2533 IU/mL。前者效价比后者提高了47%。
2.1.5 比活性 S-20161013、S-20161028、S-20161103批马破伤风免疫球蛋白F(ab′)2的比活性分别为186275、179487、193069 IU/g,均值为186277 IU/g;M-20160302、M-20160303、M-20160304 批破伤风抗毒素的比活性分别为54229、57395、55066 IU/g,均值为55563 IU/g。前者的比活性比后者提高了335%。
2.2 稳定性 马破伤风免疫球蛋白F(ab′)2于(25 ±2)℃放置6 个月后,效价均在合格范围之内,见表2。
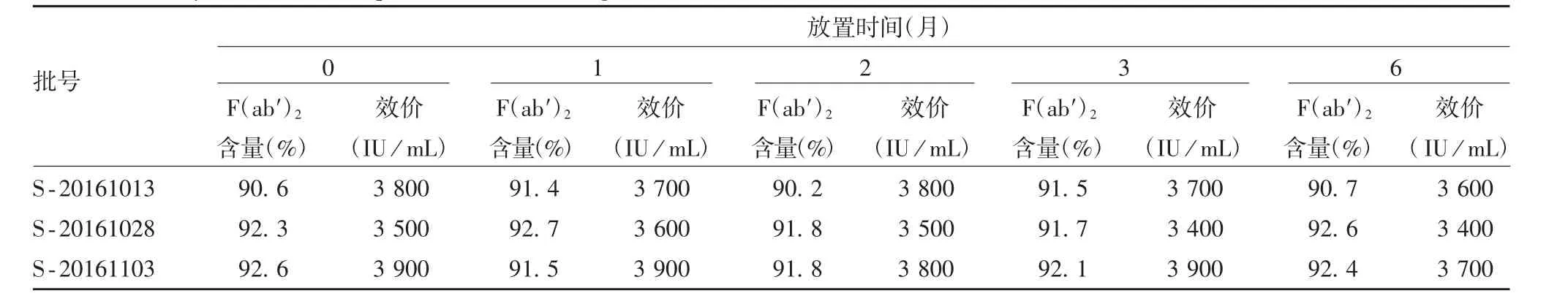
表2 马破伤风免疫球蛋白F(ab′)2 的稳定性检测结果Tab.2 Stability test result of equine tetanu immunoglobulin F(ab′)2
3 讨论
破伤风抗毒素的临床应用非常广泛,作为预防和治疗破伤风感染的特殊药品,进入体内与血液中的游离毒素结合后被机体免疫系统清除而发挥作用[8]。马破伤风免疫球蛋白F(ab′)2作为破伤风抗毒素的升级产品,与破伤风抗毒素相比,蛋白质含量大幅降低,同时效价和比活性得到了较大提高,聚合物也得到了大幅降低。两者同属于动物源性制品,对于人体而言是外源性蛋白,输入人体不良反应发生率较高[9-10],输入外源性蛋白的总量越多则发生不良反应的发生率也越高[11]。另外,据有关文献报道,聚合物含量可能是影响不良反应发生的因素之一[12],马破伤风免疫球蛋白F(ab′)2与破伤风抗毒素比较,蛋白质含量和聚合物含量大幅降低,进一步降低了发生不良反应的发生率[13]。本实验采用免疫亲和层析法制备的马破伤风免疫球蛋白F(ab′)2,其蛋白质含量和聚合物含量更低,因此发生不良反应的可能性较破伤风抗毒素更小。
李景玉等[14]在专利申请中采用DEAE 柱层析纯化的马破伤风免疫球蛋白F(ab′)2比活性为80000 ~100000 IU /g;杨俊杰等[7]采用辛酸沉淀结合DEAE柱层析技术纯化马IgG,比活性为60000~80000 IU/g;ZHANG 等[15]采用两步盐析加一步蛋白G 亲和层析制备的马破伤风免疫球蛋白F(ab′)2片段,比活性为90000 IU/g。综上所述,增加一步层析步骤均可提高马破伤风免疫球蛋白F(ab′)2的比活性,但上述层析方法均是非特异性方法,因此比活性提高幅度较低。本研究采用的免疫亲和层析技术属于特异性方法,纯化过程中收集的均是具有中和活性的目的蛋白,因此获得马破伤风免疫球蛋白F(ab′)2的比活性平均值可达186277 IU/g,远高于其他方法。本研究纯化过程中去除的主要是无中和活性的杂蛋白,纯化后目的蛋白收率范围为40% ~ 60%,在今后的大规模生产中会导致从马血浆中提取蛋白效价的总收率下降,基于获得更高比活性的马破伤风免疫球蛋白F(ab′)2,收率下降是可以接受的。
亲和层析是分离纯化蛋白质等生物大分子特异而有效的层析技术,分离过程简单、快速,分辨率高,具有高度的选择性、分辨率和优良的载量[16-17]。与其他层析技术相比,免疫亲和层析技术更具专一性、高效性、特异性[18-19]。本实验采用免疫亲和层析法制备马破伤风免疫球蛋白F(ab′)2,可进一步降低聚合物含量和制品的蛋白含量,从而得到高效价和高比活性的破伤风马免疫球蛋白F(ab′)2制剂。本研究稳定性研究结果显示,采用免疫亲和层析制备的马破伤风免疫球蛋白F(ab′)2于(25 ± 2)℃放置6 个月,效价均在合格范围之内,稳定性较好。本研究为马破伤风免疫球蛋白F(ab′)2制剂及同类产品的制备提供了新的思路。

