评估慢性乙型病毒性肝炎患者换用集采恩替卡韦的疗效与安全性
乙型肝炎病毒(hepatitis B virus,HBV)感染呈世界性流行,据WHO报道,全球约有2.57亿慢性HBV感染者
。据估计,目前我国一般人群HBsAg流行率为5%~6%,慢性HBV感染者约7 000万例,其中慢性乙型病毒性肝炎(chronic hepatitis B,CHB)患者2 000万~3 000万例
。乙型病毒性肝炎是慢性肝病进展为肝硬化、肝癌等终末期肝病最常见的病因
。抗病毒治疗是治疗CHB患者的关键措施。恩替卡韦可强效抑制病毒复制,改善肝脏炎症,长期治疗可改善乙型肝炎肝硬化患者的组织学病变,显著降低肝硬化并发症和肝细胞癌(hepatocellular carcinoma,HCC)的发生率
。多项权威指南/共识推荐:抗病毒治疗,HBV-DNA应控制在20 IU/ml以下以产生完全病毒学应答
。若HBV-DNA持续/间歇处于20~2 000 IU/ml即为低病毒血症,可显著增加患者肝纤维化进展风险,进而增加肝硬化、肝癌等终末期肝病发生风险
。大量研究显示,国产恩替卡韦分散片活性成分与进口恩替卡韦片相同,长期规律口服国产恩替卡韦分散片可有效将HBV-DNA控制在20 IU/ml以下(即产生完全病毒学应答),显著降低HCC风险和肝脏相关死亡风险,且价格较低廉,成为很多患者的第一选择
。为响应国家医保局、国家卫健委、国家药监局等部门组织的以公立医疗机构为集中采购主体采购药品,进而解决药品价格虚高问题号召,我院于2019年12月28日集采恩替卡韦片(北京百奥)。集采恩替卡韦片服用28 d仅需5.5元,价格是一般国产恩替卡韦分散片的1/37,但因上市时间短,其疗效与安全性仍存在很多疑问。尤其对于已长期规律口服国产抗病毒药物CHB患者而言,换药长期口服集采恩替卡韦片对维持患者完全病毒学应答等疗效及安全性不确切。本研究旨在探究长期规律口服国产恩替卡韦分散片的CHB患者换药口服集采恩替卡韦片的长期疗效及安全性评估。
baby普通词义为“婴儿”,在科技英语中表示“微小的物体”。 如:baby car微型汽车;baby carrier轻型航空母舰;baby tower小型蒸馏塔。
1 资料与方法
回顾性分析2019年1月1日至2021年5月18日在郑州大学第一附属医院河医院区感染肝病门诊就诊的CHB患者。纳入标准:(1)诊断符合《慢性乙型肝炎防治指南(2019年版)》
;(2)接受国产恩替卡韦分散片治疗至少1年已产生完全病毒学应答;(3)年龄≥18周岁。排除标准:(1)合并HCV、HDV、HIV感染者;(2)曾用免疫抑制剂、干扰素患者;(3)肝移植患者;(4)依从性差,不能规律口服抗病毒药物,不能定期至我院复查。按照纳入及排除标准,纳入已长期口服国产抗病毒药物治疗超过1年,并产生完全病毒学应答CHB患者,共计260例。根据纳入研究后是否换药,将纳入后继续服用国产恩替卡韦分散片的104例患者作为未换药组;将纳入后改为口服集采恩替卡韦(北京百奥)的156例患者作为换药组。两组剂量均为0.5 mg/d,纳入后服用抗病毒药物治疗时间均超过48周,患者依从性好,能按要求定期至我院复查,复诊同时了解依从性及药物不良反应。观察终点为:纳入研究期间,在治疗24周及48周时,是否为持续性完全病毒学应答,本研究获得医院伦理委员会的批准(批号:2022-KY-0405)。
收集患者纳入研究时的年龄、性别、ALT等基线情况,比较纳入研究后治疗24周及48周时的HBV-DNA、ALT、HBeAg、乙型肝炎病毒e抗体(HBeAg/抗-HBe)水平。(1)HBV-DNA:使用磁珠法提取总核酸(DNA/RNA)制备模板,再用乙型感染病毒核酸检测试剂盒(荧光PCR法)定量人血清中HBV-DNA含量,检测下限为20 IU/ml;(2)ALT:使用丙氨酸氨基转移酶测定试剂盒(IFCC法)定量测定人血清或肝素血浆中ALT的活力,参考区间为:ALT<41 U/L;(3)HBeAg:使用乙型肝炎病毒e抗原测定试剂盒(时间分辨荧光免疫法)定量检测血清标本中HBeAg的含量,其检测结果<0.6 NCU/ml为阴性;(4)抗-HBe:使用乙型肝炎病毒e抗体测定试剂盒(时间分辨荧光免疫法)定量检测血清标本中乙型肝炎病毒e抗体的含量,其检测结果<1.0 NCU/ml为阴性。上述检测均由本院检验中心专人完成。
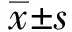
260例患者纳入研究时,HBV-DNA均低于检测下线。比较两组患者年龄、性别、ALT、HBeAg(+)、抗-HBe(+),差异均无统计学意义(
均>0.05,见表1)。
2 结果
网络整体内向接近中心度标准差为7.164,外向接近中心度标准差为6.940,差异较小,且节点间差异没有很大差异,说明三峡地区旅游节点的通畅程度较高,并没有出现明显的阻碍现象。个体节点以白帝城、解放碑、小三峡、三峡大坝、神女峰、重庆红岩的内外向中心度最高,表明这几个节点与三峡地区其他景点通达性较好,受其他节点控制较弱,近20年过去了,游客在三峡旅游的游线组合中仍然包含这几个经典景区。相对这些景区,三峡旅游的经典景区中衰落较快的景区为张飞庙、万州港、大昌古镇、小小三峡、三游洞、葛洲坝、名山、涪陵新城、三峡大瀑布。这些景区节点与其他景区节点依赖性较强,旅游目的地竞争力相对较弱。
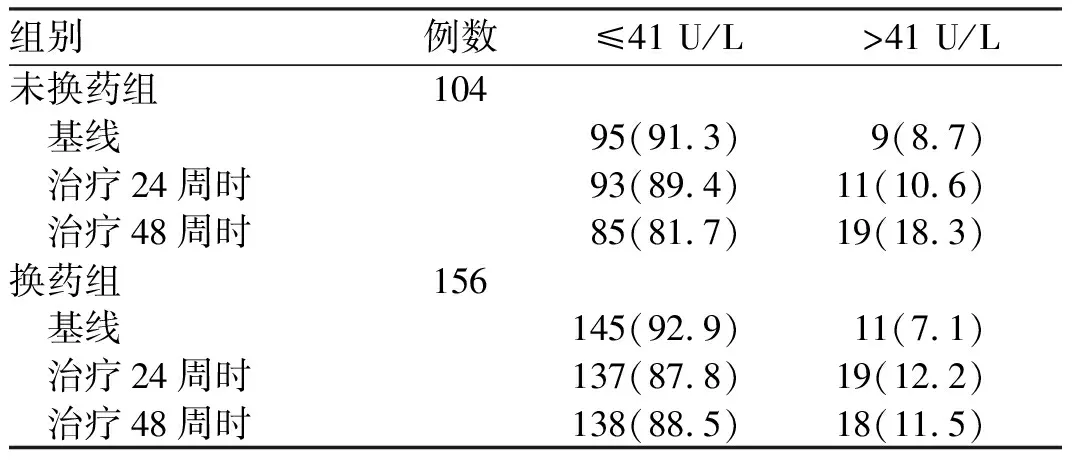
两组患者治疗24周和48周时,HBeAg转阴率、HBeAg/抗-HBe血清学转换率差异均无统计学意义(
>0.05,见表3)。
在治疗过程中,所有患者均未发生与药物相关的不良反应和实验室检测结果异常。
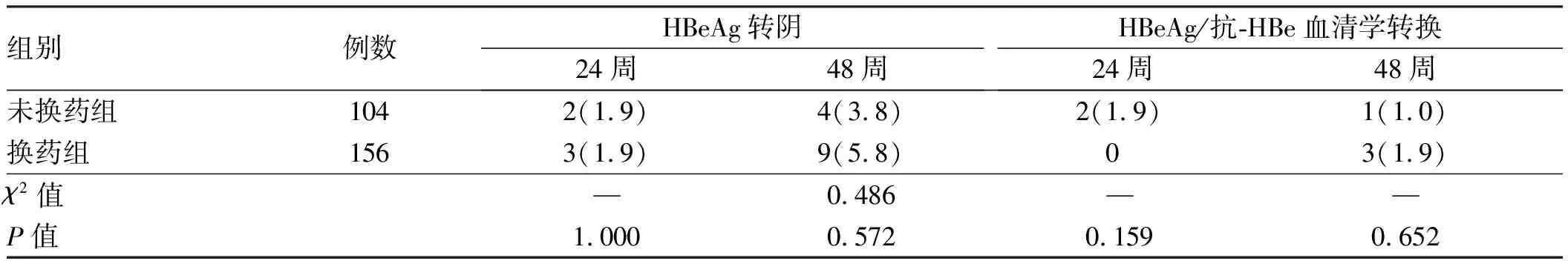
260例患者纳入研究时,均已规律口服国产恩替卡韦治疗超过1年,HBV-DNA基线水平均低于检测下线。纳入研究后,治疗24周时未换药组完全病毒学应答率为97.12%(101/104),换药组为96.79%(151/156),两者比较,差异无统计学意义(
=1.000);治疗48周时两组患者HBV-DNA均低于检测下线,完全病毒学应答率均为100%,差异无统计学意义(
>0.05)。
钱穆先生认为,以政事领导民众,仍是居上临下,法制禁令,其效不能深入人心;导之而不从,以刑罚齐一之,民之有畏而已,其心无所感化。德者,在上者自己之人格与心地,以此为领导,乃人与人、心与心相感相通,非居上临下之比。
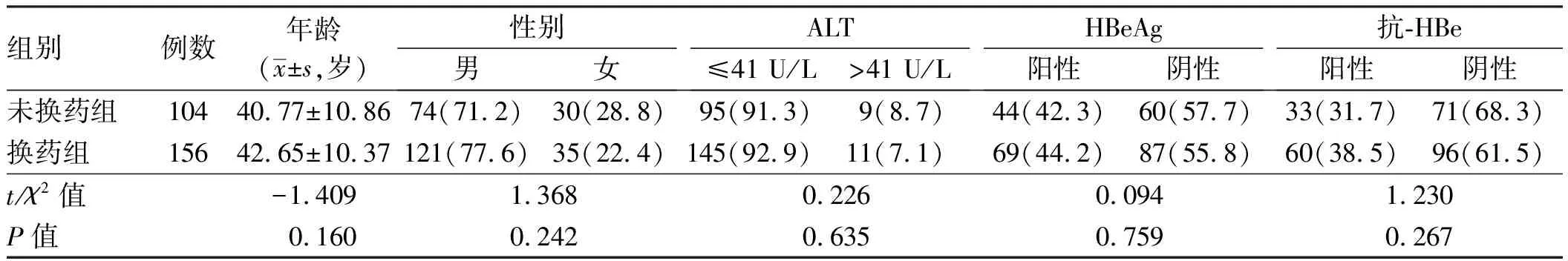
对ALT明显升高者(>2×ULN)抗病毒同时口服保肝药(双环醇50 mg,2次/d)治疗至ALT恢复正常值后停药。未换药组与换药组ALT复常率组间与组内比较,差异均无统计学意义(
>0.05,见表2)。
3 讨论
HBV属嗜肝DNA病毒科,是有包膜的DNA病毒,为部分双链环状DNA
。HBV通过肝细胞膜上的钠离子-牛磺胆酸协同转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)作为受体进入肝细胞
。侵入肝细胞后,部分双链环状HBV-DNA在细胞核内以负链DNA为模板,延长正链以修补正链中的裂隙区,形成共价闭合环状DNA(covalently closed circular DNA,cccDNA)
。cccDNA半寿(衰)期较长,难以从体内彻底清除,对慢性感染起重要作用
。因此,需长期抗病毒治疗。目前,CHB患者可选择的抗病毒治疗方案有:核苷(酸)类似物(nucleoside analogues,NAs),注射干扰素治疗,或两者联合治疗
。注射干扰素治疗对患者人群有选择性,绝大部分患者选择规律口服抗病毒药物治疗,各大权威指南推荐一线治疗口服抗病毒药物主要是NAs,包括恩替卡韦、替诺福韦酯和富马酸丙酚替诺福韦
。大量研究数据显示,采用恩替卡韦治疗可强效抑制病毒复制,改善肝脏炎症,安全性较好,长期治疗可改善乙型肝炎肝硬化患者的组织学病变,显著降低肝硬化并发症和HCC的发生率,降低肝脏相关和全因病死率
。
我国国产恩替卡韦疗效稳定,与进口恩替卡韦相比,在疗效与安全性方面无差异,是很多患者首选的抗病毒药物
。国产恩替卡韦疗效确切,但价格昂贵。集采恩替卡韦,1个月仅需5.5元,显著减轻CHB患者口服药物费用负担。虽然集采药物一般会经过3期临床试验观察后投入使用,但目前暂无确切的文献报道集采恩替卡韦的有效性与安全性。本研究发现,两组患者完全病毒学应答率差异无统计学意义,但未换药组和换药组中分别有3例(3/104,2.88%)和5例(5/156,3.21%)间歇HBV-DNA阳性(均在20~2 000 IU/ml),即为低病毒血症,患HCC风险较高,这可能是由于患者出现耐药,应检测是否耐药并调整NAs治疗,推荐选择新一代抗病毒药物富马酸丙酚替诺福韦
。有大量研究表明,服用恩替卡韦治疗患者换为富马酸丙酚替诺福韦治疗后可提高或维持完全病毒学应答率
。由于本研究为回顾性分析,纳入研究时限较短,未追踪患者后续治疗方案及效果;两组患者在不同节点均有ALT波动,差异无统计学意义,这可能与患者饮食、休息、劳累、饮酒等有关,必要时可行口服保肝药物治疗
;HBeAg阴转率及HBeAg/抗-HBe血清学转换率差异均无统计学意义。
式中,QBCF为评价区域农产品的重金属生物可利用风险商;A为研究区农产品中重金属的实测质量分数均值,mg·kg-1;C为研究区土壤中重金属的实测质量分数均值,mg·kg-1;CS为土壤重金属的限量值,采用GB 15618中规定的土壤污染风险筛选值,mg·kg-1;S为农产品重金属的限量标准值,采用 GB 2762中规定的食物中污染物限量标准,mg·kg-1;SE为研究农产品中重金属i的实测值的标准误差。
综上所述,集采恩替卡韦为安全抗病毒药物,且价格低廉,可广泛用于临床。本试验的不足之处在于试验周期较短,纳入患者数量较少,应增加病例、延长抗病毒疗程进一步观察集采恩替卡韦的抗病毒疗效与安全性,为临床指导用药提供更充分的证据。
[1] Revill PA, Chisari FV, Block JM, et al.A global scientific strategy to cure hepatitis B[J].Lancet Gastroenterol Hepatol, 2019, 4(7): 545-558.DOI: 10.1016/S2468-1253(19)30119-0.
[2] Liu J, Liang W, Jing W, et al.Countdown to 2030: eliminating hepatitis B disease, China[J].Bull World Health Organ, 2019, 97(3): 230-238.DOI: 10.2471/BLT.18.219469.
[3] Ren X, Xu Z, Liu Y, et al.Hepatitis B virus genotype and basal core promoter/precore mutations are associated with hepatitis B-related acute-on-chronic liver failure without pre-existing liver cirrhosis[J].J Viral Hepat, 2010, 17(12): 887-895.DOI: 10.1111/j.1365-2893.2009.01254.x.
[4] Su F, Kristin B, Ioannou GN.No difference in hepatocellular carcinoma risk between chronic hepatitis B patients treated with entecavir versus tenofovir[J].Gut, 2021, 70(2): 370-378.DOI: 10.1136/gutjnl-2019-319867.
[5] Terrault NA, Lok ASF, McMahon BJ, et al.Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J].Hepatology, 2018, 67(4): 1560-1599.DOI: DOI: 10.1002/hep.29800.
[6] 中华医学会感染病学分会, 中华医学会肝病学分会.慢性乙型肝炎防治指南(2019年版)[J].临床肝胆病杂志, 2019, 35(12): 2648-2669.DOI: 10.3969/j.issn.1001-5256.2019.12.007.
Chinese Society of Infectious Diseases, Chinese Medical Associations;Chinese Society of Hepatology, Chinese Medical Association.Guidelines for the prevention and treatment of chronic hepatitis B(version 2019)[J].J Clin Hepatol, 2019, 35(12): 2648-2669.DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[7] European Association for the Study of the Liver.EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J].J Hepatol, 2017, 67(2): 370-398.DOI: 10.1016/j.jhep.2017.03.021.
[8] Yao K, Liu J, Wang J, et al.Distribution and clinical characteristics of patients with chronic hepatitis B virus infection in the grey zone[J].J Viral Hepat, 2021, 28(7): 1025-1033.DOI: 10.1111/jvh.13511.
[9] 徐东平, 李进, 张玲霞.恩替卡韦治疗慢性乙型肝炎的研究进展[J].中华医学杂志, 2006, 86(28): 2014-2016.DOI: 10.3760/j:issn:0376-2491.2006.28.020.
[10] 吕睿.慢性乙型病毒性肝炎抗病毒治疗进展[J].现代医药卫生, 2013, 29(2): 220-224.DOI: 10.3969/j.issn.1009-5519.2013.02.032.
[11] Wieland SF, Chisari FV.Stealth and cunning: hepatitis B and hepatitis C viruses[J].J Virol, 2005, 79(15): 9369-9380.DOI: 10.1128/JVI.79.15.9369-9380.2005.
[12] Yan H, Zhong G, Xu G, et al.Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J].Elife, 2012, 1: e00049.DOI: 10.7554/eLife.00049.
[13] Seeger C, Mason WS.Hepatitis B virus biology[J].Microbiol Mol Biol Rev, 2000, 64(1): 51-68.DOI: 10.1128/MMBR.64.1.51-68.2000.
[14] Tan A, Koh S, Bertoletti A.Immune response in hepatitis B virus infection[J].Cold Spring Harb Perspect Med, 2015, 5(8): a021428.DOI: 10.1101/cshperspect.a021428.
[15] Zhang Z, Zhou Y, Yang J, et al.The effectiveness of TDF versus ETV on incidence of HCC in CHB patients: a meta analysis[J].BMC Cancer, 2019, 19(1): 511.DOI: 10.1186/s12885-019-5735-9.
[16] Yip TC, Wong GL, Chan HL, et al.HBsAg seroclearance further reduces hepatocellular carcinoma risk after complete viral suppression with nucleos(t)ide analogues[J].J Hepatol, 2019, 70(3): 361-370.DOI: 10.1016/j.jhep.2018.10.014.
[17] Ogawa E, Nomura H, Nakamuta M, et al.Tenofovir alafenamide after switching from entecavir or nucleos(t)ide combination therapy for patients with chronic hepatitis B[J].Liver Int, 2020, 40(7): 1578-1589.DOI: 10.1111/liv.14482.
[18] Li ZB, Li L, Niu XX, et al.Switching from entecavir to tenofovir alafenamide for chronic hepatitis B patients with low-level viraemia[J].Liver Int, 2021, 41(6): 1254-1264.DOI: 10.1111/liv.14786.

