炎症性肠病患者免疫抑制剂和生物制剂治疗对疫苗接种的影响
疫苗接种是降低免疫较为低下的人群感染性疾病发病率和死亡率的主要方式。炎症性肠病(inflammatory bowel disease,IBD)患者免疫功能低下,主要是因为使用免疫调节药物包括激素、免疫抑制剂、生物制剂或小分子药物。重要的是,即使是流感病毒也可以导致年轻IBD患者的发病率和死亡率增加,因此,例行特定的免疫接种程序在此人群中很重要
。据报道,IBD患者由于缺乏对感染风险的认识、恐惧不良反应或疫苗成本导致了低接种率
。因此,专科医师包括消化内科医师、全科医师和感染病学专家也建议参与共同决策提供疫苗接种策略。IBD患者和疫苗接种的核心问题包括5个方面:IBD患者疫苗的接种时机、免疫调节剂药物对于疫苗转化率和滴度的影响、疫苗接种对于IBD病程的影响、疫苗对于妊娠过程的影响、疫苗接种对于婴幼儿和老年人的影响。
1 常见疫苗的分类举例和制剂工艺
常见的疫苗主要包括灭活疫苗和活疫苗(见表1)。值得注意的是,由于疫苗制作工艺的不同,针对同一传染性疾病的疫苗可能由于其给药方式或地区分布而不完全相同。如流感三价疫苗为灭活疫苗,而鼻腔内流感疫苗则为活疫苗;甲肝疫苗进口制剂为灭活疫苗,而国产制剂为非灭活疫苗。
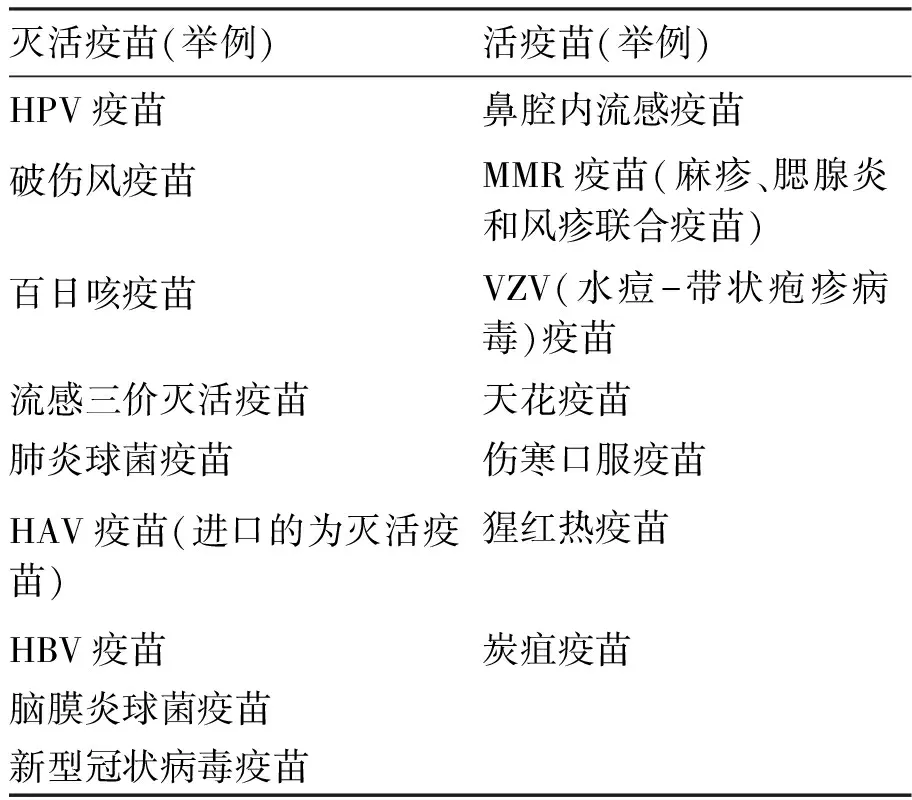
新型冠状病毒肺炎流行以来,对于疫苗制作工艺的审视又重新进入了感染学专家、病毒学者和制剂厂家的考量范围。常用疫苗按照制剂工艺分类主要包括灭活疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、核酸疫苗(分mRNA和DNA疫苗)等。这几类疫苗因制剂工艺的不同各有一定的优缺点。其中灭活疫苗技术成熟但免疫保护时间较短;腺病毒载体疫苗有效性可能不足;核酸疫苗对存储和运输的要求较高。以新型冠状病毒疫苗为代表,上述5种疫苗均有研发,可以以新型冠状病毒疫苗的研制工艺为例来了解当前各类疫苗的制作工艺,通过工艺和储存运输差异可以了解不同种类疫苗的优缺点(见表2)。

2 IBD患者接种疫苗与免疫抑制治疗的基本认识
对于活疫苗,IBD患者接种时机有3个要点:(1)首先要强调尽早接种。IBD患者接种疫苗最好是在疾病的早期阶段,理想情况下,应在患者第1次IBD诊断时检查免疫状况,并向全科医师询问接种疫苗记录;(2)使用激素接种疫苗时机:如果单独使用激素治疗,停药1个月后可以考虑注射活疫苗,活疫苗对于每日服用<20 mg强的松当量、服用时间<14 d的患者可能是安全的;使用免疫抑制类药物接种疫苗时机:这里面包括较高剂量的激素、免疫抑制剂、生物制剂和小分子药物,对这部分药物,使用免疫抑制类药物3个月内禁止注射活疫苗。(3)成人IBD患者疫苗接种策略主要是根据特定国家的指导方针,执行常规疫苗接种计划,包括年龄特异性疫苗(如流感疫苗、带状疱疹疫苗),而在免疫抑制治疗期间,活疫苗是禁忌使用的。在IBD诊断时或诊断前建议接种水痘疫苗、乙肝疫苗、流感疫苗和人乳头状瘤病毒疫苗;在使用免疫调节剂之前建议注射肺炎球菌疫苗,灭活流感疫苗建议需要1年接种1次,23价肺炎球菌多糖疫苗增强剂需要与上一次接种间隔5年以上
。
对各种灭活疫苗来说,免疫抑制类药物的使用整体上不影响接种。3价流感疫苗是一种灭活疫苗,需要每年注射1次,免疫抑制治疗可能会降低其效果;乙肝疫苗也是灭活疫苗,可以使用0、1个月、6个月的注射频率,最后一次给药后1个月需要检查抗体滴度;如果无抗体则需要复种或使用双倍剂量乙肝疫苗;人乳头瘤病毒疫苗注射的间隔为0、2个月、6个月,可以使用4价疫苗;肺炎球菌疫苗分为13价和23价。接种13价疫苗8周后给予23价肺炎球菌疫苗注射,5年后可以再次接种单剂量23价肺炎球菌疫苗。值得注意的是,另一剂量的23价肺炎球菌疫苗应在65岁或以上患者中使用并且从上一剂量23价疫苗注射起至少已有5年;单纯疱疹病毒也是一种灭活疫苗,整体上是安全的,其第二剂注射需要在第一剂注射2个月后
。
IBD患者患带状疱疹的风险与普通人群相比增加1.2~1.8倍,尤其是在50岁以上人群、使用免疫抑制剂、托法替布的人群中,而使用维得利珠单抗和乌司奴单抗的患者并未显著增加带状疱疹的发生概率。在小剂量免疫抑制剂治疗的IBD患者中(甲氨蝶呤每周≤0.4 mg/kg,硫唑嘌呤≤3.0 mg·kg
·d
,6-巯基嘌呤≤1.5 mg·kg
·d
),带状疱疹减毒活疫苗的效价会降低
,因此推荐重组疫苗。
IBD患者经常受到免疫抑制治疗,接受抗TNF-α治疗的患者对疫苗的抗体反应较低。百日咳病例在后疫苗时代处于高发水平。美国一项横断面研究评估IBD患者与正常对照者对百白破疫苗的抗体反应
。该研究按维持用药方案分层的成人IBD患者分为三组:(1)硫嘌呤类药物单药疗法;(2)抗TNF单一疗法;(3)联合治疗(抗TNF和免疫调节剂,如硫唑嘌呤或甲氨蝶呤)。该研究结果表明IBD患者的百日咳相关抗体浓度显著低于正常对照者(
=0.021),而使用抗TNF药物(单药治疗或联合治疗)的患者的抗体浓度低于使用巯嘌呤类药物单药治疗的患者(
=0.028)。IBD患者的整体白喉抗体浓度也较低(
<0.001),与巯嘌呤类药物单药治疗组相比,使用抗TNF药物(单药治疗或联合治疗)的患者白喉抗体浓度较低(
<0.001)。这些结果表明,IBD患者需要不同的百白破疫苗增强方案应对抗TNF治疗带来的抗体滴度下降。
由于委派制在某种程度上的“过渡性”和“不彻底性”,审计人员的专业化、系统化的培训较少,人员专业素养提升较慢,难以胜任日益复杂的审计业务要求。
3 IBD患者接种疫苗与免疫抑制治疗的抗体转化率和滴度
在成人IBD患者中,HBV疫苗免疫应答率(anti-HBs >10 IU/L)为61%,这似乎低于普通人。在年轻时接种疫苗和在缓解期接种疫苗与较高的血清学接种率相关,而使用免疫抑制类药物(皮质类固醇、免疫抑制剂和抗TNF药物)与接种反应减弱相关
。成人IBD患者使用抗TNF后,初次接种乙肝疫苗的血清保护率下降为43.5%,相比之下,接受维得利珠单抗治疗对乙肝疫苗的血清保护率无影响。尽管有一些研究认为连续接种两个疗程,每个疗程接种三剂乙肝疫苗可能会获得较高的应答率,但这一结论在不同的研究中有争议。为了应对使用免疫抑制类药物可能导致的乙肝疫苗抗体滴度下降,部分不同佐剂(AS04)的乙肝疫苗剂型投入临床使用,通过强化治疗的方法可能抵消诸如激素或抗TNF药物对于疫苗转化率的降低
。
一项波兰的多中心研究评估白喉强化疫苗在IBD患儿接受和未接受免疫抑制治疗时的免疫原性和安全性,93%的患儿获得免疫保护
。接种白喉强化疫苗如抗体滴度≥0.1 IU/ml表示对白喉有保护作用,而≥ 1.0 IU/ml可以确保长期保护效能。白喉强化疫苗在IBD患儿中诱导了对白喉的保护(93.5%)和长期保护(56.5%),其中56.5%的患儿获得了强化效应。在使用免疫抑制治疗组和免疫抑制治疗组之间血清保护率和强化效应差异无统计学意义。
本次补充调查对象主要以种子植物为主,下一步将对蕨类植物进行收集整理。此外,受个人水平和时间所限,还有一些领域尚未涉足,如禾本科、莎草科、唇形科等,可以说保护区的植物资源相当丰富,还有很大的潜力可挖,期待同行专家前来考察指导。
活疫苗在IBD患者中的接种与激素剂量、使用时长及生物制剂种类相关。对每日使用<20 mg当量强的松同时短于2周的成人患者或每日使用<2 mg/kg当量强的松的儿童患者、使用5-ASA的患者、使用维得利珠单抗的患者接种活疫苗通常无需间隔于上述药物的使用;但对于每日使用≥20 mg当量强的松的激素或长于2周的成人患者或每日使用≥2 mg/kg当量强的松的儿童患者,活疫苗通常需要在激素使用后1个月方可接种;对于免疫抑制和其他生物制剂或小分子药物,活疫苗通常需要在这些药物使用3个月后方可接种
。以水痘疫苗为例,水痘疫苗是一种活疫苗,免疫抑制治疗开始前至少3周使用两剂,两剂的间隔时间需要超过4周,并且不建议在免疫抑制治疗开始后接种水痘疫苗。
例4(2013湖北卷·文16)我国古代数学名著《数书九章》中有“天池盆测雨”题:在下雨时,用一个圆台形的天池盆接雨水.天池盆盆口直径为二尺八寸,盆底直径为一尺二寸,盆深一尺八寸.若盆中积水深九寸,则平地降雨量是 寸.注:① 平地降雨量等于盆中积水体积除以盆口面积;②一尺等于十寸.
美国的一项研究
评估使用免疫抑制类药物包括硫唑嘌呤/6-巯基嘌呤和抗TNF-α单克隆抗体的IBD患者中使用MMR疫苗诱导的麻疹、腮腺炎和风疹抗体滴度。这项横断面研究比较了46例IBD患者和20名健康对照者(healthy controls,HC)接种两剂MMR疫苗后的抗体浓度。入选三个IBD组并根据免疫抑制方案分层分为巯嘌呤类药物单药治疗组、抗TNF单药治疗组,或联合治疗组(抗TNF药物联合巯嘌呤类药物治疗组)。结果显示,所有受试者对三种疫苗病毒均获得了满意的转化率,IBD患者麻疹(IBD:667 mIU/ml
HC:744 mIU/ml;
=0.45)、腮腺炎(IBD:339 EU/ml
HC:402 EU/ml;
=0.62)或风疹(IBD:25 mIU/ml
HC:62 mIU/ml;
=0.11)的抗体滴度与正常对照组比较,差异无统计学意义,IBD治疗组之间的抗体滴度差异无统计学意义,因此,该研究发现使用免疫抑制类药物的IBD患者的抗体滴度与健康对照组相当。
我国在2017年就制定了使用TNF单克隆抗体的疫苗接种原则
。其中要点和国外一些指南较为相近,有三点值得重视:(1)3个月内接受过活疫苗接种者禁用;(2)使用抗TNF-α单克隆抗体的妊娠女性患者其婴儿在出生6个月内不能接种活疫苗以防引起严重感染;(3)IBD患者可以按照疫苗计划接种灭活疫苗,但有TNF单克隆抗体可能影响其接种有效性和滴度。随着对新型冠状病毒疫苗的深入认识,一些新型冠状病毒疫苗接种过程中的关键问题形成了专家共识,巴西炎症性肠病学会的共识对临床有一定的指导意义:(1)IBD患者并不表现为更高的新型冠状病毒感染率,因此在疫苗接种分配组中无需优先,而高危人群如医务工作者应该优先;(2)目前所有疫苗均适合IBD患者;(3)免疫抑制有可能影响疫苗的有效性,主要涉及转化率和滴度,但仍然需要更为长期的观察和循证依据;(4)IBD患者的疫苗接种整体安全,在接种时不考虑附加风险;(5)IBD患者不应该推迟免疫抑制治疗以便接种疫苗,而是应该采取个体化接种和应接种尽接种的策略
。
4 特殊IBD人群接种疫苗与免疫抑制治疗
白百破疫苗如必须在妊娠期接种,则建议最好是在妊娠27~36周接种;人类乳头瘤病毒疫苗通常在妊娠期不建议接种;灭活型带状疱疹疫苗还缺乏妊娠期接种的数据。而其余灭活型甲肝、乙肝、流感、脑膜炎奈瑟菌、肺炎球菌疫苗在妊娠期无需改变接种计划
。如活疫苗包括麻腮风疫苗、水痘带状疱疹疫苗、活疫苗型带状疱疹疫苗不建议在妊娠期接种。另外如果母亲为IBD患者,15月内婴幼儿疫苗接种灭活疫苗不受影响,但如果使用免疫抑制类药物,麻腮风和水痘疫苗建议在12个月后注射,而轮状病毒疫苗需要检测生物制剂血药浓度,测不出方可使用。
儿童IBD患者如不考虑免疫抑制药物的使用,可接种非复制性疫苗;如果暂不计划在4~6周内开始免疫抑制治疗,可以考虑接种减毒活疫苗;如果免疫抑制疗法已经开始,减毒活疫苗可在停药至少3个月后注射(皮质类固醇单药治疗在停药1个月后注射)。对于儿童IBD患者来说,在免疫抑制治疗期间,疫苗的有效性可能较低,滴度在疫苗接种史未知或野生型感染的情况下,或可用于确认足够的抗体水平
。而对于老年IBD患者来说则更需要消化专科医师、感染病学专家、社区医师的共同参与,均衡患者的获益和风险。
当前国内城市化进程的不断加快,城市内部的居住空间越来越少,人口却越来越多。广大城市居民为了能够在有限的城市空间内提高生活质量,对于建筑内部空间的合理利用问题开始越来越关注。在这样的大背景下,也间接地加快了建筑装修装饰行业的顺利发展。建筑装修品质的优劣不但影响了人们的生活环境,而且对于建筑物的整体效果也有重要的影响。在建筑装修过程当中如要发生质量问题,业主不但要重新进行翻修整改,造成大量的经济损失,并且还会破坏建筑的内部构造带来安全隐患,长此以往必然会给建筑行业发展带来极大的阻碍。
5 总结
某些IBD患者感染的风险增加,其中一些是可以通过接种疫苗预防的。消化专科医师应与社区接种疫苗的医师密切合作告知患者适当免疫接种的重要性。灭活疫苗可以不管患者使用何种方案的免疫抑制治疗,但活疫苗的安全性取决于免疫抑制治疗的类型和时间长短。免疫接种是保证IBD患者避免合并感染的有效措施,即使IBD患者需要使用免疫抑制类药物,也需要合理安排疫苗接种的时机和疫苗的种类。
[1] Rahier JF, Papay P, Salleron J, et al.Influenza A(H1N1)v infection in patients with inflammatory bowel disease: a case series[J].Aliment Pharmacol Ther, 2011, 33(4): 499-500.DOI: 10.1111/j.1365-2036.2010.04558.x.
[2] Malhi G, Rumman A, Thanabalan R, et al.Vaccination in inflammatory bowel disease patients: attitudes, knowledge, and uptake[J].J Crohns Colitis, 2015, 9(6): 439-444.DOI: 10.1093/ecco-jcc/jjv064.
[3] Beaugerie L, Rahier JF, Kirchgesner J.Predicting, preventing, and managing treatment-related complications in patients with inflammatory bowel diseases[J].Clin Gastroenterol Hepatol, 2020, 18(6): 1324-1335.e2.DOI: 10.1016/j.cgh.2020.02.009.
[4] Papa A, Scaldaferri F, Vetrone LM, et al.How to face the advent of SARS-CoV-2 vaccination in IBD patients: another task for gastroenterologists[J].Vaccines(Basel), 2021, 9(3): 248.DOI: 10.3390/vaccines9030248.
[5] Manser CN, Maillard MH, Rogler G, et al.Vaccination in patients with inflammatory bowel diseases[J].Digestion, 2020, 101 Suppl 1(Suppl 1): 58-68.DOI: 10.1159/000503253.
[6] 中华医学会消化病学分会炎症性肠病学组.抗肿瘤坏死因子α单克隆抗体治疗炎症性肠病专家共识(2017)[J].协和医学杂志, 2017, 8(4): 239-243.DOI: 10.3969/j.issn.1674-9081.2017.05.009.
[7] Queiroz NSF, Teixeira FV, Freire CCF, et al.Brazilian IBD study group position statement on SARS-COV2 vaccination[J].Arq Gastroenterol, 2021, 58(1): 1-4.DOI: 10.1590/S0004-2803.202100000-02.
[8] Caldera F, Ann Misch E, Saha S, et al.Immunosuppression does not affect antibody concentrations to measles, mumps, and rubella in patients with inflammatory bowel disease[J].Dig Dis Sci, 2019, 64(1): 189-195.DOI: 10.1007/s10620-018-5321-z.
[10] Caldera F, Saha S, Wald A, et al.Lower sustained diphtheria and pertussis antibody concentrations in inflammatory bowel disease patients[J].Dig Dis Sci, 2018, 63(6): 1532-1540.DOI: 10.1007/s10620-018-5043-2.
[11] Wasan SK, Zullow S, Berg A, et al.Herpes zoster vaccine response in inflammatory bowel disease patients on low-dose immunosuppression[J].Inflamm Bowel Dis, 2016, 22(6): 1391-1396.DOI: 10.1097/MIB.0000000000000743.
[12] Jiang HY, Wang SY, Deng M, et al.Immune response to hepatitis B vaccination among people with inflammatory bowel diseases: a systematic review and meta-analysis[J].Vaccine, 2017, 35(20): 2633-2641.DOI: 10.1016/j.vaccine.2017.03.080.
[13] Chaparro M, Gordillo J, Domènech E, et al.Fendrix vs engerix-B for primo-vaccination against hepatitis B infection in patients with inflammatory bowel disease: a randomized clinical trial[J].Am J Gastroenterol, 2020, 115(11): 1802-1811.DOI: 10.14309/ajg.0000000000000926.
[14] Zullow S, Farraye FA.Updates on vaccinating the inflammatory bowel disease patient[J].Expert Rev Gastroenterol Hepatol, 2019, 13(3): 229-239.DOI: 10.1080/17474124.2019.1565993.
[15] Dipasquale V, Romano C.Vaccination strategies in pediatric inflammatory bowel disease[J].Vaccine, 2017, 35(45): 6070-6075.DOI: 10.1016/j.vaccine.2017.09.031.

