耐力运动对脑纤维结构的特异性影响
严世振,王正光,2,张琪涵,2,白学军,2,金 花,2
(1. 天津师范大学 心理学部,天津 300387;2. 天津师范大学 心理与行为研究院,天津 300387)
1 引 言
大量研究[1–8]表明,具有特定专业技能的专家(如专业运动员)的脑结构功能不同于非专业人员或新手,这些结果为脑损伤后康复方案的制定提供了有效的参考。在结构维度上,这些研究多集中于脑的形态结构(如灰质或白质体积)上,如:Park等[9]发现,优秀篮球运动员小脑蚓部的白质体积显著大于非运动员;Paruk等[3]比较了12名训练1年以上的耐力运动员和非运动员的T1结构像,全脑分析发现运动员全脑灰质和白质体积大于非运动员,但兴趣区分析发现运动员在右侧初级感觉运动皮层、右侧额下回和额中回、左侧丘脑的灰质体积小于非运动员。目前有关运动专家脑白质微结构特点的报道相对较少,有待进行更多的实证研究。
对于白质微观结构的评估,各向异性分数(Fractional Anisotropy,FA)即组织内水分子的各向异性成分占全部扩散张量的比例(变化范围是0~1),是目前应用最广泛的反映白质微结构的指标,它与神经纤维轴突和髓鞘的完整性、纤维束的致密度及走行有关[10]。目前运动专家脑白质微结构特点的研究尚处于数据积累的初始阶段,报道相对较少,专家类型较为分散,结果的无序性较高。如:Toh等[11]发现,年轻柔道运动员在内囊、胼胝体膝部、体部、压部和上纵束FA均显著高于对照组,提示专业训练可能会增加脑白质FA和纤维完整性;而Jäncke等[12]的研究发现,高水平高尔夫球运动员在内囊、外囊、皮质脊髓束附近以及顶盖处的FA和白质体积显著小于初级运动员,提示专业运动训练可能减少脑白质FA。Huang等[13]发现,优秀体操运动员上、下纵束和额枕下束等白质纤维束的FA低于非运动员。因此推测,专业运动训练对脑白质的影响具有一定的项目和脑区特异性。不同类型的运动对体能、技能和认知能力的需要不同,专业训练优先发展的竞争能力不同,对具体脑区结构的影响也不同,因此,不同脑区的白质结构或功能的变化出现专业依赖性也是合理的。此外,仅依靠FA的变化并不能准确反映白质纤维束的变化,进一步的研究需要引进更多的扩散指标如轴向扩散系数(Axial Diffusivity,AD)和径向扩散系数(Radial Diffusivity,RD),以准确描述白质纤维束的变化。因此,脑白质的结构变化与专业运动训练之间的关系尚需更多实验数据。
耐力运动(如长跑、长距离竞走)与体操等技能型项目有质的区别,前者是典型的体能型项目,也是当前社会参与度最高的体育项目。以长距离径赛运动员为模型探讨耐力运动对个体脑白质微结构的可塑性影响具有更好的社会意义。目前,Chang等[14]基于长跑运动员兴趣脑区FA的特点探讨了耐力训练对脑白质微结构的影响,比较了11名长跑运动员(每天接受4.2 h训练,至少持续2.8年)和11名正常大学生基底神经节的FA差异,发现长跑运动员苍白球内段FA显著低于非运动员,但双侧基底节的尾状核、壳核、苍白球外段等感兴趣区的FA无显著差异。这一研究率先为耐力训练改变脑白质微结构的可能性提供了实验依据,但它仅限于基底节特定兴趣区的白质变化比较,未比较脑组织的其他区域,且仅依靠单一的FA指标也不能很好地揭示白质纤维改变的机制。FA只能反映水分子扩散运动各方向差异的程度,如FA减小可能是由于本征(或主要)方向的扩散降低,也可能是由于非本征(或次要)方向的扩散增加,因此,FA的变化不能确切揭示白质变化的具体原因。AD和RD分别描述水分子在平行和垂直于主要纤维束方向上的扩散能力,二者的变化能够反映FA变化的具体原因和机制。例如:AD的变化能够反映主要纤维束轴索的改变[15],对大的轴突变化更敏感;而RD的变化更多反映次要或细小联系纤维,乃至细胞膜结构的改变[16−17]。因此,需要通过AD和RD的变化探索长跑训练引起FA变化的深层原因。
纤维束自动定量分析(Automating Fiber-Tract Quantification,AFQ)可自动提取出脑白质中20条主要纤维束不同节点上的扩散值进行统计分析。与兴趣区分析方法相比,AFQ可以快速、可靠地识别和测量白质纤维束,并允许分析沿纤维束轨迹的扩散特性,提供更多关于白质微结构的信息。本文采用AFQ技术重建脑部主要神经纤维,比较优秀长距离径赛运动员和普通大学生的脑白质主要纤维束扩散值,以揭示长距离径赛运动员脑白质微结构特点,探讨长期耐力训练与脑主要白质纤维束微结构改变间的关系。鉴于目前对专业运动员的白质微结构特征尚处于初步探索阶段,数据量较少且结果较离散,本文提出假设:专业耐力训练可能改变个体脑内纤维束的微观结构,运动员脑内特定纤维束的FA和RD、AD不同于非运动员。关于FA和RD、AD的深入研究能提示纤维束改变的位置和特点。
2 研究方法
2.1 被 试
实验共招募被试59人。运动员组为28名曾参加全国及以上级别赛事(包括奥运会和世界锦标赛)的现役运动员(年龄18~28岁),其中,国际级运动健将5人,国家级运动健将6人,其余为国家一级运动员,项目包括3 000 m跑、5 000 m跑、马拉松赛、20 km和50 km竞走。对照组为31名天津某高校非体育学院、非学校运动队学生(年龄18~25岁),没有参加过任何全国及以上级别的体育比赛。所有被试经爱丁堡问卷测定均为右利手[18],视力或矫正视力正常且不是色盲或色弱。所有被试身体健康,无脑外伤史、药物依赖病史、精神病史、神经病史及家族病史,无核磁检查禁忌证。被试在实验前签署了知情同意书并填写自编运动经历问卷(包括运动或锻炼时间、项目、参与的比赛等)。本实验已通过所在单位伦理委员会批准。
2.2 磁共振数据采集
采用天津师范大学脑成像中心西门子Prisma 3.0 T磁共振扫描仪和64通道头线圈。T1全脑结构像采用3D快速磁化预备梯度回波序列(magnetization-prepared rapid acquisition gradient echo,MPRAGE),TR为2 530 ms,TE为2.98 ms,反转角7°,层厚1 mm,无间隔扫描,视野256 mm×256 mm,矩阵256×256,体素大小为1 mm×1 mm×1 mm,192层,扫描时间363 s。扩散张量成像采用平面回波成像序列(Echo-Planar Imaging sequence,EPI),TR为8 500 ms,TE为63 ms,视野224 mm×224 mm,矩阵112×112,层数为75,层厚2 mm,无层间隔,体素大小为2 mm×2 mm×2 mm,扩散梯度编码方向64个,扩散加权系数(b)为1 000 s/mm2,扫描时间10 min 56 s。
2.3 纤维束自动定量分析
采用FMRIB Software Library (FSL)对3D-T1加权图像进行配准和分割,将预处理的扩散张量图像和结构像采用AFQ软件进行分析[19]。该软件为MATLAB工具箱,可用于识别和量化每名被试脑中20条主要白质纤维束,包括双侧的丘脑放射束、扣带束扣带回、皮质脊髓束、扣带束海马回、额枕下束、下纵束、上纵束、弓形束、钩束以及胼胝体大小钳。纤维束识别和量化主要包括以下4个步骤:①重建每个被试全脑纤维束成像,所有纤维束使用确定性纤维束追踪成像进行跟踪;②使用自动兴趣区(Regions of Interest, ROI)方法将整个脑纤维组分割成束,ROI是基于先前的研究定义的,随后通过将束内的每根纤维与概率纤维束图谱进行比较来细化纤维束;③离散纤维束的清除,通过离散排除算法过滤掉偏离纤维中心的离散纤维;④计算沿纤维轨迹的扩散指标,将每根纤维束重新采样到100个等距的节点,获得每个节点的扩散指标。扩散指标选取FA、AD和RD以描述全脑白质状态。
2.4 统计分析
采用SPSS 22.0(IBM Corp.,Armonk,New York)软件的卡方检验或独立样本t检验分析运动员和非运动员在性别、年龄、身体质量指数(Body Mass Index,BMI)、训练(锻炼)年限、周训练(锻炼)时长和受教育年限上的差异。在AFQ分析中,对于每条纤维束首先提取其100个节点的扩散指标FA、MD和RD。采用双样本t检验对每条纤维束各节点的扩散值进行组间分析,扩散指标分析时将年龄、性别和BMI作为协变量进行控制。每条纤维束多重比较的次数为100,基于MATLAB 2015R采用FDR方法进行多重比较校正,P值为0.05。将组间差异显著的连续节点的扩散值进行平均,作为这一连续节点(节段)的平均扩散指标。
3 研究结果
3.1 人口统计学结果
运动员和非运动员在年龄、性别和受教育年限上均不存在显著差异。在训练(锻炼)年限和周训练(锻炼)时长上,运动员显著大于非运动员(表1)。此外,运动员的BMI显著小于非运动员,提示后续分析需将BMI作为协变量进行控制。

表 1 人口学变量的组间比较(M±SD)Table 1 Comparison of demographic variables between the groups
3.2 AFQ结果
对运动员和非运动员20条主要纤维束各节点水平FA、AD和RD等扩散指标进行双样本t检验(FDR校正,P<0.05)。结果显示:在FA上,胼胝体小钳的节点3—9和节点23—41,以及右侧钩束的节点1—51均存在显著差异;在RD上,胼胝体小钳的节点5—8和23—41以及右侧钩束的节点1—38均存在节点水平的差异;在AD上,所有主要纤维束的等分节点均不存在显著差异。将连续的差异显著节点定义为显著节段,计算节段内各节点的平均扩散值,并进行组间比较(表2)。

表 2 扩散指标组间差异显著的节段(M±SD)Table 2 Locations along the white matter tracts showed significant group differences in FA, RD and AD profiles
双样本t检验发现,运动员胼胝体小钳的前部节段(节点3—9)的FA值显著小于非运动员[t(57)=−2.75,P=0.008,Cohen'sd=−0.44],而在前中部节段(节点23—41)的FA显著大于非运动员[t(57)=4.94,P<0.001,Cohen'sd=0.88];运动员右侧钩束的前半部分节段(节点1—51)的FA显著小于非运动员[t(57)=−3.14,P=0.003,Cohen'sd=−0.67]。上述结果呈现于图1,其中(A)和(B)分别描述运动员和非运动员胼胝体小钳和右侧钩束各节点的FA,黑色虚线所指示的区域为组间差异显著的节点。图2为通过AFQ重建的胼胝体小钳(A)和右侧钩束(B)。
运动员胼胝体小钳的前部节段(节点5—8)的RD显著大于非运动员[t(57)=2.12,P=0.039,Cohen'sd=0.28],而在胼胝体小钳的前中部节段(节点23—41)的RD显 著 小 于 非 运 动 员[t(57)=−3.50,P<0.001,Cohen'sd=−0.57]。运动员右侧钩束的前部节段(节点1—38)的RD显著大于非运动员[t(57)=3.18,P=0.002,Cohen'sd=0.34]。上述结果呈现于图3,其中(A)和(B)分别描述运动员和非运动员胼胝体小钳和右侧钩束各节点的RD,黑色虚线所指示的区域为在RD上组间差异显著的节点。

图 1 运动员与非运动员在胼胝体小钳(A)和右侧钩束(B)各节点FA的组间比较Figure 1 The pointwise comparison of FA profiles between athletes and control groups in callosum forceps minor (A) and right uncinate (B)

图 2 AFQ重建的胼胝体小钳(A)和右侧钩束(B)Figure 2 Callosum forceps minor (A) and uncinate (B)reconstructed using AFQ
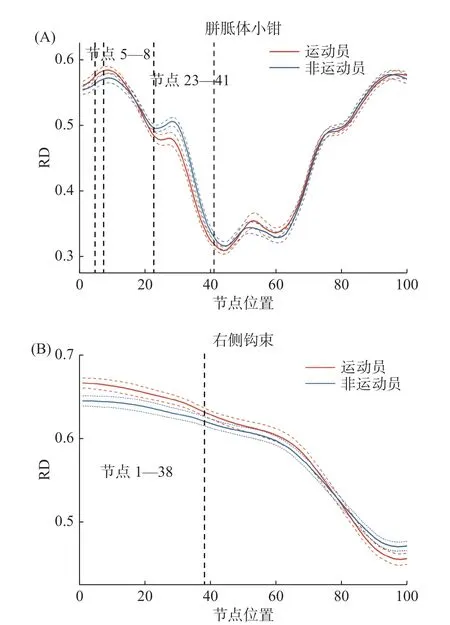
图 3 运动员与非运动员在胼胝体小钳(A)和右侧钩束(B)各节点RD的组间比较Figure 3 The pointwise comparison of RD profiles between athletes and control groups in callosum forceps minor (A) and right uncinate (B)
4 讨 论
本文发现运动员较非运动员在胼胝体小钳前中部节段的FA增高,而RD降低。纤维束此节段内FA的变化主要源于径向扩散率的改变,即在胼胝体小钳前部各向异性的增加是由于非轴向扩散的减小所致,提示运动员胼胝体小钳前部次要方向联系纤维较非运动员减少。运动员胼胝体小钳前部节段和右侧钩束部分节段的FA下降而RD升高,证明运动员这2条纤维束上述位置各向异性的下降是由于非轴向扩散增加所致,提示运动员纤维束这些节段次要方向联系纤维较非运动员增加。综上,耐力运动可能影响脑纤维束的微观结构,且这种影响具有一定的位置特异性。
胼胝体是最大的连合纤维,对左右半球间的协调活动具有重要作用。经过胼胝体膝部的纤维弯向前,连接两侧额叶的前部,称胼胝体小钳或胼胝体额钳。钩束连接额叶下部和颞叶前部皮层,该纤维束相对于其他纤维束在发育中成熟更晚,有着更大的结构可塑性[20]。本文在胼胝体小钳和右钩束发现了FA和RD的组间差异,结果支持“运动可强化脑特定纤维束”的观点。先前以其他类型运动员为对象的研究结果也提示了专业训练和脑特定纤维束FA间的相关性,如:Yao等[21]比较了25名国家级足球运动员和25名非运动员之间的脑白质结构差异,发现足球训练引起胼胝体FA增大;Toh等[11]采用确定性纤维追踪技术对14名年轻柔道运动员和7名同龄对照组的运动纤维束、胼胝体和上纵束进行重建,并通过参数分析获得扩散指标,发现柔道运动员内囊的FA增加18%,胼胝体膝部FA增加22%,胼胝体部FA增加13%,胼胝体压部FA增加16%,上纵束FA增加16%。此外,在其他非运动员群体中,体力活动或有氧训练和白质纤维FA值之间的正相关也间接提示运动强化纤维束完整性。如Yao等[22]发现,与同龄对照组相比,规律性太极拳锻炼者(平均锻炼年限8.45±5.1年,锻炼时长为1~15年)在胼胝体压部呈现更大的FA,且锻炼的年限越久、太极拳水平越高,胼胝体压部FA值越大。
训练后发生的FA变化被认为是反复进行某项运动或运动学习的结果,与个体在该活动项目上的行为改善有关[23−24]。耐力运动员胼胝体小钳前中部更高的FA可能与他们长期进行耐力训练引起的双侧下肢协调活动能力增加有关。胼胝体在左右半球间的协调活动具有重要作用。长跑和长距离竞走属于双侧肢体对称运动的周期性项目,运动过程要求左右半球持续、稳定地保持协同激活,促使双侧下肢肌肉保持长时间的协调运动,使个体能在保持平衡的前提下更快地完成向前的位移。双侧下肢肌肉运动的协调性是步态正常和个体保持平衡的重要保障。胼胝体FA也被证实与下肢平衡和步态控制功能有关[25–27],如Kim等[28]发现步态障碍患者多条受损的白质纤维束中胼胝体FA值与步态障碍的相关性最为显著。这一结果也得到了其他具有高协调要求项目研究结果的间接支持,如在柔道、足球和太极拳等高肢体协调的运动项目中也发现训练引起了胼胝体FA的升高[21−22,29]。
本文结果进一步提示,RD减小可能是专业运动员特定纤维束FA升高的原因。RD的减少一般解释为神经元轴突具有更高的髓鞘化程度[30]。受制于细胞和分子通路的测量技术,目前尚无直接证据证明运动可使人脑纤维束的髓鞘化程度更高,但动物实验为这种可能性提供了间接的证据。Jensen等[31]让脱髓鞘后的幼鼠立即进行14 d的跑轮活动发现,鼠髓磷脂碱性蛋白增加48%,髓鞘化的轴突密度增加了2.11倍,证明跑轮活动促进了幼鼠的髓鞘再生。Mandyam等[32]的动物实验也证明了长期运动可增强形成髓鞘的神经胶质细胞的生成。Chen等[33]对运动相关神经可塑性变化分子机制的研究结果进一步强化了此类间接证据的支撑力,他们发现:与对照组相比,连续21 d进行每天1 h跑步活动的小鼠,细胞层面的变化是少突胶质祖细胞的增殖和分化能力增强,进而促进了大脑内侧胼胝体轴突髓鞘化;分子层面的变化是脑源性神经营养因子(BDNF)表达的增强并激活了运动皮层雷帕霉素靶蛋白通路,而雷帕霉素靶蛋白通路的表达有效增长了运动组小鼠突触后致密物的长度和厚度,以及运动皮层第五层锥体神经元的兴奋性突触后电位的幅度,表明跑步运动有效促进了突触形成和皮层中突触的传递功能。已有研究[34−36]发现,人类长期运动训练增强BDNF、胰岛素样生长因子的表达和蛋白质水平。如Leckie等[34]发现,老年人进行为期1年有氧运动(步行)后血清中的BDNF浓度增加,推测运动强化了相关纤维束轴突的髓鞘化,其分子和细胞机制可能与神经营养因子调节的细胞水平的神经胶质生成、神经发生的增加有关。由于当前运动相关分子研究主要依赖动物模型,且分子间的作用机制尚不清晰,因此,对运动强化纤维束完整性潜在分子、细胞机制的解释尚待更多人类研究证据进一步验证。
本文发现胼胝体小钳前部和右侧钩束的FA降低主要由RD升高所引起。不少研究也发现了优秀运动员在特定纤维束上FA的下降,如:高水平高尔夫运动员比低水平高尔夫运动员和非运动员的内囊后肢有更低的FA[12];世界级体操运动员右侧钩束岛叶皮层部分以及上、下纵束和额枕下束的FA均显著低于非运动员[13,37]。相似地,体育运动对脑白质扩散性的这种影响也得到了部分运动干预研究的支持。虽然持续时间几个月的干预训练在运动总量和运动强度上难以匹配职业性训练,在对脑结构的可塑性影响上也不能完全等同于职业训练,但其结果也能在一定程度上说明运动的影响。Clark等[38]考察了有氧运动(骑自行车或跑步机训练)对25名57~86岁老年人白质微观结构的影响,发现经过6个月的训练后被试左侧钩束的FA下降。Xiong等[39]对听障儿童进行11周运动(跑步游戏、跳绳或武术)干预后,其胼胝体膝部FA降低,且脑白质完整性与抑制行为表现存在相关。
对于FA下降的生理意义,临床或亚临床研究[40−43]较为一致地认为是源于髓鞘化减少或轴向扩散率的增加,反映了纤维的损伤,多与生理或认知功能下降有关。如:原发性书写震颤患者额中回和壳核FA显著小于正常人[44];主观认知下降患者在包括双侧皮质脊髓束、上纵束、下纵束、额枕束、胼胝体大小钳、海马体、丘脑前辐射和小脑在内的广泛区域表现出FA降低[45]。FA的下降也可能和脑组织的其他特性有关,如交叉纤维数量和少突胶质细胞的增加,或是轴突直径和纤维密度的变化等,如研究发现直径较大的纤维束的FA较低[17]。目前的DTI技术尚难以明确分离出引起RD或AD变化的细胞层面的微结构变化原因。专业运动员或普通人运动干预后特定脑区白质或纤维束FA下降的生理意义目前尚无肯定性解释。结合本文研究结果推测,运动员FA的下降伴随着RD的增加而轴向扩散率没有变化是一种运动引起的适应性变化而非病理性损伤,更深层的原因可能和运动导致非轴向的髓鞘化完整性提高有关,也可能和运动引起树突棘的增加有关。Huang等[13]把观察到的优秀体操运动员双侧上、下纵束FA的降低解释为运动促进轴突直径增大引起的。Herting等[46]认为,运动性FA减少可能和长期有氧训练引起更多的轴突分支生长或胶质细胞数量增加有关。上述解释也得到动物模型研究的支持,如:Krityakiarana等[47]以nestin-GFP转基因小鼠作为研究对象,发现经过7 d跑轮运动,小鼠脊髓胸段少突胶质细胞的标志物NG2水平增高,提示自主运动提升了小鼠少突胶质细胞的数量;Ghiani等[48]发现与无运动对照组相比,经过7 d和28 d跑轮运动后的大鼠脊髓髓磷脂相关糖蛋白水平分别降低52%和62%,而抑制髓磷脂相关糖蛋白的表达促使更多的轴突分支生长。
本文还发现,同样的训练可能对不同位置的纤维束或同一纤维束的不同位置的扩散性产生不同影响,这可能与不同脑区有不同功能特点及运动训练对不同解剖亚区的影响不同有关[49]。先前也有研究发现了训练对纤维束影响的多样性,如:Yao等[22]发现,参与太极拳锻炼的老年人胼胝体压部的FA大于同龄对照组,而在胼胝体体部和膝部无显著差异;Fissler等[50]以高痴呆症风险老年人为对象发现,短期运动训练或生活方式与胼胝体膝部的白质微结构并无相关;Schmithorst等[51]发现自童年早期就接受音乐训练的成年人,胼胝体膝部的FA高于对照组,而放射冠和内囊的FA低于对照组。
本文也存在一定的局限性:①纤维追踪标准相对严格,部分被试的双侧弓状束和双侧皮质脊髓束因算法因素未能完成追踪,可能对数据的完整性有一定影响。②本文并未获得被试的认知表现结果,忽视了运动诱导的认知表现变化,今后可以进一步阐明训练诱导的脑结构、脑功能变化和认知变化之间的潜在关系。③DTI指标并不是特定神经生物学特性的特异性指标。其他组织特性,如胶质细胞数量和交叉纤维数量的增加可能会引起FA的降低。目前DTI技术尚不能区分上述机制的各自贡献,因此在解释健康人群DTI参数变化上的个体差异时应谨慎。
5 结 论
本文基于AFQ考察运动员和非运动员脑部主要纤维束白质完整性差异,并探索耐力训练引起的白质完整性变化的深层原因,发现长距离径赛运动员因耐力训练其胼胝体和右钩束部分节段的FA不同于非运动员,且FA的变化主要源于径向扩散率的改变。得出结论:耐力训练可能改变了脑白质微观结构,为体能型运动强化脑神经元间的纤维连接提供了依据。
作者贡献声明:
严世振:调研文献,分析数据,撰写论文;
王正光:采集数据,核实数据;
张琪涵:招募被试,采集、核实数据;
白学军:招募被试,核实数据;
金 花:设计论文框架,指导修改论文。

