672例抗肿瘤药物严重药品不良反应分析
江 彦,黄爱文
(中国人民解放军联勤保障部队第九〇〇医院临床药学科,福建 福州 350025)
严重药品不良反应(SADR)报告比例是衡量上报药品不良反应(ADR)总体质量和可利用性的重要指标。在临床用药中,SADR发生率较低,但严重危害患者的健康和生命安全,应引起医务工作者的重视。正常剂量下,抗肿瘤药物在抑制或杀伤肿瘤细胞的同时,也会不可避免地对正常细胞和组织产生损害。因而抗肿瘤药物比一般药物更易引起ADR,且发生率高,程度更严重,不仅对患者身心造成损害,也影响化学药物治疗(简称化疗)的效果和预后。因此,如何更安全、合理地应用抗肿瘤药物以达到最佳疗效,是临床关注的重点。本研究中对某三甲医院上报的672例抗肿瘤药物的SADR进行回顾性分析,并对程序性死亡蛋白1(PD-1)抑制剂和程序性死亡蛋白配体1(PD-L1)抑制剂的SADR进行分析,旨在探讨相应ADR的发生情况及其特点,为降低临床SADR发生率,预防或减少ADR的发生、促进合理用药和风险防范提供参考。
1 资料与方法
通过ADR监测管理系统提取某三甲医院2017年1月1日至2021年7月1日上报的SADR报告1 217份,选取其中672份抗肿瘤药物引起的SADR,参照国家药品不良反应监测中心分类评价方法,利用Excel软件统计患者的年龄、给药途径、转归、累及系统/器官和临床表现、药品分类、发生例数排名前10位的药品及PD-1和PD-L1抑制剂引起的SADR等数据并分析。药品分类方法主要参照2020年版《中国国家处方集》,ADR累及系统/器官及主要临床表现采用《WHO药品不良反应术语集》定义。
2 结果
2.1 性别与年龄
672例SADR中,男243例(36.16%),女429例(63.84%),比例为1∶1.77;年龄11~93岁,多发于41~70岁(80.36%)患者。患者性别与年龄分布见表1。
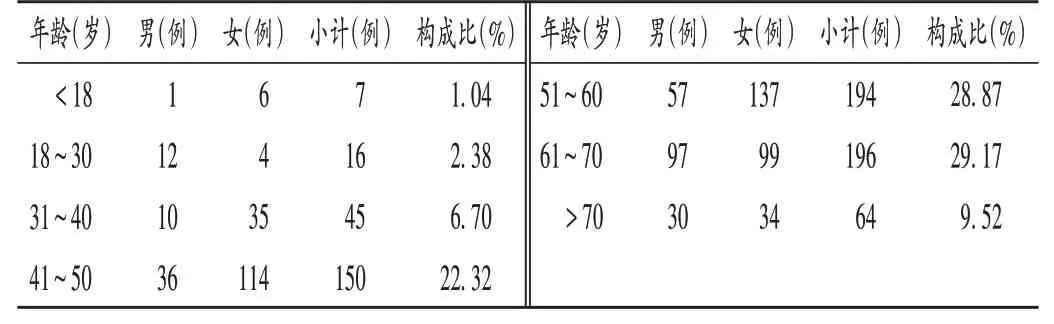
表1 SADR患者的性别与年龄分布(n=672)Tab.1 Distribution of gender and age of patients with SADR(n=672)
2.2 转归
绝大部分(92.41%)患者予以停药、吸氧、抗过敏和减慢滴速等对症处理后,SADR逐渐缓解,严重程度降为最轻(包括痊愈或好转)。详见表2。
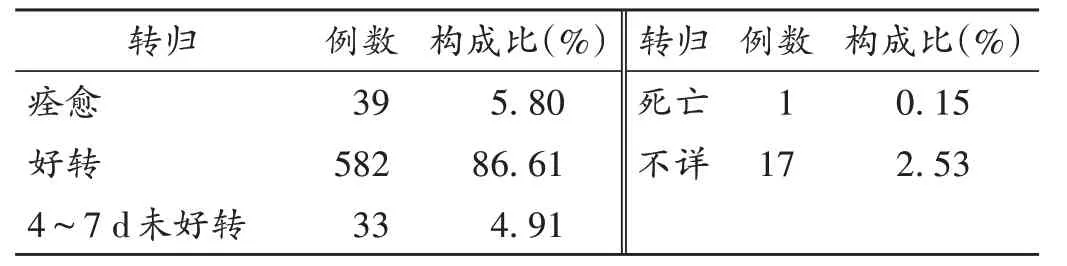
表2 SADR患者的转归情况(n=672)Tab.2 Outcomes of patients with SADR(n=672)
2.3 给药途径
672例SADR中,给药途径多为静脉滴注(88.99%),其次为口服(9.82%)。详见表3。

表3 SADR患者的给药途径(n=672)Tab.3 Administration route in patients with SADR(n=672)
2.4 累及系统/器官及主要临床表现
672例SADR中,累及血液系统的例数(500例,74.40%)远多于其他系统/器官。详见表4。
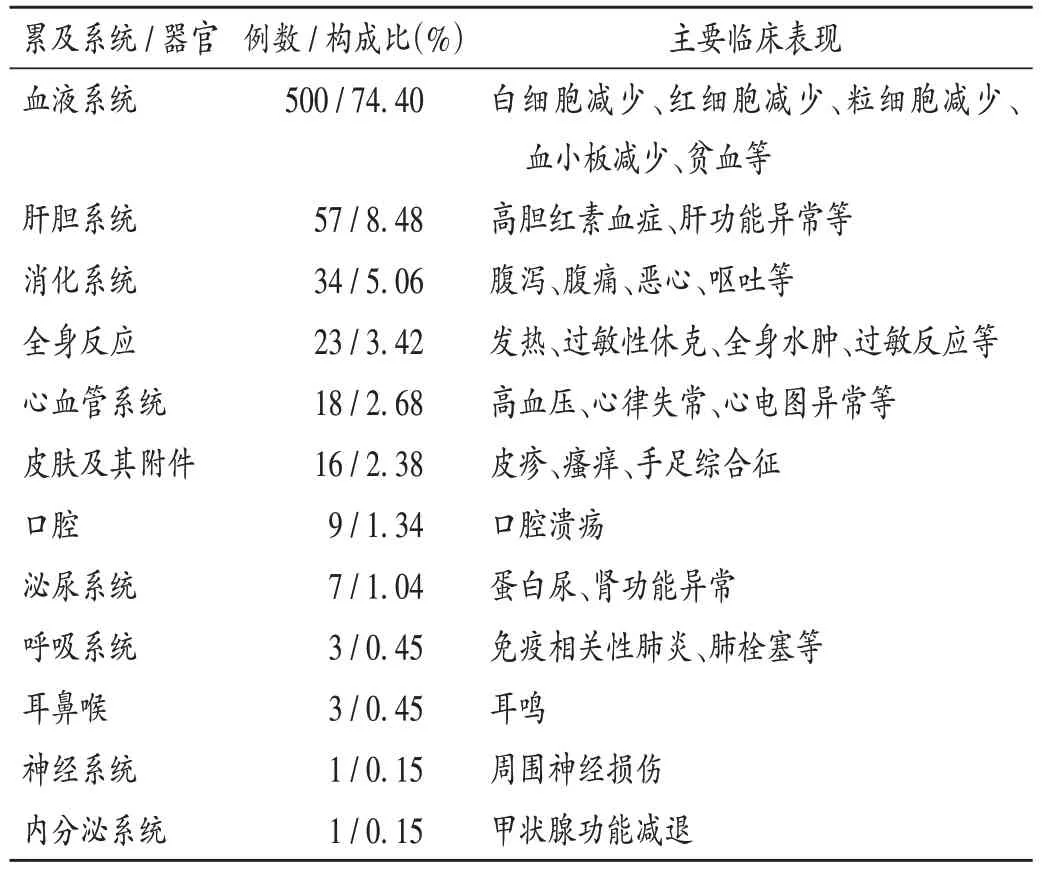
表4 SADR累及系统/器官及主要临床表现(n=672)Tab.4 Systems/organs involved in SADR and their main clinical manifestations(n=672)
2.5 抗肿瘤药物类别
共涉及7大类抗肿瘤药物,51种药品。引起SADR例数最多的药物类别是作用于脱氧核糖核酸(DNA)分子结构的药物(36.76%),其次是影响蛋白质合成和干扰有丝分裂的药物(29.46%),再次为影响核酸合成的药物(18.01%);单药以多西他赛(21.28%)较多见。详见表5。

表5 引起SADR的药物及类别(n=672)Tab.5 Drugs inducing SADR and their categories(n=672)
2.6 PD-1和PD-L1抑制剂
使用PD-1和PD-L1抑制剂后,共发生ADR 13例,其中SADR 6例(46.15%),详见表6。其中帕博利珠单抗、信迪利单抗和特瑞普利单抗均为2018年上市,而卡瑞利珠单抗为2019年上市。PD-1和PD-L1抑制剂在国内的上市时间较短,现用药品说明书相较于国内外发布的治疗指南及信息有一定滞后,故这两类药物的用药监护和ADR上报存在一定不足。

表6 PD-1和PD-L1抑制剂SADR发生例数及其临床表现Tab.6 Cases of SADR induced by PD-1/PD-L1 inhibitors and their clinical manifestations
2.7 较常发生SADR的抗肿瘤药品及其临床表现
发生SADR例数排名前10的抗肿瘤药品分布情况见表7。其中排名前3的药品分别为多西他赛、表柔比星和吉西他滨。SADR的临床表现主要为骨髓抑制,其次是肝功能异常和过敏反应等。

表7 SADR发生例数排名前10的药品分布Tab.7 Distribution of drugs with the top 10 cases of SADR
3 讨论
3.1 相关因素
患者性别与年龄:中老年人是发生抗肿瘤药物SADR的高风险人群。本研究结果显示,SADR患者年龄以40岁以上居多,尤其是61~70岁(29.16%);同时,患者多为女性。中老年人随着年龄的增长,身体机能随之下降,肝肾功能、药物代谢及排泄功能减退,大多还伴有其他疾病或并发症,用药品种多且复杂,因此发生SADR的概率和程度相对高于其他年龄段。女性的体质量相对男性较轻,在相同给药剂量的作用下,药效强度可能较男性大,故其SADR发生率相对较高。儿童发生SADR的比例相对较低(年龄最小为11岁),但也不容忽视[1]。临床应特别关注中老年及儿童患者等特殊人群的用药情况,结合患者的年龄、原患疾病和体质等综合考虑治疗方案,实行个体化给药治疗,尽量减少SADR的发生。
给药途径:本研究中近90%抗肿瘤药物SADR的给药方式为静脉滴注。静脉滴注为抗肿瘤药物最常用的给药方式,可避免肝脏首过效应,直接进入血液系统,因此受药物的浓度、pH、渗透压、溶液内的微粒等因素影响,较口服给药更易引起ADR的发生[2]。此外,药物相互作用、滴注速度和配伍禁忌等也是静脉给药更易发生ADR的因素。因此,临床治疗前应详细询问患者的药物过敏史,优先选择口服给药,必须静脉给药时应尽量减少联合用药的种类,对患有心脑血管疾病的患者和老年患者应适当降低滴速,加强用药监护,同时还应加强对医务人员及患者的用药安全培训,进一步加强临床合理用药水平[3]。
累及系统/器官及主要临床表现:血液系统SADR最常见,其在一定程度上会影响患者的疗效和生活质量。一旦出现SADR,需立即减少给药剂量或停药,并给予对症处理。除骨髓造血干细胞外,皮肤、消化道黏膜等器官或组织的细胞更新亦较快,易受到化疗药物的影响[4]。其中消化系统的ADR以恶心、呕吐为主要表现,严重时会导致脱水、体质量减轻和电解质失调等,不仅给患者的治疗带来痛苦,也会降低其依从性,在治疗过程中,医务人员除加强敏感人群治疗过程的用药监测外,还需结合患者的实际情况,对用药方案进行调整。同时,随着肿瘤靶向治疗不断深入研究,将会尽可能地减少对人体正常组织的损伤,选择性作用于肿瘤细胞,最大限度发挥抗肿瘤效应[5-6]。
3.2 发生SADR的具体药品
不同类别抗肿瘤药物的作用机制表明,影响蛋白质合成和干扰有丝分裂的药物导致骨髓抑制的发生率明显高于作用于DNA分子结构的药物、拓扑异构酶抑制药物等其他类别。产生严重骨髓抑制ADR率占比最高的药物是多西他赛,血液系统毒性是其最主要的剂量限制性毒性[7-8]。已有研究表明,多西他赛在各类恶性肿瘤化疗方案中使用广泛,其在杀伤肿瘤细胞的同时还损伤了正常的淋巴及血液细胞,因此引发ADR的比例也相对较高,该类药品受剂量、药物相互作用和机体状态等多种因素影响[7]。因此,在临床使用中要注意结合患者个体差异,及时预防此类药品SADR的发生。
3.3 发生SADR的PD-1和PD-L1抑制剂
肿瘤免疫疗法不同于传统治疗,它是通过自身的免疫系统来杀伤肿瘤,在大多数情况下,免疫治疗相关ADR较轻。但免疫治疗在过度激活T细胞抗肿瘤的同时,也打破了正常免疫系统的稳定,过度免疫导致免疫耐受紊乱,从而发生免疫相关不良事件(irAE)[8-9]。PD-1和PD-L1抑制剂常引起皮肤、肝、胃肠道、肺和血液系统等的ADR,以皮肤ADR最常见,而心脏ADR是irAE中罕见并致命的。与靶向药物比较,PD-1和PD-L1抑制剂引起的输注反应较少见,发生症状多表现为发热、寒战等,可根据病情进行对症治疗。irAE通常初发于PD-1和PD-L1抑制剂治疗开始后的几周到几个月内,大部分是耐受及可逆的,通常发生在对免疫检查点抑制剂反应良好的患者中,虽然SADR的发生率较低,但一旦出现,会导致患者的生活质量降低,甚至导致患者免疫抑制剂治疗中断,生存期缩短,甚至直接致死,故及时有效的irAE治疗非常重要[10-13]。
3.4 建议
随着抗肿瘤药物不断更新,特别是靶向药物的层出不穷,了解其SADR的机制及因素,对于预防SADR,保障用药安全意义重大。在临床治疗中,当怀疑为ADR时,首先停用可疑药物,一旦明确判断为ADR,应立即采取措施,及时对患者进行对因、对症治疗。ADR监测离不开临床医师、护士和药师的互相协作和配合,通过加强主动监测,可减少ADR的发生,减轻患者的痛苦和经济负担,保障用药安全,从而提高医院的医疗质量。

