circRNA_0128846 靶向miR-1183 介导人非小细胞肺癌细胞放射抵抗的研究
陆滢 邓鑫州 宋仕茂 骆志国
湖北医药学院附属太和医院肿瘤防治中心,十堰 442099
肺癌是全球范围内最常见的恶性肿瘤之一,严重影响人类健康[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%[2]。放疗是其主要的非手术治疗方法,但放射抵抗往往会导致局部肿瘤复发和预后不良[3-4],目前尚无逆转NSCLC放射抵抗的有效靶点,亟需探究。
环状RNA(circular RNA,circRNA)是一类在真核生物中广泛表达的环状非编码RNA,其由mRNA 前体通过反向剪接产生。不同于其他线性非编码RNA,circRNA 不具备5′端帽和3′端尾结构,对核酸外切酶具有抵抗性,故circRNA 极具稳定性[5-6]。2011 年,Salmena 等[7]提出,circRNA 具有微小RNA(microRNA,miRNA)反应元件,可作为竞争性内源性RNA 海绵吸附并抑制miRNA,从而改变细胞的基因表达。circRNA 还可以通过结合RNA 结合蛋白、调节基因转录等方式来发挥作用,故其可参与基因转录、转录后调控、细胞内RNA调控网络及蛋白质翻译等生理过程,进而影响细胞周期进程、细胞衰老和凋亡等多种生物学过程[8]。
研究结果证实,circRNA 在肺癌、胃癌、膀胱癌和乳腺癌等多种肿瘤中表达异常,其参与调控肿瘤细胞增殖、侵袭和转移等多种生物学过程,因此circRNA 被认为是一种潜在的肿瘤生物标志物及治疗靶点[9]。Wang 等[10]发现,circRNA_0008305可诱导NSCLC 细胞发生上皮间充质转化,进而促进肺癌转移。circRNA_0000199 通过抑制miR-198上调磷脂酰肌醇-3 激酶调节亚基1,以此增强胃癌细胞对铂类药物的耐药性[11]。另有研究结果证实,circRNA 可能参与肿瘤的放射抵抗过程[12]。Ma 等[13]发现,circRNA_0122683 在食管癌组织中高表达,其通过调控miR-186-5p/腺苷二磷酸核糖聚合酶9(PARP9)轴调控细胞恶性程度并促进放射抵抗。circRNA_100367 通过吸附miR-217 增强食管癌细胞的放射抗性[14]。目前,针对circRNA 与NSCLC细胞放射敏感性关系的研究尚不多见,circRNA_0128846 对NSCLC 细胞放射敏感性的影响不清楚。本研究探讨circRNA_0128846 对人NSCLC 细胞放射敏感性的调控作用及分子机制,以期为解决临床NSCLC 放射抵抗问题提供潜在的治疗靶点。
1 材料与方法
1.1 主要材料与仪器
人支气管上皮细胞Beas-2B、人NSCLC 细胞A549、H460、H1299、H1975 和人胚肾细胞293T均购自中国科学院上海生命科学研究院细胞资源中心,培养代次为10。DMEM 培养基、DMEM/F12培养基、DMEM 高糖培养基、胎牛血清、0.25%胰蛋白酶(不含EDTA)、0.25%胰蛋白酶、表皮细胞生长因子、β-成纤维细胞生长因子、2% B27 添加物均购自美国Gibco 公司;青霉素和链霉素均购自浙江吉诺生物医药技术有限公司;Lipofectamine3000、Trizol 试剂均购自美国Invitrogen 公司;SYBR Green PCR 试剂盒购自日本Takara 公司;RIPA 裂解液购自北京普利莱基因技术有限公司;CCK-8 试剂盒、RNA 反转录试剂盒均购自上海碧云天生物技术有限公司;miR-1183 抑制剂、miR-1183 模拟物及阴性对照均购自苏州吉玛基因股份有限公司。NanoDrop2000 分光光度计、酶联免疫分析仪均购自美国Thermo 公司;X-RAD 320 直线加速器购自美国North Branford 公司。质粒(LUC)购自上海和元生物技术股份有限公司;引物购自广州生工生物工程股份有限公司。双荧光素酶报告基因分析系统购自美国Promega 公司。
1.2 细胞培养及照射
人支气管上皮细胞Beas-2B 和人NSCLC 细胞A549、H460、H1299、H1975 分别培养于含10%胎牛血清、100 U/ml 青霉素、100 g/ml 链霉素的DMEM 培养基中;人胚肾细胞293T 培养于含10%胎牛血清的DMEM 高糖培养基中,培养条件均为37℃、5% CO2。放射抵抗细胞系是本实验室前期经分割辐射(2 Gy×30 次)诱导而成的,已建立具有稳定放射抵抗能力的人NSCLC 细胞A549(命名为A549R),并每2 周给予低剂量(2 Gy)照射以维持细胞的辐射抗性,照射条件为6 MV X 射线,剂量率为4 Gy/min。
1.3 目标circRNA、miRNA 的筛选
在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo)中下载微阵列数据集GSE101684,筛选出在4 对癌组织与癌旁正常组织中差异表达最显著的10 种circRNA[筛选标准为log2FC(折叠变化)≥1.5,且P<0.05],选择在亲本细胞和放射抵抗细胞中表达差异最显著的circRNA 作为目标circRNA。利用人类环状RNA 数据库(http://www.circbank.cn)和circinteractome 数据库(https://circinteractome.nia.nih.gov)预测目标circRNA 下游的miRNA,筛选出沉默目标circRNA 后,表达水平上升最显著的miRNA作为目标miRNA。
1.4 细胞转染
将人NSCLC 细胞A549、A549R 接种于6 孔培养板中(1×105个/孔),培养至50%~70%融合度后转染,转染操作按照Lipofectamine3000 说明书进行。对A549R 细胞进行转染,目标circRNA 沉默载体为pLKD-CMV-G&PR-U6-shRNA,干扰序列为5′-TCCAAGCTGGCCAGCAGCCAGC-3′;对A549细胞进行转染,目标circRNA 过表达载体为pIREShrGFP-1a,目标circRNA 过表达序列见“http://www.circbank.cn/search.html?selectValue=has_circ_01288 46”。使用miRNA 抑制剂转染A549 细胞以实现miRNA 沉默;使用miRNA 模拟物转染A549R 细胞以实现miRNA 过表达,转染对照组均为空载体。
1.5 细胞克隆形成实验
将转染后24 h 的人NSCLC 细胞A549、A549R各分为3 组进行照射,照射剂量分别为0、4、8 Gy,照射后将细胞接种于6 孔低吸附培养板中(1×104个/孔),使用DMEM/F12 无血清培养基培养,培养基中加入50 ng/ml 表皮细胞生长因子、10 ng/ml β-成纤维细胞生长因子和2% B27 添加物。培养7 d 后在显微镜下拍照分析,以细胞克隆最大径>20 μm为判定标准,统计细胞克隆形成率(细胞克隆形成率=细胞克隆数/细胞总数×100%)[15]。
1.6 荧光实时定量( fluorescence real-time quantitative,qRT)PCR
使用Trizol 试剂从细胞中提取总RNA,使用NanoDrop2000 分光光度计检测纯化的总RNA 的质量和浓度。按照RNA 反转录试剂盒说明书提取RNA,并进行反转录合成互补DNA(cDNA)。采用SYBR Green PCR 试剂盒检测细胞中在人NSCLC癌组织与配对的癌旁正常组织中差异表达的10 种circRNA 以及可能与目标circRNA 结合的miRNA的表达水平,操作按照说明书进行。以甘油醛-3-磷酸脱氢酶(GADPH)作为目标circRNA 的参考基因,U6 作为目标miRNA 的参考miRNA。PCR 反应条件:94℃预变性1 min,94℃变性10 s,60℃退火30 s,72℃延伸30 s,40 个循环。引物序列如表1 所示。

表1 荧光实时定量聚合酶链反应的引物序列Table 1 Primers sequences used in fluorescence real-time quantitative polymerase chain reaction
1.7 双荧光素酶报告基因的分析
质粒在荧光素酶基因启动子(LUC-目标circRNA)下游插入序列5′-CUUACAGUAC-3′(目标circRNA 中miRNA 的潜在结合序列)。将293T细胞接种于24 孔培养板中(5×104个/孔),将LUC-目标circRNA 与miRNA 模拟物或miRNA 阴性对照共转染293T 细胞,48 h 后裂解细胞,使用双荧光素酶报告基因分析系统测定荧光素酶活性。
1.8 统计学分析
应用SPSS 23.0 软件、GraphPad Prism 7.0 软件进行统计学分析。符合正态分布的计量资料以±s表示,2 组间数据的比较采用独立样本t检验(方差齐)。P<0.05 为差异有统计学意义。
2 结果
2.1 circRNA_0128846 高表达对人NSCLC 细胞放射抵抗的影响
由图1A 可见,经GEO 数据库微阵列数据集GSE101684(包括4 对癌组织与配对的癌旁正常组织)筛选,在人NSCLC 癌组织中表达上调的前10 种circRNA 分别为circRNA_0116061、circRNA_0116961、circRNA_0106711、circRNA_0106714、circRNA_0128846、circRNA_0094088、circRNA_0046264、circRNA_0096041、circRNA_0096042 和circRNA_0096049。qRT-PCR 结果显示,上述10 种circRNA 中,circRNA_0116961、circRNA_0106714、circRNA_0128846 和circRNA_0046264 在A549R 细胞中的相对表达水平均高于A549 细胞(均P<0.05),其中circRNA_0128846表达差异最显著(图1B)。故本研究选择circRNA_0128846 作为目标circRNA。qRT-PCR 检测circRNA_0128846 在正常人支气管上皮细胞Beas-2B 以及人NSCLC细胞A549、H460、H1299、H1975中的相对表达水平,结果显示,circRNA_0128846 在A549、H460、H1299、H1975 细胞中的相对表达水平均高于Beas-2B 细胞(均P<0.01,图1C)。以上4 株人NSCLC细胞的克隆形成实验结果显示,经0、4、8 Gy 的X 射线照射后,随着circRNA_0128846 表达水平的升高,4 株人NSCLC 细胞的克隆形成能力逐渐增强(图2),这提示circRNA_0128846 的高表达可能与人NSCLC 细胞的放射抵抗呈正相关。
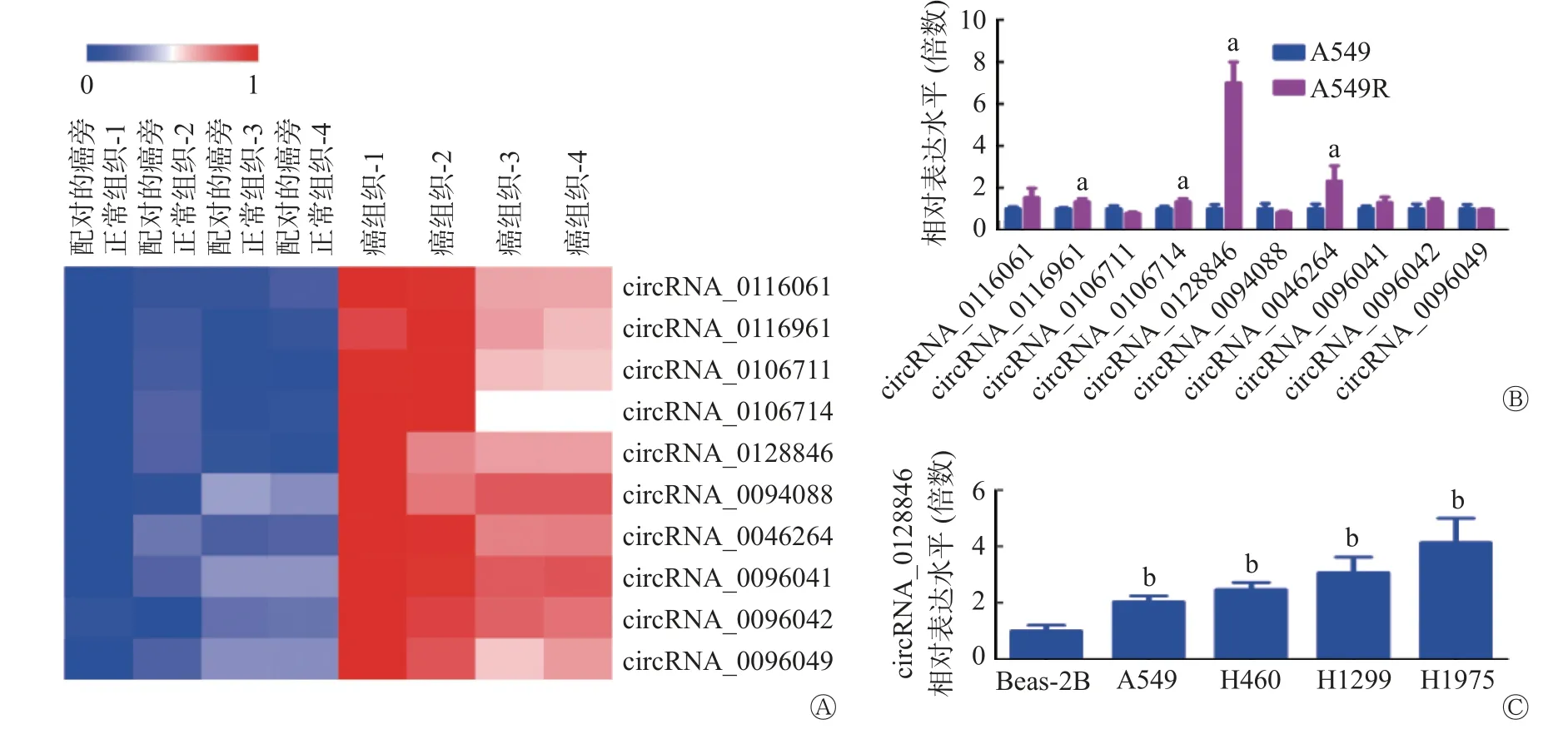
图1 筛选目标circRNA 并检测其在正常人支气管上皮细胞Beas-2B 及人非小细胞肺癌细胞A549、H460、H1299、H1975 中的表达情况 A 为以log2FC(折叠变化)≥1.5,且P<0.05 为筛选标准,经GEO 数据库微阵列数据集GSE101684 筛选在4 对人NSCLC 癌组织与配对的癌旁正常组织中差异表达的circRNA 的热图,红色、蓝色条带分别表示高表达、低表达;B 为qRT-PCR 检测A549 细胞及其放射抵抗细胞(A549R)中10 种circRNA 的相对表达水平;C 为circRNA_0128846 的相对表达水平。a 表示与A549 细胞相比,差异均有统计学意义(t=3.592、2.972、10.000、2.997,P=0.023、0.041、0.001、0.040);b 表示与Beas-2B 细胞相比,差异均有统计学意义(t=6.200、7.903、6.010、6.132,P=0.003、0.001、0.004、0.004)。circRNA 为环状RNA;qRT-PCR 为荧光实时定量聚合酶链反应Figure 1 Screening target circRNA and detecting its expression in normal human bronchial epithelial cell Beas-2B and human non-small cell lung cancer cell A549, H460, H1299, H1975
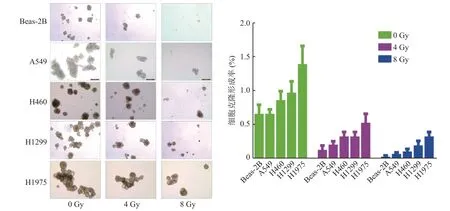
图2 不同剂量X 射线照射后正常人支气管上皮细胞Beas-2B 和人非小细胞肺癌细胞A549、H460、H1299、H1975 的克隆形成情况(×200)Figure 2 Clone formation in normal human bronchial epithelial cells Beas-2B and human non-small cell lung cancer cell A549, H460, H1299,H1975 after irradiation with different doses of X-ray radiation (×200)
2.2 circRNA_0128846 对人NSCLC细胞放射抵抗的影响
细胞克隆形成实验结果显示,在4、8 Gy X 射线的照射下,A549R细胞的辐射抗性显著高于亲本A549细胞(均P<0.05,图3)。qRT-PCR检测结果表明,在A549 细胞中成功过表达了circRNA_0128846(图4A),与对照组相比,过表达circRNA_0128846 显著增强了A549细胞的克隆形成能力(0.22%对0.45%,图4B);在A549R 细胞中成功沉默了circRNA_0128846(图5A),与对照组相比,沉默circRNA_0128846 显著降低了A549R 细胞的克隆形成能力(0.23%对0.10%,图5B),该结果提示circRNA_0128846 能够促进人NSCLC 细胞的放射抵抗。

图3 不同剂量X 射线照射后人非小细胞肺癌细胞A549 及其放射抵抗细胞(A549R)的克隆形成情况(×200) a 表示与A549 细胞相比,差异均有统计学意义(t=4.427、3.479,P=0.011、0.025)Figure 3 Clone formation in human non-small cell lung cancer cell A549 and its radioresistant cell A549R after irradiation with different doses of X-ray radiation (×200)
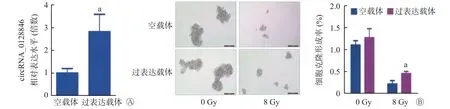
图4 circRNA_0128846 过表达载体转染人非小细胞肺癌细胞A549 48 h 后的相对表达水平(A)及8 Gy X 射线照射后的克隆形成能力(B,×200) a 表示与空载体相比,差异均有统计学意义(t=4.022、4.427,P=0.016、0.011)。 circRNA 为环状RNAFigure 4 Relative expression level of circRNA_0128846 overexpression vector transfected human non-small cell lung cancer cell A549 for 48 h (A) and clone formation ability after 8 Gy X-ray irradiation (B, ×200)

图5 circRNA_0128846 沉默载体转染人非小细胞肺癌细胞A549 的放射抵抗细胞(A549R) 48 h 后的相对表达水平(A)及8 Gy X 射线照射后的克隆形成能力(B,×200) a 表示与空载体相比,差异均有统计学意义(t=6.002、3.780,P=0.004、0.019)。 circRNA 为环状RNAFigure 5 Relative expression level of circRNA_0128846 silencing vector transfected the radioresistant cell (A549R) of human non-small cell lung cancer cell A549 for 48 h (A) and clone formation ability after 8 Gy X-ray irradiation (B, ×200)
2.3 与circRNA_0128846 结 合 的miRNA
在circinteractome 数据库和人类环状RNA 数据库中取交集得到9 种可能与circRNA_0128846 结合的潜在miRNA。qRT-PCR 检测A549R 细胞中circRNA_0128846 沉默后各miRNA 的表达,结果显示,沉默circRNA_0128846 可上调miR-1183 和miR-1827 的表达(t=5.095、3.464,P=0.007、0.026),其中miR-1183 表达上调最显著,该结果提示circRNA_0128846 可能与miR-1183 结合,并下调其表达。采用生物信息学预测circRNA_0128846 与miR-1183 潜在的结合位点如图6 所示。qRT-PCR 检测结果表明,在A549细胞中过表达circRNA_0128846 可显著下调miR-1183 的表达(t=6.002,P=0.004)。在人胚肾293T细胞中进行双荧光素酶报告基因分析的结果显示,过表达miR-1183 可显著降低circRNA_0128846 的表达(t=4.562,P=0.010),这提示miR-1183 可以与circRNA_0128846 结合并下调其表达。经qRTPCR 验证,miR-1183 在A549R 细胞中的表达水平显著低于A549 细胞(t=6.025,P=0.004),这提示miR-1183 可能与人NSCLC 细胞的放射抵抗有关。

图6 生物信息学预测circRNA_0128846 与miR-1183 的结合位点 circRNA 为环状RNA;miR 为微小RNAFigure 6 Bioinformatics prediction of the binding site of circRNA_0128846 and miR-1183
2.4 circRNA_0128846 靶向miR-1183 的放射抵抗
经qRT-PCR 验证,使用miR-1183 抑制剂成功对A549 细胞进行了miR-1183 沉默,沉默miR-1183 显著增强了8 Gy X 射线照射后A549 细胞的克隆形成能力(0.21%对0.31%,图7);同时,使用miR-1183 模拟物成功对A549R 细胞进行了miR-1183 过表达,过表达miR-1183 显著降低了8 Gy X射线照射后A549R 细胞的克隆形成能力(0.26%对0.15%,图8),这提示miR-1183 可抑制人NSCLC细胞的放射抵抗。过表达circRNA_0128846 可显著增强8 Gy X 射线照射后A549 细胞的克隆形成能力(P<0.01),而过表达miR-1183 逆转了circRNA_0128846 诱导的放射抵抗(1.90%对1.20%,图9),这表明circRNA_0128846 可以通过介导miR-1183促进人NSCLC 细胞的放射抵抗。
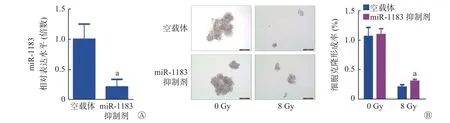
图7 miR-1183 抑制剂转染人非小细胞肺癌细胞A549 48 h 后的相对表达水平(A)及8 Gy X 射线照射后的克隆形成能力(B,×200)a 表示与空载体相比,差异均有统计学意义(t=4.848、3.293,P=0.008、0.030)。miR 为微小RNAFigure 7 Relative expression level of miR-1183 inhibitor transfected human non-small cell lung cancer cell A549 for 48 h (A) and clone formation ability after 8 Gy X-ray irradiation (B, ×200)
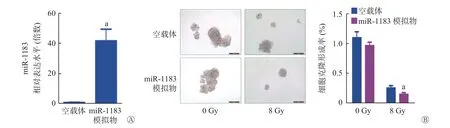
图8 miR-1183 模拟物转染人非小细胞肺癌细胞A549 的放射抵抗细胞(A549R) 48 h 后的相对表达水平(A)及8 Gy X 射线照射后的克隆形成能力(B,×200) a 表示与空载体相比,差异均有统计学意义(t=9.219、3.671,P=0.001、0.021)。 miR 为微小RNAFigure 8 Relative expression level of miR-1183 mimic transfected the radioresistant cell (A549R) of human non-small cell lung cancer cell A549 for 48 h (A) and clone formation ability after 8 Gy X-ray irradiation (B, ×200)
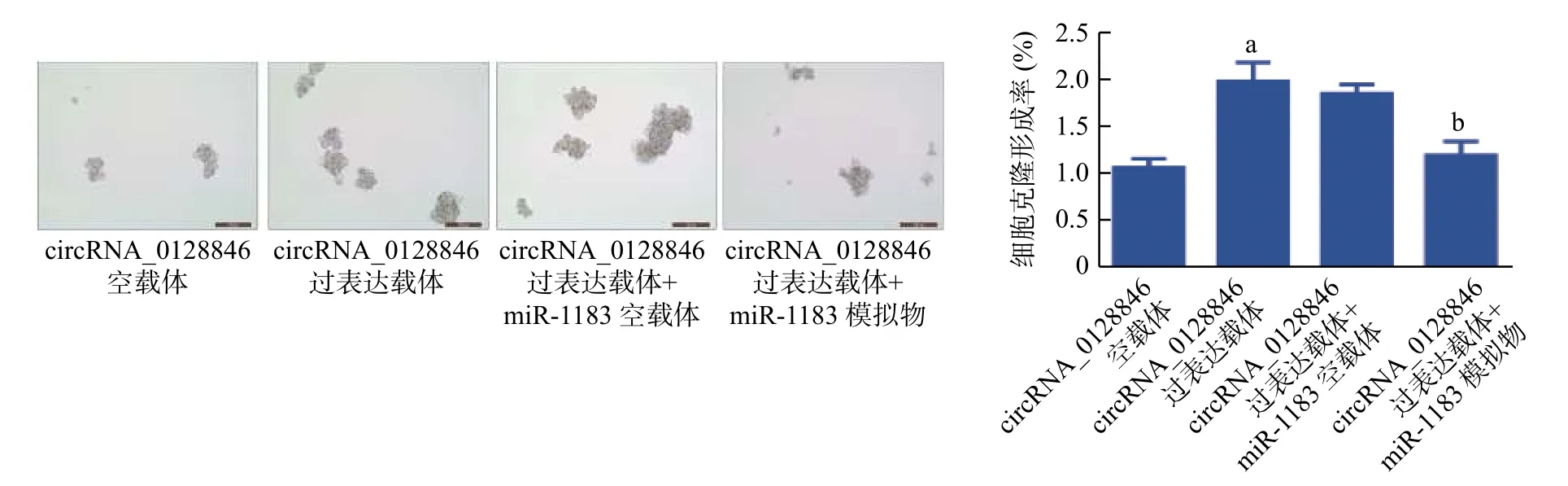
图9 人非小细胞肺癌细胞A549 过表达circRNA_0128846 和miR-1183 后的克隆形成能力(×200) a 表示与circRNA_0128846 空载体相比,差异有统计学意义(t=7.000,P=0.002);b 表示与circRNA_0128846 过表达载体+miR-1183 空载体相比,差异有统计学意义(t=6.325,P=0.003)。circRNA 为环状RNA; miR 为微小RNAFigure 9 Clonal formation ability of human non-small cell lung cancer cell A549 after overexpression of circRNA_0128846 and miR-1183(×200)
3 讨论
越来越多的研究结果表明,circRNA 在许多恶性肿瘤的发生发展中起着关键的调节作用[16]。随着高通量测序及先进的生物信息学技术的发展,许多circRNA 被鉴定出来,这使得circRNA 与肿瘤的关系比以往更受关注。circRNA 的异常表达已被证实与NSCLC 的进展有关,如circRNA_100876在NSCLC 组织中的表达水平明显高于邻近的非肿瘤组织,circRNA_100876 的表达上调与NSCLC患者的淋巴结转移和肿瘤分期有关[17]。此外,circRNA_100876 表达水平较高的NSCLC 患者的总生存时间明显短于circRNA_100876 表达水平较低的NSCLC 患者[17],故某些circRNA 对NSCLC的发生、发展及诊断治疗可能有重大意义。目前,关于circRNA_0128846 与肿瘤的关系仅有1 篇文献报道,其研究结果显示,circRNA_0128846 在结直肠癌组织中的表达水平显著高于正常组织,circRNA_0128846 通过下调miR-1184 的表达来增加LIM 结构域蛋白(AJUBA)的表达,使得Hippo/Yes 相关蛋白(YAP)通路信号失活,从而促进结直肠癌的发生[18]。在本研究中,我们通过生物信息学分析发现circRNA_0128846 在人NSCLC 细胞中显著高表达。
目前,关于circRNA 与肿瘤放射敏感性关系的报道还不多见。研究结果表明,circZNF609 在前列腺癌组织和细胞系中异常上调,其通过调控miR-501-3p/已糖激酶2(HK2)轴促进糖酵解代谢,从而增强前列腺癌细胞的放射抵抗[19]。circ_0086720 通过靶向miR-375/纺锤体蛋白1(SPIN1)轴促进NSCLC 放射抵抗[20]。下调circ_CCNB2 可抑制miR-30b-5p/驱动蛋白家族成员18A(KIF18A)轴介导的细胞自噬,增强前列腺癌细胞的放射敏感性[21]。在本研究中,我们发现circRNA_0128846在人NSCLC 放射抵抗细胞中显著高表达,沉默circRNA_0128846 能显著增强人NSCLC 细胞的放射敏感性,过表达circRNA_0128846 能显著降低人NSCLC 细胞的放射敏感性,circRNA_0128846 可作用于miR-1183,促进人NSCLC 细胞的放射抵抗。
circRNA 发挥生物学功能的重要途径之一就是作为分子海绵吸附miRNA。大量研究结果证实miRNA 参与炎症[22]、心脏病[23]、肿瘤[24]等多种疾病的发生、发展。目前,关于miR-1183 的研究还较少。miR-1183 可通过调控B 细胞淋巴瘤基因2(Bcl2)的表达参与风湿性心脏病的发生、发展过程[25]。在肿瘤中,miR-1183 是circRNA_0073239和circRNA_0005273 调控肿瘤细胞增殖、迁移、糖酵解的重要下游靶标[26-28]。Zhu 等[26]的研究结果表明,miR-1183 是circRNA_0073239 介导胶质瘤放射抵抗的下游靶标。本研究通过人类环状RNA 数据库和circinteractome 数据库预测并验证了circRNA_0128846 的下游靶标miR-1183,并发现其可能是circRNA_0128846 介导人NSCLC 细胞放射抵抗的重要靶标。我们发现,通过过表达miR-1183 显著增强了人NSCLC 细胞的放射敏感性,而沉默miR-1183 显著降低了人NSCLC 细胞的放射敏感性。
关于miR-1183 下游靶标的研究不多,B 细胞淋巴癌基因2(Bcl2)和磷脂酰肌醇依赖性激酶1(pPDPK1)是miR-1183 的下游靶标。在前期,我们通过TargetScan 和miRbase 数据库分析预测了miR-1183 可能的下游靶标,其中包括鼠双微体2(mouse double minute 2,MDM2)和缺氧诱导因子1(hypoxia inducible factor-1,HIF-1),这些基因已被证实参与肿瘤的放射抵抗[29-30]。MDM2 作为一种癌基因,能调节抑癌基因p53 对细胞周期和凋亡的调控[31]。多项研究结果表明,MDM2 在肿瘤对辐射反应的过程中发挥关键作用[32]。HIF-1 是一种关键的转录因子,可使肿瘤细胞适应缺氧条件[33]。放疗可以加速HIF-1 的激活,而HIF-1 反过来可通过多条信号途径影响辐射反应[34-35]。这些基因可能是miR-1183 调控肿瘤放射敏感性的重要靶标。本研究中,circRNA_0128846 在人NSCLC 放射抵抗细胞中的表达显著上调,而miR-1183 的表达下降,circRNA_0128846 可通过靶向结合并抑制miR-1183的表达,进而降低人NSCLC 细胞的放射敏感性,这提示circRNA_0128846 在NSCLC 的放射抵抗中发挥重要作用,其可能成为一种潜在的治疗靶点,但具体的作用机制还需进一步探究。
利益冲突所有作者声明无利益冲突
作者贡献声明陆滢负责实验的实施、论文的撰写;邓鑫州负责图像的分析、数据的处理、论文最终版本的修订;宋仕茂负责生物信息学的分析、论文摘要的校对;骆志国负责命题的提出、论文的审阅

