半夏泻心汤及其不同拆方对抗生素诱导的菌群紊乱幼鼠结肠黏膜屏障的影响
张映红,戴丽蓉,陈启明,刘喜平,岳娟,施丽娟,朱中博,李沛清
1.甘肃中医药大学,甘肃 兰州 730000;2.兰州大学第一医院,甘肃 兰州 730000
人体胃肠道是一个巨大的微生态系统,肠道菌群与其他组织及系统共同构成了肠道黏膜的生物屏障。正常情况下,肠道菌群在肠道内环境与机体形成一种互相依存、互相制约的共生关系,并维持动态平衡。在生命早期阶段,肠道菌群对免疫系统的形成至关重要也最易受到干扰,使菌群比例失调,破坏肠道菌群稳态,改变免疫应答,造成代谢障碍,还会使条件致病菌过度增殖、肠黏膜屏障受损,消弱机体免疫,增加肠道通透性,成为功能性胃肠病、炎症性肠病及一系列感染性疾病发生发展的基础。因此,基于生命早期阶段肠道菌群紊乱后肠黏膜屏障功能的改变,研究肠道菌群功能及药物的干预效应,对防治肠上皮屏障损伤相关胃肠道疾病具有重要意义。半夏泻心汤出自《伤寒论》,全方辛开苦降,甘补益脾,调和胃肠。临床研究表明,半夏泻心汤可通过调节肠道菌群失调改善菌群失调炎症性肠病等引起的肠黏膜受损,能提高机体免疫机能,减轻炎性反应,保护胃肠黏膜。本研究采用抗生素暴露致幼鼠肠道菌群失调并经脂多糖(LPS)诱导炎症反应,观察半夏泻心汤及其不同拆方对菌群失调幼鼠肠道菌群及结肠黏膜屏障的影响,进一步探讨半夏泻心汤干预效应与其配伍的关系,以期为中医药防治肠上皮屏障损伤相关胃肠道疾病提供实验依据。
1 实验材料
1.1 动物
3~4周龄SPF级雄性Balb/c幼鼠70只,体质量(15±2)g,北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2016-0006,饲养于甘肃中医药大学SPF级动物实验中心,温度(22±1)℃,相对湿度45%~65%,12 h明暗交替,给予标准饲料和清洁自来水喂养。本研究经甘肃中医药大学伦理委员会批准(2020-264)。
1.2 药物及制备
半夏泻心汤(法半夏60 g,干姜45 g,黄芩45 g,黄连15 g,人参45 g,大枣20枚,甘草45 g),饮片购于甘肃中医药大学附属医院中药房,经甘肃中医药大学药学院景明教授鉴定,符合2020年版《中华人民共和国药典》标准。依据半夏泻心汤配伍规则,将其分为全方组(法半夏60 g,干姜45 g,黄芩45 g,黄连15 g,人参45 g,大枣20枚,甘草45 g)、辛开组(法半夏60 g,干姜45 g)、苦降组(黄芩45 g,黄连15 g)和甘补组(人参45 g,大枣20枚,甘草45 g)。各组药物饮片浸泡30 min,煎煮2次,第一次加8倍量水煎煮1 h,第二次加6倍量水煎煮45 min,合并煎液,过滤,滤液减压浓缩至全方组、辛开组、苦降组、甘补组原药材浓度分别为0.91、0.32、0.18、0.41 g/mL。双歧杆菌四联活菌片,批号202005244,杭州远大生物,用生理盐水溶解,配制成浓度为68 mg/mL溶液。
1.3 主要试剂与仪器
氨苄西林胶囊(珠海联邦制药股份有限公司,批号96003103);硫酸新霉素、两性霉素B、甲硝唑、脂多糖(北京索莱宝,批号分别为70210512、511B059、827L021、408Z033);盐酸万古霉素(上海源叶生物,批号H13M11Y11310);Occludin、ZO-1抗体(英国Abcam公司,货号分别为ab216327、ab96587);粪便清蛋白ELISA试剂盒(上海酶联生物科技有限公司,批号202102)。ECLIPSE Ti型荧光倒置显微镜(日本Nikon公司);LEICA2016型切片机(德国Leica公司);JY-SCZ2+型电泳仪(北京君意东方电泳设备有限公司);DYCZ-40B型转膜仪(北京六一生物科技有限公司);SpecraMax i3x型多功能酶标仪(美国Thermo Fisher Scientific公司);ChemiDoc MP型数码凝胶成像分析系统(美国Bio-Rad公司)。
2 实验方法
2.1 混合抗生素溶液配制
参考文献[9]方法,使用生理盐水配制混合抗生素溶液,盐酸万古霉素、硫酸新霉素、两性霉素B、氨苄西林、甲硝唑浓度分别为5、10、0.1、10、10 mg/mL。
2.2 造模、分组及给药
幼鼠常规适应性饲养1周后,随机抽取10只作为空白组,其余幼鼠参考文献[9]方法,每12 h予混合抗生素溶液(盐酸万古霉素50 mg/kg、硫酸新霉素100 mg/kg、两性霉素B 1 mg/kg、氨苄西林100 mg/kg、甲硝唑100 mg/kg)灌胃制备抗生素暴露幼鼠模型,灌胃体积10 mL/kg,连续灌胃14 d后,按随机数字表法分为模型组、阳性对照组、全方组、辛开组、苦降组和甘补组,每组10只。按照人与动物体表面积换算等效剂量,阳性对照组、全方组、辛开组、苦降组、甘补组分别为0.68、9.1、3.19、1.82、4.1 g/kg,各组分别予双歧杆菌四联活菌片溶液、半夏泻心汤全方及相应拆方组药液灌胃,空白组、模型组予等体积生理盐水灌胃,1次/d,连续14 d。
2.3 肠道菌群多样性检测
末次灌胃12 h后,无菌收集幼鼠粪便(约0.5 mg),置于无菌EP管中,-80 ℃冰箱保存,用于16S rDNA测序分析肠道菌群。采用Illumina NovaSeq测序平台,提取全基因组DNA。以稀释后的基因组DNA为模板,根据测序区域,使用带Barcode的特异引物进行PCR。PCR产物使用2%琼脂糖凝胶电泳检测,TruSeqDNA PCR-Free Sample Preparation Kit进行文库构建,经过Qubit和Q-PCR定量,使用NovaSeq6000进行上机测序。利用Uparse算法(http://www.drive5.com/uparse/)对所有样本的全部有效数据进行聚类,默认以97%的一致性将序列聚类成为OTUs,筛选出现频率最高的序列作为OTUs的代表序列,作物种注释分析(设定阈值为0.8~1)。并根据OTU分类对肠道菌群α多样性及物种差异等进行分析。由苏州帕诺米克生物医药科技有限公司提供技术支持。
2.4 ELISA检测粪便清蛋白含量
于“2.3”项下采集粪便6 h后,除空白组外所有幼鼠一次性腹腔注射LPS(10 mg/kg)诱导炎症反应,6 h后采集幼鼠粪便(约0.5 mg)于无菌EP管中,加入无菌蒸馏水充分溶解,4 000 r/min离心10 min,分离上清液,按试剂盒说明书检测清蛋白含量。
2.5 HE染色观察结肠组织形态
采集粪便后脱颈处死幼鼠,分离全胃肠道组织,取距离阑尾处约2 cm的近端结肠组织,用预冷生理盐水冲洗干净,4.5%多聚甲醛溶液固定10 h,石蜡包埋,切片(9 μm),常规HE染色,光学显微镜下观察结肠组织病理形态。
2.6 Western blot检测结肠组织ZO-1、Occludin蛋白表达
取100 mg结肠组织,加入1 mL RIPA裂解液(含蛋白酶抑制剂),冰上充分研磨,4 ℃、12 000 r/min离心15 min。吸取上清液,BCA蛋白定量试剂盒检测蛋白浓度,将30 μL 5×上样缓冲液与120 μL蛋白样品混合,于PCR仪98 ℃加热变性5 min,冰浴5 min,重复3次。取等量蛋白上样,电泳、转膜后,5%脱脂牛奶室温封闭1 h。加入ZO-1、Occludin一抗(均为1∶1 000),4 ℃孵育过夜。TBST洗膜5次,每次6 min,加入二抗(1∶4 000),室温孵育90 min,TBST洗膜5次,每次6 min,凝胶成像分析系统曝光、显影。采用Image J 1.8软件测量条带灰度值,计算蛋白相对表达量。
3 统计学方法
采用SPSS23.0统计软件进行分析。实验数据以±表示,组间两两比较采用检验、MetaStat法,多组间比较采用方差分析。<0.05表示差异有统计学意义。
4 结果
4.1 半夏泻心汤及其不同拆方对抗生素暴露幼鼠肠道菌群α多样性的影响
基于幼鼠肠道菌群α多样性指数绘制稀释曲线及Rank Abundance曲线,显示样品测序数据量合理、饱和。与空白组比较,模型组幼鼠肠道菌群Shannon、Chao1及Simpson指数显著降低(<0.01),PD指数显著升高(<0.05);与模型组比较,全方组及不同拆方组幼鼠肠道菌群Shannon、Simpson指数显著升高(<0.01),辛开组及甘补组幼鼠肠道菌群Chao1指数显著降低(<0.05),辛开组、甘补组及苦降组幼鼠肠道菌群PD指数显著降低(<0.01),全方组差异无统计学意义(>0.05);各治疗组组间比较,全方组在升高Shannon指数方面最显著(<0.01)。结果见表1。
表1 各组幼鼠肠道菌群α多样性比较(±s)
4.2 半夏泻心汤及其不同拆方对抗生素暴露幼鼠肠道菌群结构的影响
LDA Effect Size分析可以确定各组之间具有显著差异的肠道菌群物种,LDA score>4的物种共52个,见图1、图2。空白组有9个差异物种,其中拟杆菌门Bacteroidetes、拟杆菌纲Bacteroidia、拟杆菌目Bacteroidales丰度较高;模型组有8个差异物种,其中 γ-变形菌纲Gammaproteobacteria、肠杆菌目Enterobacterales、肠内细菌科Enterobacteriaceae、克雷伯氏菌属丰度较高;阳性对照组有4个差异物种,副杆菌属、坦纳菌科Tannerellaceae、肠球菌属、肠球菌科Enterococcaceae丰度基本接近;辛开组有14个差异物种,其中拟杆菌属、阿克曼氏菌属、普雷沃菌属、布劳特氏菌属丰度较高;苦降组未见差异显著的肠道菌群;甘补组有9个差异物种,其中多枝梭菌属、梭菌属丰度较高;全方组有8个差异物种,其中乳杆菌属、柠檬酸杆菌属丰度较高。
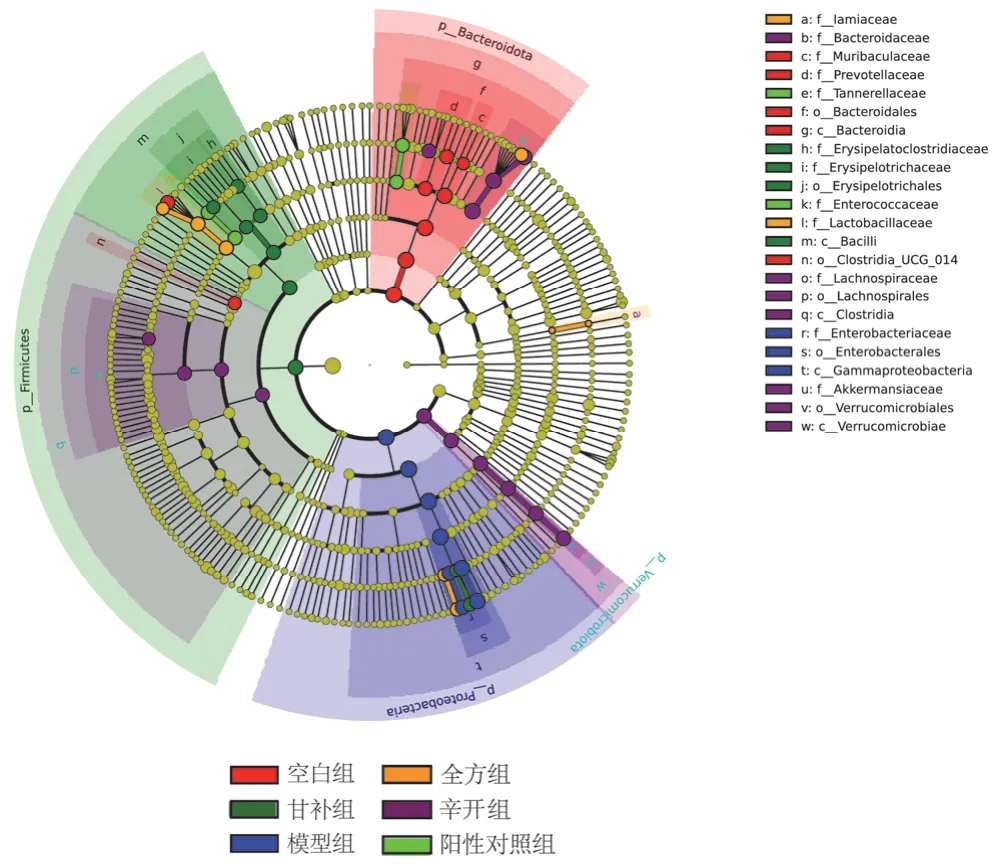
图1 各组幼鼠肠道菌群环形进化
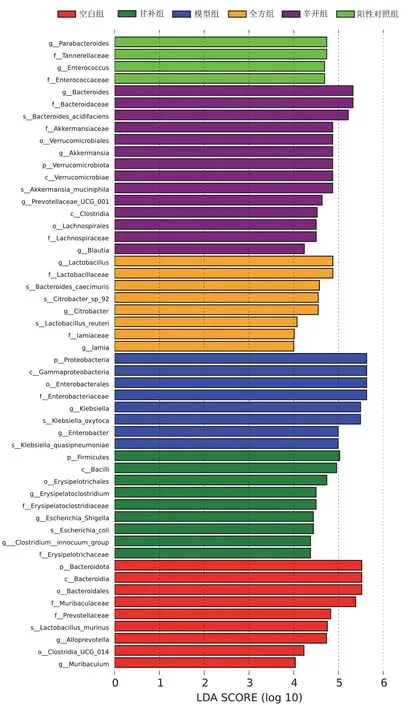
图2 各组幼鼠肠道菌群LDA score分布
根据物种注释结果,选取各样品在属水平上丰度排名前10位的物种,绘制物种相对丰度柱形累加图,见图3。其中相对丰度较高的菌属有克雷伯氏菌属、拟杆菌属、肠杆菌属、乳杆菌属。与空白组比较,模型组幼鼠肠道克雷伯氏菌属、肠杆菌属丰度显著增加,拟杆菌属、乳杆菌属丰度显著减少(<0.05,<0.01);与模型组比较,阳性对照组、全方组及不同配伍组幼鼠肠道克雷伯氏菌属和肠杆菌属丰度显著减少,全方组和不同配伍组幼鼠肠道拟杆菌属、乳杆菌属丰度显著增加;各治疗组组间比较,辛开组降低克雷伯氏菌属和肠杆菌属丰度最显著(<0.01),全方组增加乳杆菌属丰度最显著(<0.01),辛开组增加拟杆菌属丰度较全方组和苦降组显著(<0.01)。见表2。
表2 各组幼鼠肠道菌属水平丰度比较(±s,%)
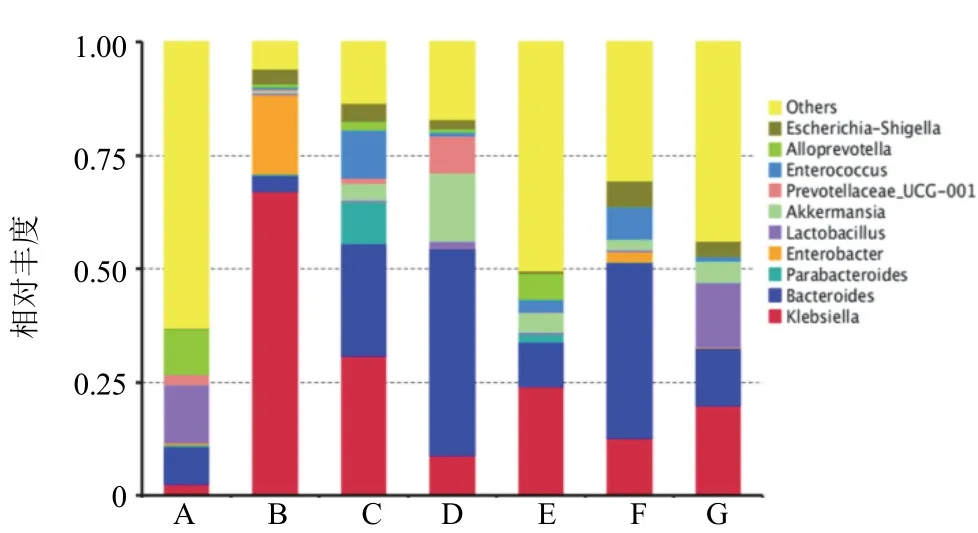
图3 各组幼鼠肠道菌群属水平丰度
4.3 半夏泻心汤及其不同拆方对抗生素暴露幼鼠结肠组织形态的影响
空白组幼鼠结肠绒毛发达,结肠黏膜上皮组织完整,结构清晰,隐窝无破坏,上皮细胞排列整齐,腺体完整,可见少量炎性细胞浸润;与空白组比较,模型组幼鼠结肠绒毛结构发育落后,结肠黏膜上皮组织不完整,结构不清晰,隐窝不明显,有大量炎性细胞浸润,腺体萎缩,有脓肿形成,细胞形态有所改变;与模型组比较,阳性对照组、全方组及不同拆方组幼鼠结肠组织腺体变长,黏膜层内隐窝结构损伤程度减轻,结肠黏膜组织可见少量炎性细胞浸润,其中以全方组较为明显。见图4。
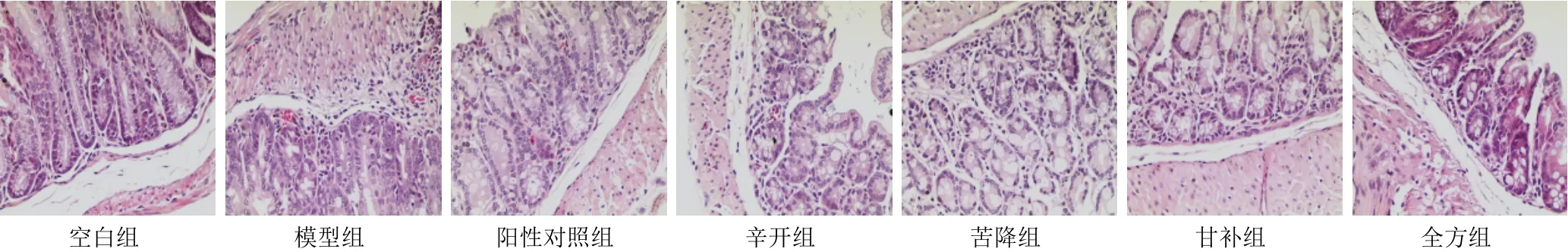
图4 各组幼鼠结肠组织形态(HE染色,×200)
4.4 半夏泻心汤及其不同拆方对抗生素暴露幼鼠粪便清蛋白含量的影响
与空白组比较,模型组幼鼠粪便清蛋白含量显著增加,差异有统计学意义(<0.01);与模型组比较,阳性对照组、全方组、甘补组、苦降组幼鼠粪便清蛋白含量显著减少,差异有统计学意义(<0.05,<0.01)。结果见表3。4.5 半夏泻心汤及其不同拆方对抗生素暴露幼鼠结肠组织Occludin、ZO-1蛋白表达的影响
表3 各组幼鼠粪便清蛋白含量比较(±s,μg/mL)
与空白组比较,模型组幼鼠结肠组织ZO-1和Occludin蛋白表达显著降低(<0.01);与模型组比较,阳性对照组、全方组及不同配伍组幼鼠结肠组织ZO-1和Occludin蛋白表达显著升高(<0.05,<0.01);各治疗组组间比较,全方组上调ZO-1蛋白表达最显著(<0.05,<0.01),上调Occludin蛋白表达较甘补组显著(<0.05)。结果见表4、图5。
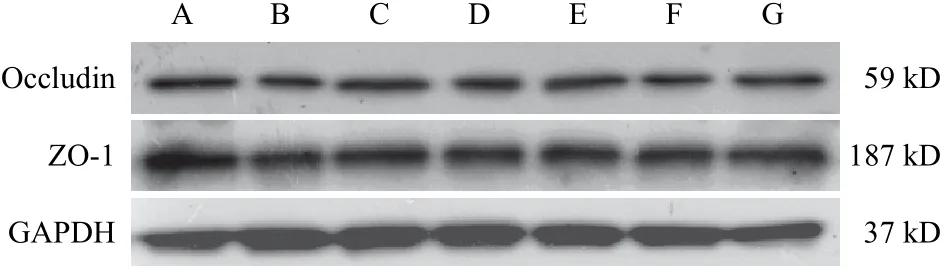
图5 各组幼鼠结肠组织Occludin、ZO-1蛋白免疫印迹
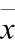
表4 各组幼鼠结肠组织Occludin、ZO-1蛋白表达比较(±s)
5 讨论
西医临床儿科人群和新生儿约25%的处方药含有抗生素,抗生素在防治各种感染性疾病的同时,也干扰了婴幼儿肠道正常菌群。抗生素暴露已成为生命早期阶段干扰肠道菌群结构的最常见诱因,可诱发炎症性肠病、哮喘、肥胖、变应性疾病等多种疾病。本实验结果表明,幼鼠抗生素暴露后肠道菌群Shannon、Chao1、Simpson指数显著降低,PD指数升高,表明肠道菌群平衡被破坏。半夏泻心汤全方及其不同拆方能升高Shannon、Chao1、Simpson指数,降低PD指数,其中半夏泻心汤全方组在升高Shannon、Simpson指数方面更显著,提示半夏泻心汤在调节肠道菌群多样性方面更具优势。对差异菌的研究表明,各组差异菌种类及丰度均有显著变化,其中辛开组差异菌最多,共有14个,苦降组无显著差异菌。
肠道菌群属水平分析表明,模型组肠道克雷伯氏菌属及肠杆菌属丰度显著增加,拟杆菌属和乳杆菌属丰度显著降低。克雷伯氏菌属是寄生于肠道中的条件致病菌,可引发呼吸道、消化道感染,尤其是免疫功能低下的新生儿和老年人,肠杆菌属也是常见的致病菌属,能够利用宿主炎症反应定植,过度生长,进一步加重肠道炎症程度。拟杆菌属和乳杆菌属是肠道常见的生理性菌群,其中拟杆菌属在肠黏膜血管形成、肠道微生态平衡及提高宿主免疫方面具有重要意义。乳杆菌能通过分泌乳酸、细菌素等物质降低肠道pH值,对肠道炎症、氧化应激和微生物群的共生作用产生有益影响,也能改善肠道菌群结构缺陷。本研究结果表明,抗生素暴露导致幼鼠肠道菌群结构发生改变,有害菌丰度增加,有益菌丰度减少。半夏泻心汤全方及其不同拆方能显著降低克雷伯氏菌属及肠杆菌属丰度,增加拟杆菌属和乳杆菌属丰度。其中辛开组在降低克雷伯氏菌属和肠杆菌属丰度方面最为显著,辛开组、甘补组在增加拟杆菌属丰度方面最为显著,全方组在增加乳杆菌属丰度方面最为显著。
肠黏膜屏障由机械屏障、生物屏障、化学屏障和免疫屏障组成。机械屏障是肠黏膜屏障的最后一道防线,主要由黏膜液、微绒毛、上皮黏膜细胞紧密连接蛋白等结构组成。紧密连接蛋白Occludin及ZO-1是反映结肠和回肠细胞旁通透性,维持肠黏膜屏障功能完整的重要标志;粪便清蛋白能维持肠道营养和渗透压,是肠黏膜屏障功能受损的指标。已有研究表明,肠道微生物及其代谢产物可为肠上皮细胞提供能量,促进紧密连接蛋白表达,塑造肠黏膜屏障,而肠道益生菌可通过调节紧密连接蛋白表达保护肠上皮屏障的完整性。因此,肠道菌群与紧密连接蛋白、肠黏膜屏障之间的相互协调在维持肠屏障稳态过程中扮演重要角色。本研究发现,LPS刺激后幼鼠结肠绒毛结构发育落后,结肠黏膜表面上皮组织不完整,隐窝不明显,腺体萎缩,结肠组织Occludin和ZO-1蛋白表达降低,粪便清蛋白含量增加,提示肠黏膜屏障受损严重。半夏泻心汤全方及其不同拆方能改善结肠组织病理形态,促进Occludin和ZO-1蛋白表达,降低粪便清蛋白含量,以半夏泻心汤全方作用最显著。
综上所述,抗生素暴露导致幼鼠肠道菌群紊乱,进而破坏肠黏膜屏障,半夏泻心汤全方及其不同拆方可调节肠道菌群结构,保护受损肠黏膜屏障。但辛开组、苦降组、甘补组及全方组在调节菌群结构及不同菌属丰度方面作用并不完全一致,在调节肠受损黏膜屏障、结肠组织ZO-1表达方面,以半夏泻心汤全方最为显著,而辛开、苦降、甘补3种配伍具有协同增效作用。本研究可为临床合理应用抗生素及半夏泻心汤防治肠上皮屏障损伤相关胃肠道疾病提供科学依据。

