超高效液相色谱-串联质谱法测定鲜蛋中氟苯尼考残留量的不确定度分析
谭美龄,阎睿,贺灵芝,张椿翊,任静
(1.重庆市万州食品药品检验所,重庆 404000; 2.重庆三峡学院生物与食品工程学院,重庆 404100)
氟苯尼考(florfenicol,FFC)是新一代酰胺醇类抗生素,具有抗菌谱广、耐药性小、抗菌活性强等特点,被广泛用于人和动物疾病的防治[1]。氟苯尼考具有一定的免疫毒性和胚胎毒性,可通过疾病治疗或饲料添加的方式在家禽体内残留并不断积累,进而传递至蛋品中,并通过食物链对人体产生危害[2]。我国在GB 31650—2019 《食品安全国家标准食品中兽药最大残留限量》[3]中规定产蛋期家禽禁用氟苯尼考。
在氟苯尼考残留量的检测工作中,由于仪器设备、试剂等诸多因素,分析结果存在误差,需要进行测定不确定度分析。不确定度是与测量结果相关的表征合理地赋予被测量之值的分散性的参数[4]。一个科学、准确的测量结果应包含与其相关的不确定度来表示该测量值的可信赖程度。
笔者根据JJF 1135—2005 《化学分析测量不确定度评定》、JJF 1059.1—2012 《测量不确定度评定与表示》和CNAS—GL006—2019 《化学分析中不确定度的评估指南》等相关指导性文件的要求[5-8],参照GB/T 22338—2008 《动物源性食品中氯霉素类药物残留量测定》[9]液相色谱-质谱/质谱法测定鲜蛋中氟苯尼考残留量,并对其检测结果进行不确定度评定,为提高检测方法的准确性和评估其它农兽药残留检测方法的不确定度提供技术的参考。
1 实验部分
1.1 主要仪器与试剂
液相色谱系统-串联三重四极杆质谱仪:色谱系统为DIONEX UltiMate-3000型,三重四极杆质谱仪为TSQ Quantum Access Max型,配ESI离子源,美国赛默飞世尔科技公司。
高速离心机:3-30KS型,德国SIGMA实验室离心机公司。
微孔滤膜:孔径为0.22 μm,北京迪马科技有限公司。
氟苯尼考(FFC):批号为B0002300,质量分数为99.0%,北京曼哈格生物科技有限公司。
乙腈、甲醇:色谱纯,德国默克公司。
乙酸铵、正丙醇、正己烷:分析纯,重庆川东化工公司。
鲜蛋:市售。
1.2 实验环境及器具
所有操作均在(20±5)℃的环境温度及50%~70%的相对湿度条件下进行,并假设温度波动服从均匀分布[10]。在该环境条件下,甲醇的体积膨胀系数为1.1×10-3℃-1,水的体积膨胀系数为2.1×10-4℃-1。本实验所用玻璃量器均符合A级标准,容量允差均以20 ℃时的示值为标准。
1.3 标准溶液配制
精密称取FFC标准物质0.010 08 g,用甲醇配制成FFC标准储备溶液(质量浓度为99.792 μg/mL);准确移取上述溶液1 mL至100 mL容量瓶中,用甲醇配制成FFC标准中间溶液(质量浓度为997.92 ng/mL);准确移取FFC标准中间溶液1 mL至10 mL容量瓶中,用甲醇配制成FFC标准工作溶液(质量浓度为99.792 ng/mL);用合适的移液器分别准确吸取FFC标准工作溶液50、100、200、500、1 000 μL至5只10 mL容量瓶中,加入10%甲醇水溶液,稀释成质量浓度分别为0.499、0.998、1.996、4.990、9.979 ng/mL的FFC系列标准工作溶液。
1.4 样品制备
参照GB/T 22338—2008[9]中的方法对鲜蛋中的FFC进行提取和净化。氮气吹干后,用10%甲醇水溶液复溶至1 mL,过0.22 μm微孔滤膜后用于超高效液相色谱-串联质谱法测定。
1.5 仪器工作条件
1.5.1 色谱
色 谱 柱:InfinityLab Poroshell 120 EC-C18柱(100 mm×2.1 mm,1.9 μm,美国安捷伦科技有限公司);流动相:A相为甲醇,B相为5 mmol/L乙酸铵水溶液,设置梯度洗脱程序,0~1.5 min,A相为体积分数为10%,1.5~4 min,A相从10%线性增加至90%,并保持至7.50 min,7.50~7.51 min,A相从90%线性降回至10%,并保持至10 min,流量为0.20 mL/min;进样体积:5 μL;柱温:40 ℃。
1.5.2 质谱
离子源:电喷电离ESI(-);检测方式:选择反应监测扫描(selective reaction monitoring,SRM);电喷雾电压:-2 500 V;雾化器蒸发温度:300 ℃;毛细管温度:350 ℃;鞘气:35 Arb;辅助气:10 Arb;离子吹扫气:0;定量离子对:m/z355.942>335.837;定性离子对:m/z355.942>184.913;碎裂电压:-53 V;碰撞电压:-12 V(定量)/-21 V(定性)。
1.6 数学模型的建立
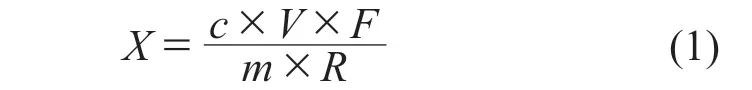
式中:X——试样中FFC的残留量,μg/kg;
c——利用拟合曲线法测得试样溶液中FFC
的残留浓度,ng/mL;
V——试样溶液最终定容体积,mL;
F——重复性系数;
m——称取试样的质量,g;
R——回收率,%。
2 不确定度来源
根据数学模型,影响鲜蛋中氟苯尼考残留量的测定结果的不确定度包括标准溶液的质量浓度、样品溶液体积量取、称样质量、重复性。不确定度来源示意图如图1所示。

图1 不确定度的来源
3 不确定度评定
3.1 标准溶液的质量浓度(ρ)引入的不确定度
因标准溶液产生的不确定来源主要有FFC标准物质浓度、称量过程、溶液的定容及移取过程、曲线拟合过程[11-13]。
3.1.1 FFC标准储备溶液的配制
(1)标准物质纯度引入的不确定度。根据标准物质证书,FFC的纯度误差为2.0%,按照B类评定,均匀分布的包含因子k=,则由FFC纯度引入的相对标准不确定度:
urel(ρ)=2.0%/99.0%/k=0.011 7
(2)标准物质称量引入的不确定度。根据电子天平检定证书,其最大允许误差为±0.05mg,按照B类评定,均匀分布的包含因子k=,则由FFC称量引入的相对标准不确定度:
urel(m)=0.05/10.08/k=0.002 86
(3)标准储备溶液定容引入的不确定度。根据JJG 196—2006 《常用玻璃量器》[12]规定,100 mL容量瓶容量允差为±0.10 mL,以对称分布计算[14],取包含因子k1=;温度波动服从均匀分布[10],取包含因子k2=。由容量和温度引入的标准不确定度分别为:
u(V1)=0.10/k1=0.040 82 mL
u(V2)=5×1.1×10-3×100/k1=0.317 54 mL
合成相对标准不确定度:
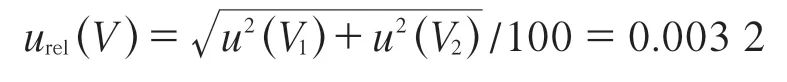
综上,由FFC标准储备溶液的配制所产生的相对标准不确定度:
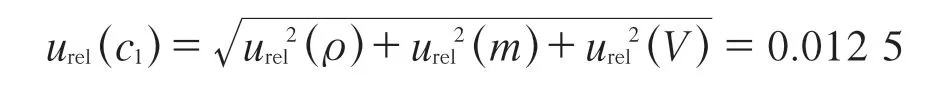
3.1.2 FFC标准储备溶液的稀释
假设(1±0.007)mL单标线吸量管容量误差服从均匀分布,取包含因子k=,标准中间溶液及FFC标准工作溶液移液过程产生的标准不确定度分别为:?
u(y11)=0.007/k=0.004 04 mL
u(y12)=5×1.1×10-3×1/k=0.003 18 mL
合成相对标准不确定度:
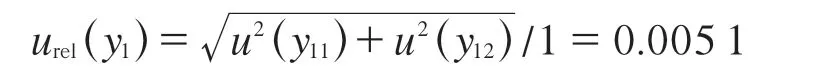
假设(10±0.020)mL容量瓶服从均匀分布,取包含因子k=,在FFC标准中间溶液的定容过程中产生的标准不确定度分别为:
u(d11)=0.10/k=0.057 74 mL
u(d12)=5×1.1×10-3×100/k=0.317 54 mL
合成相对标准不确定度为:
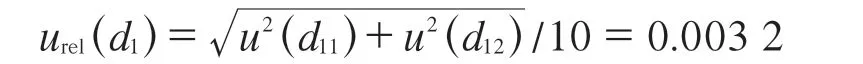
假设(100±0.10)mL容量瓶均服从均匀分布,取包含因子k=,在FFC标准工作溶液的定容过程中产生的标准不确定度分别为:
u(d21)=0.020/k=0.011 55 mL
u(d22)=5×1.1×10-3×10/k=0.031 75 mL
合成相对标准不确定度:

其中,FFC标准中间溶液及FFC标准工作溶液具有相同的(1±0.007) mL单标线吸量管移液过程。综上,由FFC标准储备溶液的稀释产生的相对标准不确定度:
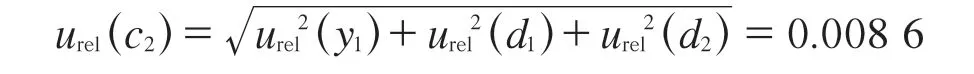
3.1.4 标准曲线的拟合
对FFC标准工作曲线的5种质量浓度分别平行测定2次,色谱峰面积见表2。以标准溶液质量
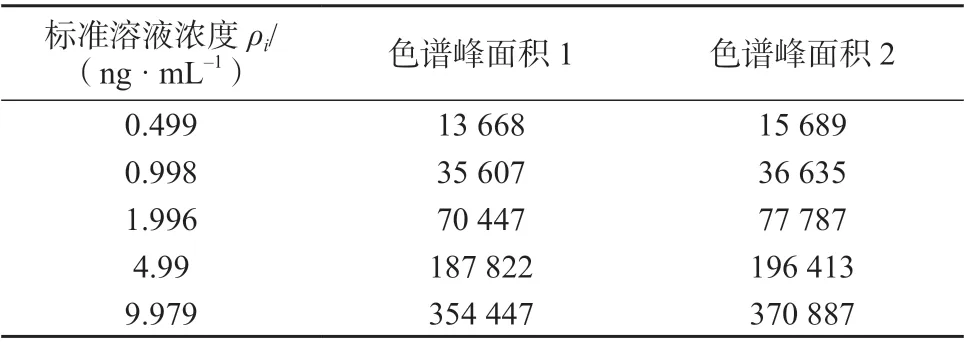
表2 标准曲线的色谱峰面积
3.1.3 FFC标准曲线溶液的配制
根据JJG 646—2006 《移液器检定规程》的要求,按照均匀分布处理[15],取包含因子k=,移液过程引入的不确定度见表1。
由表1中的数据,可以得出由FFC标准曲线溶液的配制引入的相对标准不确定度:浓度为横坐标(X),色谱峰面积为纵坐标(Y),拟合得到线性回归方程为Y=36 580X+2 474,相关系数为0.999 5。阳性鲜蛋样品质量浓度的4次测定结果分别为7.110、7.400、7.577、7.523 ng/mL。
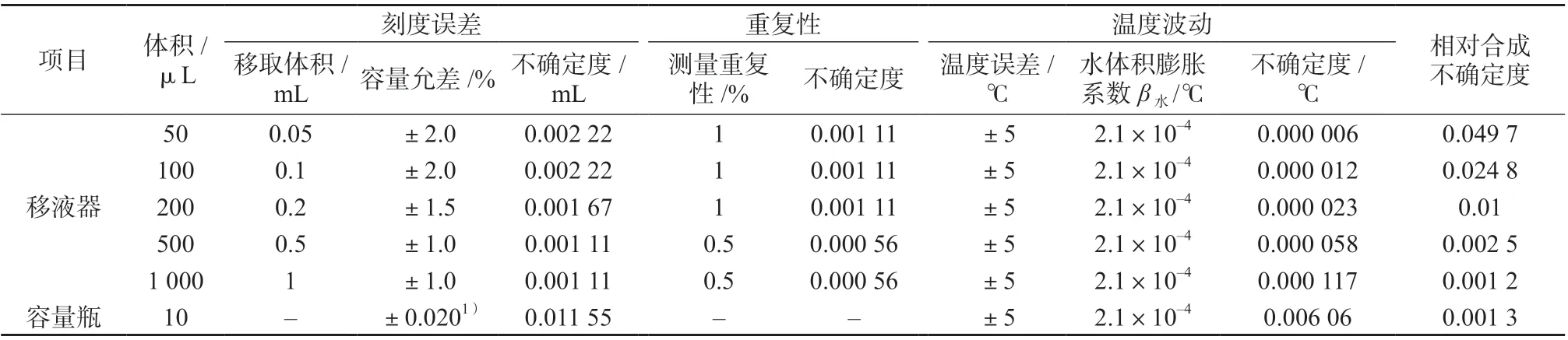
表1 FFC标准曲线溶液的配制引入的不确定度
回归方程的估计误差S按照式(2)计算,FFC拟合曲线的相对不确定度按照式(3)计算:
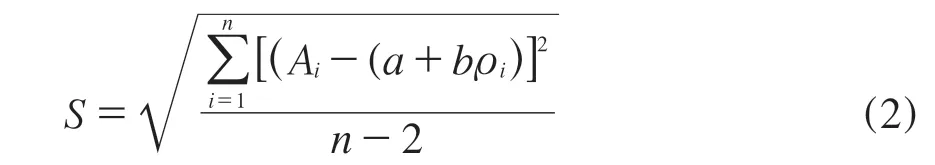
式中,S——估计误差;
Ai——标准溶液的色谱峰面积;
a——拟合曲线的截距;
b——拟合曲线的斜率;
ρi——标准溶液的浓度;
n——FFC标准曲线上点的测定次数[16]。
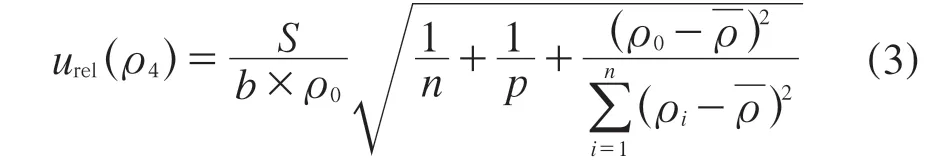
式中:ρ0——通过曲线回归方程计算出的鲜蛋中FFC浓度[17];
n——FFC标准曲线上点的测定次数[16];
p——阳性鲜蛋样品的测定次数,p=4;
ρi——标准溶液的浓度;
将实验数据代入式(2)与式(3),得到S=7439,urel(c4)=0.018 7。
综上,标准溶液质量浓度(ρ)引入的不确定度:
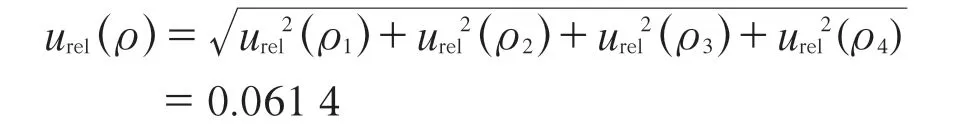
3.2 样品溶液体积量取(V)引入的不确定度[18]
在样品溶液的定容过程中,刻度试管定容至1 mL的体积允许误差为±0.008 mL,代入均匀分布的包含因子k=3,由容量和温度引入的标准不确定度分别为:
u(V1)=0.008/k=0.004 62 mL
u(V2)=5×2.1×10-4×1/k=0.000 61 mL
合成相对标准不确定度:
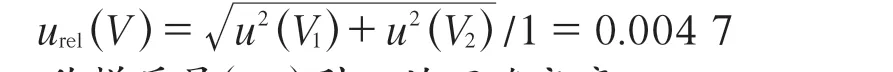
3.3 称样质量(m)引入的不确定度
根据电子天平检定证书,得其最大允许误差为±0.000 5 g,按照B类评定,代入均匀分布的包含因子k=,其相对不确定度:
urel(m)=0.000 5/5.0011/k=0.000 06 mL
3.4 测量重复性(F)引入的不确定度
向阴性鲜蛋样品中加入FFC标准溶液,按照样品制备过程同法处理[19-20]。按照A类评定,将重复测定的标准偏差与平均值分别代入u(F)=s(F)/,urel(F)=u(F)/,计算结果见表3。
3.6 合成不确定度
将各分量的相对不确定度列于表4,则合成各分量的相对不确定度:
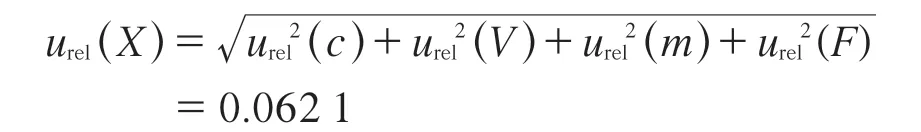

表4 各分量的相对不确定度
3.7 扩展不确定度及结果报告
在本研究条件下,阳性鲜蛋中FFC残留量的测定值经回收率校正为=1.49 μg/kg。取包含因子k=2,置 信 水 平 为95%[21],扩 展 不 确 定 度U=urel(X)×k×=0.19μg/kg。该鲜蛋中FFC 留量的定值结果为(1.49±0.19)μg/kg。
4 结语
采用国家标准方法GB/T 22338—2008 《动物源性食品中氯霉素类药物残留量测定》[9]测定鲜蛋中氟苯尼考的残留量,依据相关标准评估了实验过程中多种因素引入的不确定度。其中影响检测结果的主次因素依次为:标准曲线溶液的配制及标准曲线的拟合、标准储备溶液的配制与稀释、方法回收率、测量重复性、体积量取、样品称量。
在实际操作中,应使用具有溯源性的有证标准物质;正确配制校准曲线,提高其线性相关系数;增加平行测定次数来降低误差;采用国标方法和经过验证的分析方法,优化样品处理过程,并使用回收率来校正测量值;定期校准测量仪器,并使用校准证书上的修正值,保持仪器较高的精度、灵敏度和稳定性;提高实验人员的检测技术水平,减少测量不确定度,从而确保检测结果的准确性。为科学评价实验结果的准确性提供依据,为评定其它相关检测方法的不确定度提供技术参考。

