基于单个B 淋巴细胞扩增技术筛选马传染性贫血病毒的囊膜蛋白单克隆抗体
张佳琦,王亚玉,郭 兴,林跃智*,廖化新,王晓钧*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/马传染病和慢病毒病研究创新团队,黑龙江 哈尔滨 150069;2.暨南大学生命科学技术学院细胞生物学系,广东 广州 510632)
马传染性贫血病(Equine infectious anemia,EIA)是一类严重危害马属动物的传染病。该病病原EIA病毒(EIAV)与人免疫缺陷病毒(HIV-1)同属于反转录病毒科慢病毒属[1]。经过体内、体外的长期传代,我国成功获得了可以提供免疫保护的弱毒疫苗株,有效地控制了EIA 在我国的流行[2]。因此,对EIAV的研究不仅可以促进对慢病毒病原学的认知,更可为慢病毒保护性免疫机制的研究提供重要模型[3]。
病毒侵入宿主细胞的过程始于病毒囊膜蛋白(Env)与宿主受体间的结合。EIAV 的Env 是由表面蛋白(Gp90)和跨膜蛋白(Gp45)组成,既是病毒粘附、细胞间融合、传播过程中的关键蛋白,也是重要的免疫原,存在于多个中和抗体表位、Th 表位和CTL 表位[4],是针对EIAV 产生中和抗体的主要靶蛋白。多项研究表明,Env 变异非常活跃,即便是感染马在无症状阶段(即机体免疫成熟阶段),其变异仍在持续发生[3],这影响了宿主免疫系统对Env 抗原的识别。另外,Env 蛋白因基因变异导致其糖基化位点的改变也会影响病毒表面的构象,影响中和抗体与病毒的结合,从而导致病毒的免疫逃逸,因此Env的高变异性与病毒的免疫逃逸密切相关[2]。另有研究发现Env 变异与EIAV 毒力息息相关,且Env 多样性的特征是EIAV 弱毒疫苗产生保护性免疫的关键因素[5]。因此,深入探究Env 对EIAV 致病性及免疫保护中的作用对抗慢病毒研究具有重要意义,但缺乏Env 单克隆抗体(MAb)一直限制该方面的研究。
单个B 淋巴细胞的抗体基因扩增技术是利用记忆性B 淋巴细胞表面表达B 细胞受体(BCR)的特点,采用荧光激活细胞分选(FACS)技术从样本(外周血/脾脏)中分选出靶蛋白的单个记忆性B 淋巴细胞。随后通过RT-PCR 和套式PCR,获得特异性识别靶蛋白的MAb 的重链和轻链可变区序列(Ig VH 和Ig VL)。通过重叠延伸PCR 分别构建表达抗体Ig VH 和Ig VL的真核表达载体,共转染后获得多个重组的MAb[6]。与传统的MAb 制备技术相比,该方法具有以下优势:1)通过单个细胞RT-PCR 所获得的抗体重链、轻链均来自于同一个浆细胞,保持了抗体天然组合,其三维空间结构与自然感染后产生的特异性抗体的空间结构更为相似,可减少抗体重组表达后活性的丢失;2)制备方法方便、高效。从分离单个细胞到得到抗体仅需不到1 个月的时间,大大缩减了MAb 制备时间;3)当免疫原不能有效诱导抗体产生或抗体效价低时,该方法仍可分离到有效的抗体;4)由于其庞大的抗体基因候选库,通过该项技术获得保护性中和抗体甚至广谱性中和抗体都成为了可能,这是该方法区别于传统的杂交瘤融合技术制备MAb 的最大优势[7]。目前该方法已广泛用于HIV-1、破伤风、乙型肝炎、流感等多种疾病病原抗体库的建立,并且也研发出基于人源、鼠源、猪源和牛源等多个物种的高通量抗体筛选平台[8-9]。本研究利用MAb 基因扩增技术,获得了特异性良好的Gp90 MAb,可为后续Env 的功能学研究及阐明EIAV 的致病及免疫保护机制提供重要工具。
1 材料与方法
1.1 细胞、质粒及实验动物 人胚胎肾细胞HEK293T、HEK293F 以及表达载体pcDNA3.1 由本实验室保存;大肠杆菌DH5α 感受态细胞购自天根生化科技(北京)有限公司;6 周龄~8 周龄SPF 级BALB/c小鼠(体质量为15 g~20 g)购自辽宁长生生物技术股份有限公司。
1.2 主要试剂 RPMI 1640 培养基购自Sigma 公司;胎牛血清购自Wisent 公司;DNA 转染试剂PolyJet 购自Signagen Laboratories 公司、PEI 购自Polysciences 公司;KOD 高保真酶购自Toyobo 公司;Superscript III反转录酶购自Invitrogen 公司;HotStarTaqPlus 酶购自QIAGEN 公司;Lgepal 酶购自Sigma 公司;重组核糖核酸酶抑制剂RNase OutTM购自G-Biosciences 公司;2×TaqPCR Mixture 购自北京博奥龙免疫技术公司;PE 荧光染料标记试剂盒购自Biotium 公司;BV421 荧光染料及anti-mouse CD4-FITC、anti-mouse CD8a-FITC、anti-mouse B220-APC、anti-mouse IgD-PE 等荧光标记抗体均购自BD biosciences 公司;His MAb、β-actin MAb 购自Abcam 公司;红外荧光标记羊抗兔IgG(IgG-Dylight 700)、红外荧光标记羊抗鼠IgG(IgG-Dylight 800)购自KPL 公司;LIVE/DEAD Fix⁃able Aqua Dead Cell Stain Kit 购 自Thermo Fisher 公 司;Protein A Matrix Antibody 纯化试剂盒、His-tag 蛋白纯化试剂盒购自Beaver 公司;RNA 提取试剂盒购自BioFlux 公司;无内毒素质粒提取试剂盒购自南京诺唯赞生物科技有限公司;蛋白预制胶、变性蛋白电泳缓冲液和非变性蛋白电泳缓冲液购自金斯瑞公司;所有引物和测序均由吉林省库美生物科技有限公司完成。
1.3 Gp90 真核表达质粒的制备及表达 根据Gen⁃Bank 登录的EIAV 参考株(AF509240.1)的Env 基因序列,截取其中Gp90 胞外区基因片段,依据哺乳动物密码子的偏好性进行优化合成(金斯瑞)。在上游引物(P1)引入信号肽GAGACCGACACCCTGCTGCTGT GGGTGCTGCTGCTGTGGGTGCCCGGCAGCACCGGCG AC。下游引物(P2)引入10×His 标签序列CACCACCA CCACCACCACCACCACCACCAC。P3/P4 用于扩增载体序列并引入与插入片段互补的同源臂(表1)。利用Seam⁃less Assembly Cloning Kit 将扩增产物和载体片段连接,转化大肠杆菌DH5α 感受态后获得重组质粒。经测序鉴定正确的重组质粒命名为pcDNA3.1-sgp90-His。随后,利用PolyJet 转染试剂将重组质粒转染至HEK293T 细胞48 h 后收集细胞和上清,分别以兔源抗His MAb 和鼠源抗β-actin MAb 为一抗(1∶10 000),以Dylight 700 标记羊抗兔IgG 和Dylight 800 标记羊抗鼠IgG 为二抗(1∶5 000),采用western blot 检测Gp90 蛋白的表达情况。鉴定正确的重组质粒用于后续动物免疫。实验设空载体转染细胞为阴性对照。
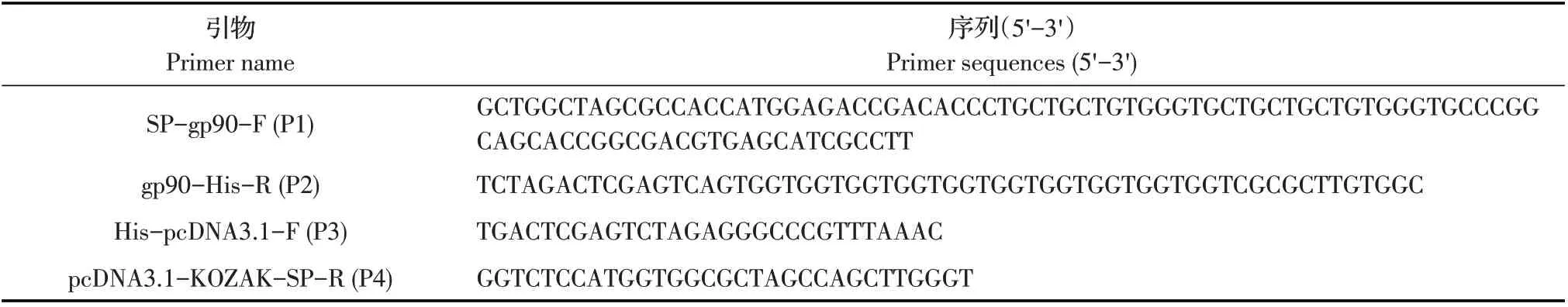
表1 目的基因扩增所用的引物序列Table 1 Primers used for PCR amplification
1.4 Gp90 蛋白的制备 利用PolyJet 转染试剂将重组质粒pcDNA3.1-s-gp90-His 转染HEK293T 细胞24 h后收集细胞,用PBS 重悬并超声裂解后取上清液,利用His-tag 蛋白纯化试剂盒纯化Gp90 蛋白。纯化的Gp90 蛋白分别用于FACS 分选单个B 细胞的染色标记及Gp90 MAb 的ELISA 鉴定。
1.5 小鼠免疫实验 采用重组质粒pcDNA3.1-sgp90-His 多次免疫雌性BALB/c 小鼠,免疫小鼠数量为3 只,每只小鼠分别在第0、2、4、6、8、10 周免疫(共计6 次),接种部位为股四头肌,免疫剂量为100 μg/只。小鼠在免疫前以及第2~6 次免疫后3 d 采集尾静脉血,分离血清备用。第6 次免疫后,以小鼠血清(1∶200,1∶400,…,1∶204 8000)为一抗,HRP标记的羊抗小鼠IgG(1∶5 000)为二抗,采用ELISA检测免疫小鼠血清抗体效价,效价达到1∶25 600 时迫杀小鼠,无菌采集免疫小鼠的脾细胞,计数冻存。
1.6 荧光激活细胞分选(FACS)小鼠脾单个B细胞 将分离的小鼠脾细胞用RPMI 1640 培养基(10%FBS)清洗3次。将anti-mouse CD4-FITC(50 μL/sample)、anti-mouse CD8a-FITC(50 μL/sample)、anti-mouse B220-APC(50 μL/sample)、anti-mouse IgD-PE(50 μL/sample)、细胞活性染料Live/Dead Fixable Aqua Dead Cell Stain Kit(50 μL/sample)分别与用PE 和BV421 按照PE 染料标记试剂盒标记的Gp90 蛋白混匀后加入到脾细胞悬液中,避光染色30 min,PBS(2% FBS)洗涤2 次,用3 mL PBS(5% FBS)重悬细胞。利用流式细胞仪依据不同的表面标记物进行分选。逐步筛选并去除死细胞、根据Live/CD4-/CD8a-/B220+获得B220+阳性表型的B 淋巴细胞、依据记忆性B 细胞的表面标记特征:CD4-/CD8-/B220+/IgD-/特异性抗原+[10],选取IgD-的B 淋巴细胞Live/CD4-/CD8a-/B220+/IgD-并最终通过荧光标记(PE 和BV421)的Gp90 蛋白筛选出特异性识别Gp90 蛋白的B 淋巴细胞,其表型为Live/CD4-/CD8a-/B220+/IgD-/Gp90+,将细胞稀释至500 个/mL,以每孔0.5 μL(约1 个细胞)的剂量加入96 孔PCR 板中,用于后续PCR 扩增。
1.7 套 式PCR 扩 增Gp90 MAb Ig VH 和Ig VL 基因 分别提取1.6 中获得多个单一B 细胞的总RNA,反转录分别获得单个细胞的cDNA,以其为模板采用套 式PCR 扩 增Gp90 MAb 的Ig VH 和Ig VL 基 因。第一轮PCR 扩增反应体系10 μL:cDNA 1 μL,HotStar⁃TaqPlus酶1 U,dNTPs 0.2 mmol/L,Ig VH 或Ig VL 上下游引物各0.5 μL,ddH2O 调整总体积为10 μL。PCR反 应 条 件 为:95 ℃5 min;95 ℃30 s、55 ℃60 s、72 ℃90 s,35个循环;72 ℃7 min。第二轮PCR 扩增反应体系50 μL:第一轮PCR 反应产物3 μL,Hot⁃StarTaqPlus 酶5 U,dNTPs 0.2 mmol/L,Ig VH 或Ig VL上下游引物各0.5 μL,ddH2O调整总体积为50 μL。PCR反应条件为:95 ℃5 min;95 ℃30 s、58 ℃60 s、72 ℃90 s,35 个循环;72 ℃7 min。PCR 终产物用1.2%琼脂糖凝胶电泳检测。PCR 产物采用Qiagen PCR purifi⁃cation kit 纯化后测序鉴定。(该步骤中涉及的所有引物目前均在专利申请过程中,故未表述)。
1.8 Gp90 MAb Ig VH 和Ig VL 线性表达载体的构建 利用重叠延伸PCR 将扩增的Gp90 MAb Ig VH 和Ig VL 链分别与抗体恒定区表达载体(包含CMV 启动子、人恒定区及多聚A 尾,专利申请中)融合成全长重链和轻链基因。反应体系50 μL:模板1.5 μL,VH 链或VL(κ 链)的正向引物、反向引物(申请专利中)各1 μL,dNTPs 1 μL,Q5 reaction buffer 10 μL,high fidelity DNA polymerase(Biolabs)0.5 μL,ddH2O 33 μL。PCR 扩 增 条 件:95 ℃5 min;95 ℃30 s、58 ℃60 s、72 ℃90 s,32 个循环;72 ℃7 min。随后将全长MAb 重链和轻链基因分别克隆至pcDNA3.1中,经测序鉴定正确的质粒分别命名为pcDNA3.1-VH 和pcDNA3.1-VL。
1.9 Gp90 MAb的筛选与纯化 待HEK293T细胞长至80%~90%密度时,利用PolyJet转染试剂将pcDNA3.1-VH和pcDNA3.1-VL重组质粒共转染至HEK293T细胞(各1 μg)6 h 后,换5%细胞培养液,37 ℃5% CO2继续培养72 h,收集细胞上清。以纯化的Gp90 蛋白(200 ng/孔)为包被抗原,各Gp90 MAb 细胞上清以1∶200 为初始稀释度按照2 倍倍比稀释(21倍~212倍)后分别为一抗,HRP 标记的羊抗小鼠IgG(1∶5 000)作为二抗,采用ELISA 方法进行检测。试验以小鼠终末免疫后的血清为阳性对照。
将ELISA 结 果 呈 阳 性 的pcDNA3.1-VH 和pcD⁃NA3.1-VL 重组质粒按照1∶1 的比例(各500 μg)参照PEI 转染方法共转染至密度为2×106个/mL 总体积为500 mL 的HEK293F 悬浮细胞中,5 d 后收集细胞上清,按照Protein A 纯化方法纯化Gp90 MAb。纯化的Gp90 MAb 经检测并用于后续western blot 的鉴定。
1.10 Gp90 MAb 的western blot 鉴定 将重组质粒pcDNA3.1-s-gp90-His 参 照PolyJet 转 染 方 法 转 染 至HEK293T 中,48 h 后收集细胞,参照文献[11]将细胞分别进行变性及非变性的处理,制备成相应的蛋白样品后进行变性凝胶电泳(SDS-PAGE)和非变性凝胶电泳(native SDS-PAGE),随后将蛋白印迹电转至NC膜上,以纯化的Gp90 MAb(1∶500)或者鼠源抗His MAb(1∶10 000)作为一抗,红外线标记的羊抗鼠IgG作为二抗(1∶10 000)进行Gp90 MAb的western blot检测。
另外,将EIAV 感染马巨噬细胞36 h 后收集细胞,通过上述western blot 方法验证本研究制备的Gp90 MAb 对EIAV 感染靶细胞状态下Gp90 蛋白的识别情况。
2 结 果
2.1 Gp90 表达质粒的构建及其重组蛋白表达 以优化过的Gp90基因为模板,PCR扩增获得约1 450 bp的片段,大小与预期相符(图1A),将获得的目的片段以及分泌型信号肽连接到真核表达载体pcDNA3.1 中构建Gp90 真核表达质粒,经测序鉴定正确的质粒命名 为pcDNA3.1-s-gp90-His。将pcDNA3.1-s-gp90-His 质粒转染至HEK293T 细胞,裂解细胞进行west⁃ern blot 鉴定,结果显示:细胞上清和细胞裂解物中均可见目的蛋白的表达,但以上清表达居多(≈90 ku)(图1B),表明重组Gp90 蛋白能够以分泌形式获得正确表达。
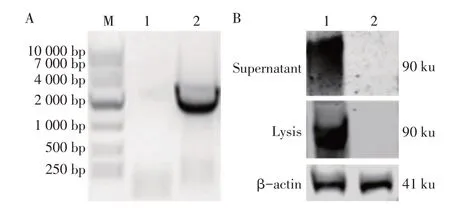
图1 Gp90基因片段的PCR扩增及表达鉴定Fig.1 PCR amplification of gp90 gene fragment and expression identification
2.2 小鼠脾单个B 淋巴细胞的分离 本实验共分选了2 只免疫小鼠的脾细胞,共计2×108个脾细胞,按照步骤1.6,利用流式细胞仪先后通过圈定DEAD-细胞群去除死细胞(DEAD+表型为死细胞)(图2A)后,经CD4+CD8+和B220+(图2B、图2C)标记物筛选,选取IgD-的B 淋巴细胞Live/CD4-/CD8a-/B220+/IgD-(图2D)、通过荧光标记(PE 和BV421)的Gp90 蛋白等标记物选取特异性识别Gp90 蛋白的B 淋巴细胞(图2E),结果显示共得到890个Gp90+B淋巴细胞,可用于后续PCR试验。

图2 流式细胞术分选可特异性识别Gp90的小鼠记忆B淋巴细胞Fig.2 Flow cytometry sorting memory B lymphocytes that specifically recognize Gp90
2.3 Gp90 MAb 的Ig VH 和Ig VL 基因的套式PCR扩增结果 以分选的890 个Gp90 特异性记忆B 淋巴细胞基因组分别为模板,采用抗体可变区特异性引物对抗体的Ig VH 和Ig VL 分别进行PCR 扩增,扩增片段测序并比对,结果显示,共获得27 对互相匹配的Gp90 MAb Ig VH和Ig VL基因(图3)。

图3 抗体可变区重链(A)/轻链(B)的套式PCR扩增Fig.3 PCR amplification of heavy(A)/light(B)chain variable region
2.4 重组Gp90 MAb的筛选纯化结果 将2.3中27对互相匹配的Gp90 MAb Ig VH 和Ig VL 基因对应的pcD⁃NA3.1-VH 和pcDNA3.1-VL 重 组 质 粒 分 别 共 转 染HEK293F,5 d后收集细胞上清,通过ELISA检测所获得MAb的反应性。结果显示:在27组转染的细胞上清中,有4组样品的OD450nm值高于阴性对照组,表明这4株MAb和Gp90蛋白具有良好的反应性(图4A)(仅展示阳性结果)。随后将4株鉴定后的Gp90 MAb大批量表达及纯化并经SDS-PAGE检测(图4B),结果显示重链约50 ku,轻链约25 ku,分别为G2、G4、G5、G6。

图4 ELISA检测Gp90 MAb的反应性(A)及纯化结果(B)Fig. 4 Detection of recombinant monoclonal antibody reactivity of Gp90 by ELISA(A)and antibody purification results(B)
2.5 Gp90 MAb 的western blot 鉴定 为了进一步鉴定筛选的4 组Gp90 MAb(G2/G4/G5/G6)与Gp90 蛋白的反应性,采用western blot 检测其对过表达的Gp90 蛋白以及模拟感染模式下的天然Gp90 蛋白的识别情况。结果显示:所获得的4 株Gp90 MAb 仅在非变性的条件下,可识别出目的蛋白条带,而在变性的条件下未能检测到目的蛋白,同时本实验利用His 抗体排除了过表达Gp90 质粒未表达的干扰(图5)。表明这4 株Gp90 MAb 可以识别Gp90 的天然构象表位,而不能识别Gp90 线性表位(此处仅展示结果最显著的Gp90 G2 号MAb 的western blot 结果)。

图5 Gp90单克隆抗体的western blot分析Fig.5 Western blot analysis of Gp90 recombinant antibody
3 讨 论
EIA 严重影响和危害我国马匹动物健康,对其病原EIAV 的研究不仅可以促进对慢病毒病原学的认知,还可为慢病毒保护性免疫机制的研究提供重要模型。EIAV Env 蛋白是病毒传播及致病过程中的关键蛋白,但受限于相关抗体的缺失,对该蛋白的研究一直未能取得深层次的进展。因此,本研究首次采用FACS 技术以及抗体基因扩增技术的组合策略制备EIAV Gp90 的MAb,为Env 蛋白的进一步研究奠定了物质基础。
本研究根据B 细胞表面的特征分子,利用FACS技术从免疫小鼠的脾脏(B 细胞库)中分离到单个的可分泌抗体且具有特异性识别Gp90 蛋白功能的B 细胞890 个。虽然小鼠免疫后的抗体效价不高,但仍然从2×108个脾细胞中分选获得了890 个Gp90+B 淋巴细胞,说明本研究选择的表面分子标记物可行,但进一步从890 个Gp90+B 淋巴细胞中筛选时仅获得了27 对抗体基因对,可见本实验筛选效率并不高,根据相关研究分析,推测这可能是由于细胞表面分子标记物在本研究中应用可行,但并非最优,后续可以通过增加CD19+/CD27+/CD38+或者IgM-等表型特征进一步优化[12-13]。抗体亲和力成熟及抗体亚型转变的深入研究对于细胞表面分子标记物的选择与优化至关重要,也将为本研究通过单个B 淋巴细胞扩增技术筛选MAb 奠定理论基础。
本研究获得了27 对匹配的Gp90 MAb Ig VH 和Ig VL 基因,该方法高效省时,在短时间内获得了EIAV 囊膜蛋白Gp90 的MAb。Gp90 蛋白作为EIAV 的囊膜蛋白,其在病毒感染周期中的主要功能是与受体特异性识别,引起跨膜区构象改变,从而介导病毒侵入靶细胞[14]。因此,能否与天然构象的Gp90 蛋白结合是鉴定Gp90 MAb 生物学活性的重要指标。本研究通过ELISA、western blot 鉴定,最终得到了4 株可有效识别天然构象Gp90 蛋白的重组Gp90 MAb,证实本研究表达的Gp90 MAb可以用于后续EIAV致病机制及EIAV 弱毒疫苗作用机制等研究中。由于该方法可提供庞大的抗体候选基因库,本研究团队后续将进一步评价目前所获得的4 株Gp90 MAb 的识别表位以及抗体在动物体内的保护性作用,继续筛选具有广泛性中和作用的Gp90 MAb。
另外,本研究在重组质粒免疫小鼠后,分离脾细胞时平行进行了杂交瘤细胞的多次融合,均未获得成功(文中未表述),分析是由于重组质粒免疫后诱导产生的抗体效价水平不高,导致未能获得有效分泌MAb 的杂交瘤细胞株。而通过单个B 细胞抗体基因扩增技术却获得了Gp90 MAb,提示单个B 细胞抗体基因扩增技术对于抗原诱导抗体效价的筛选阈值要求较低,因此可有效地缩短免疫周期。
综上所述,本研究首次采用单个B 淋巴细胞扩增技术对Gp90 MAb 进行了筛选并获得的Gp90 MAb,为基于Env 蛋白的诊断试剂等生物制品的研发,以及为研究Env 的生物学特性等提供了重要工具。

