钼对绵羊瘤胃病理形态学及消化酶的影响
刘 松,马淑雅,申衍平,李世凡,王宏伟
(河南科技大学 环境与畜产品安全实验室,河南 洛阳 471023)
0 引言
不同于单胃动物,反刍动物具有更为复杂的消化器官。瘤胃作为反刍动物体内最大的消化器官为机体提供了70%的能量和60%的非氨基氮[1-2]。因此,关注瘤胃健康对于提高反刍动物生产性能至关重要。钼作为黄嘌呤氧化酶、醛氧化酶和亚硫酸氧化酶的活性成分,参与核酸、蛋白质和含硫氨基酸的代谢,是动物生长发育所必须的微量元素。然而,钼过量会诱导氧化应激、细胞焦亡和自噬[3],对肝[4]、肾[5]和生殖系统[6-7]产生毒性作用。文献[8]首次报道了反刍动物因误食高钼牧草导致钼中毒的发生,近年来在中国也发生了多起动物钼中毒事件[9]。
瘤胃是反刍动物吸收钼的主要位点[10],伴随着钼、铜、锌和硫等多种微量元素的相互作用,影响了瘤胃中微生物的生长、繁殖和群落组成结构[11]。近年来,对钼的生物学研究主要集中于线粒体毒性的机制研究和与其他金属元素的联合毒性研究[12-14],关于钼对瘤胃健康影响的相关研究几乎处于空白状态。本文通过灌喂钼酸钠建立绵羊钼处理模型,观察钼对绵羊瘤胃形态学、超微结构及消化酶的影响,为维护反刍动物瘤胃健康、提高生长性能提供理论依据。
1 材料与方法
1.1 材料
试验动物。20只5月龄健康小尾寒羊[(20.61±1.50) kg]于河南科技大学试验动物牧场进行饲养。每日7时、14时和21时饲喂绵羊全价混合日粮,自由饮水。
试验试剂。Na2MoO4·2H2O(M1003)购自Sigma公司;磷酸盐缓冲液(phosphate buffer solution,PBS)(G0002-2 L;pH7.4)、4%(质量分数)多聚甲醛溶液(G1101-500ML)、电镜固定液(G1102-100ML)和苏木素/伊红染液(G1005-100ML)购自武汉塞维尔生物公司;无水乙醇(100092683)、二甲苯(10023418)和中性树胶(10004160)购自国药集团化学试剂有限公司;α-淀粉酶测试盒(C016-1-1)、纤维素酶测试盒(A138-1-1)和乳酸测试盒(A019-2)购自南京建成生物工程研究所有限公司。
试验仪器。包埋机(JB-P5型),武汉俊杰电子有限公司;病理切片机(RM2016型)和超薄切片机(Leica UC7型),上海徕卡仪器有限公司;组织摊片机(KD-P型),浙江省金华市科迪仪器设备有限公司;正置光学显微镜(Nikon Eclipse E100型)和成像系统(Nikon DS-U3型),尼康映像仪器销售有限公司;场发射透射电镜(JEM-F200型),日本电子株式会社;紫外可见分光光度计(UV1200型),上海美谱达仪器有限公司。
1.2 方法
动物模型的建立。绵羊预饲7 d后,随机分为5组,对照组经口灌喂蒸馏水,钼处理组按体质量灌喂钼酸钠(5 mg/kg、10 mg/kg、20 mg/kg和50 mg/kg),分别命名为对照组、钼5组、钼10组、钼20组和钼50组。
样品采集。钼处理第28天晨饲前,通过胃管式瘤胃液采样器采集50 mL瘤胃液,经4层无菌无酶纱布过滤,取滤液用于消化酶的测定。瘤胃液采集完成后立即处死绵羊,采集1 cm × 1 cm瘤胃腹囊部组织,PBS冲洗后置于4%(质量分数)多聚甲醛溶液中固定,用于瘤胃上皮组织形态学观察。从瘤胃上皮组织采集瘤胃乳头,置于2.5%(体积分数)戊二醛中固定,用于瘤胃上皮细胞超微结构观察。
苏木精-伊红染色。瘤胃组织固定24 h,经修块、梯度无水乙醇脱水、二甲苯脱醇和石蜡包埋后,用组织切片机制备5 μm的连续组织切片。切片脱蜡至水,苏木精和伊红染色,观察并扫描成像。
透射电镜观察。瘤胃乳头于4 ℃固定4 h,经修块,PBS冲洗3次后,置于1%(体积分数)锇酸中室温固定2 h。再次用PBS漂洗后,脱水,环氧树脂包埋。获得50 nm超薄切片,醋酸双氧铀和柠檬酸铅染色,透射显微镜下观察瘤胃上皮超微结构变化。
消化酶活性的测定。采用南京建成生物工程研究所检测试剂盒,按照说明书流程测定瘤胃液中α-淀粉酶和纤维素酶的活性以及乳酸的浓度。
数据统计分析。数据以均数±标准差的形式显示,采用SPSS 22.0软件进行单因素方差分析检验组间差异性,Dunnett检验分析对照组与各钼处理组间差异性。
2 结果
2.1 钼对瘤胃上皮组织形态学的影响
钼对绵羊瘤胃腹囊部上皮组织形态学的影响如图1所示。对照组(见图1a)瘤胃上皮细胞排列紧密有序,细胞质均匀分布,细胞核形态结构正常。钼5组(见图1b)瘤胃上皮组织未见明显病理学损伤。随着钼剂量的增加,瘤胃上皮组织损伤加重,表现为钼10组绵羊瘤胃上皮细胞间隙增大,部分细胞质丢失,细胞核固缩和淡染(见图1c);钼20组(见图1d)瘤胃上皮细胞数量减少,细胞间隙明显增大,部分细胞间隙模糊或消失,细胞质丢失,细胞核固缩、淡染甚至消失;钼50组(见图1e)瘤胃上皮细胞数量明显减少,细胞间隙增大,部分细胞聚集成团,间隙模糊甚至消失,细胞质严重丢失,细胞核固缩。可见添加5 mg/kg以上的钼酸钠对绵羊瘤胃造成了明显的组织病理学损伤。

(a) 对照组(b) 钼5组(c) 钼10组(d) 钼20组(e) 钼50组
2.2 钼对瘤胃上皮细胞超微结构的影响
钼处理后绵羊瘤胃腹囊部上皮细胞超微结构变化如图2所示。图2中,Mi表示瘤胃上皮细胞线粒体,Nu表示瘤胃上皮细胞细胞核。对照组(见图2a)瘤胃上皮细胞线粒体双层膜完整,嵴清晰可见。与对照组相比,钼5组(见图2b)部分线粒体嵴轻度肿胀,基粒数量减少;钼10组(见图2c)和钼20组(见图2d)瘤胃上皮细胞线粒体嵴肿胀、断裂甚至溶解,基粒数目明显减少;钼50组(见图2e)损伤最严重,线粒体空泡化,双层膜断裂甚至溶解。
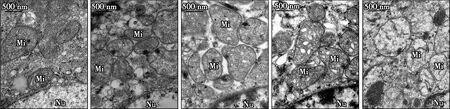
(a) 对照组(b) 钼5组 (c) 钼10组(d) 钼20组 (e) 钼50组
2.3 钼对瘤胃液中消化酶的影响
钼对绵羊瘤胃液中纤维素酶活性、α-淀粉酶活性和乳酸浓度的影响见图3。图3中“*”表示差异显著(P< 0.05),“**”表示差异极显著(P< 0.01)。与对照组相比,钼5组、钼10组和钼20组瘤胃液中纤维素酶活性显著上升(P< 0.05或P< 0.01,见图3a),尤其是钼10组,纤维素酶活性最高。与对照组相比,钼10组、钼20组和钼50组α-淀粉酶活性极显著上升(P< 0.01,见图3b),其中钼50组α-淀粉酶活性最高。与对照组相比,钼10组、钼20组和钼50组瘤胃液中乳酸浓度极显著上升(P<0.01,见图3c),其中钼50组瘤胃液中乳酸浓度最高。
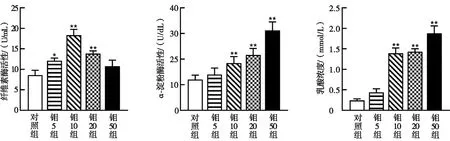
(a) 纤维素酶活性 (b) α-淀粉酶活性 (c) 乳酸浓度
3 讨论
3.1 钼对绵羊瘤胃病理形态学的影响
瘤胃上皮不仅是微生物附着、生长及其消化和代谢饲料的场所,也是物质转运、营养吸收和代谢的关键部位[15-16]。瘤胃上皮结构和功能的完整性在维持瘤胃内环境稳态中发挥着至关重要的作用。若瘤胃上皮损伤,则会导致屏障功能受损,通透性增加,有害病原菌及其代谢产生的脂多糖通过受损的瘤胃上皮吸收进入血液中,运输到机体的各组织器官,引发全身性的炎症[16]。本试验中发现添加10 mg/kg、20 mg/kg和50 mg/kg钼酸钠导致绵羊瘤胃上皮受损,这可能与过量钼降低铜和锌的生物利用度,抑制铜锌依赖的超氧化物歧化酶的活性,从而降低机体的抗氧化能力,诱导氧化应激有关[5, 17]。文献[18]报道,当机体发生氧化应激时,会引起肌动蛋白细胞骨架运动,细胞回缩,导致细胞间隙增大,这与本文的发现相一致。超微结构观察发现添加高剂量的钼导致绵羊瘤胃上皮细胞线粒体损伤,影响线粒体基粒利用呼吸链产生的能量合成三磷酸腺苷(adenosine triphosphate,ATP),导致机体供能不足,影响反刍动物的生长发育。钼诱导的线粒体损伤也影响基底层细胞参与的瘤胃上皮细胞增殖以及损伤修复的过程[19]。同时,观察到添加50 mg/kg钼酸钠导致线粒体双层膜断裂溶解。线粒体膜的破损会导致其通透性增加,诱导细胞色素C释放,激活凋亡通路,引发瘤胃上皮细胞凋亡[20],进一步加剧钼诱导的瘤胃上皮细胞的病理性损伤。
3.2 钼对绵羊瘤胃液中消化酶的影响
瘤胃微生物的组成及活力决定了消化酶的活性。本试验中,添加5 mg/kg、10 mg/kg和20 mg/kg的钼酸钠使绵羊瘤胃液中纤维素酶活性显著上升,这可能是因为钼作为亚硫酸盐氧化酶的活性位点,刺激瘤胃微生物的代谢,从而促进了饲料中粗纤维的消化[21],这与文献[22]报道结果相一致。但是添加50 mg/kg的钼酸钠并没有使纤维素酶活性发生显著变化,这可能是因为50 mg/kg的钼酸钠严重损伤了瘤胃组织病理学结构,引起瘤胃微生物菌群失调,导致与纤维降解有关细菌数量降低[23],使瘤胃液pH值降低。伴随着瘤胃pH降低[23],与淀粉降解有关的牛链球菌、反刍兽新月单胞菌、布氏普雷沃氏菌数量增多[24],这可能是钼处理后α-淀粉酶活性显著升高的原因之一。乳酸作为饲料发酵的中间产物,在瘤胃内浓度极微,但在高酸度的瘤胃内环境下牛链球菌可发酵淀粉为乳酸[25],导致瘤胃中乳酸的蓄积。钼处理组显著升高的乳酸浓度会通过诱导炎症破坏瘤胃上皮组织,加剧瘤胃内环境失衡[26],病理形态学的观察结果也支持这一推断。
4 结论
添加10 mg/kg,20 mg/kg和50 mg/kg的钼酸钠严重破坏了瘤胃上皮正常的形态结构和上皮细胞的超微结构,影响了瘤胃消化酶活性,表现为纤维素酶、α-淀粉酶活性和乳酸浓度显著上升。而钼对瘤胃中微生物及代谢产物影响,以及两者与瘤胃消化酶的联系还有待进一步研究。

