柴油机排气的O2-NO2 对碳烟氧化的协同效应
张 韦,李泽宏,陈朝辉,孙富贤,杨喜力,彭益源
(1.昆明理工大学 云南省内燃机重点实验室,云南 昆明 650500;2.昆明云内动力股份有限公司,云南 昆明 650224)
碳烟(soot)是柴油在缸内高温缺氧条件下的小分子多环芳烃(PAH)经过自由基链反应而形成,是引起雾霾、温室效应及生态环境恶化的重要诱因[1].另外,soot 的前驱体PAHs 也是毒性强烈的汽车排气污染物之一,对生物有直接蓄积性、突变性及致癌危害[2].面对全球日趋恶劣的生态环境问题,从柴油机源头降低有害的PAHs 与soot 的排放刻不容缓.
目前,柴油机颗粒捕集器(DPF)是最有效且已广泛应用的soot 控制技术[3-4],DPF 维持高效的soot 捕集效率,必须对DPF 进行适时再生,防止soot 在DPF 孔道的沉积,增加排气背压,从而影响发动机正常工作,因而DPF 内soot 再生是DPF 技术研究的关键问题.柴油机排气中O2占比约为10%,O2与soot 氧化反应温度约为873 K.但低负荷、低转速下的柴油机的排气温度在573~673 K之间,在此排气温度条件下,O2难以去除DPF 中的soot.NO2是柴油机排气中具有强氧化性的污染物,在低温条件(573 K)可与soot发生快速的氧化反应[5].针对DPF再生的研究停留于试验检测与数值模拟.Jiao 等[5]建立DPF 单孔道再生模型,研究了排气质量流量、O2与NO2摩尔分数比及温度对DPF 再生行为的影响.Lear 等[6]、Zawadzki等[7]基于程序升温解吸(TPD)与傅里叶变换红外光谱仪,分别对O2、NO2与soot 的氧化反应进行试验探究,探测出soot 氧化形成的C(O2)、C(O)、C(NO2)和C(ONO2)等表面官能物质.Setiabudi 等[8]采用热重分析结合质谱法,发现柴油机排气中O2-NO2对soot 有协同氧化作用,且协同反应对总的氧化速率的贡献达60%.Ehrburger 等[9]、Jeguirim 等[10]借助TPD技术耦合红外分析仪,研究了O2、soot 和NO2的反应,提出O2吸附于soot 可形成大量的C(O)化合物,而NO2促进C(O)化合物的分解;然而DPF 内soot的氧化再生是一系列复杂的反应过程,氧化剂(O2、NO2)及污染物(PAH、soot)共同存在,且反应速率很大程度取决于氧化剂、反应温度、soot 的结构及活性位点.因此,以上针对DPF 内O2-NO2-soot 的再生研究从宏观试验的角度,并不能清晰描述气相O2/NO2氧化剂如何在固态soot 表面扩散、吸附、表面反应及产物脱附等微观反应历程.因此,为开发先进的DPF再生技术,深入理解DPF 内soot 的氧化规律及详细反应机理不可或缺.
由于PAHs 是soot 的主要组成部分,且PAHs 的表面结构及化学性质与soot 具有相似性.因此,文献[11—13]选择PAHs 作为soot 的模型,探究了O2、NO、NO2与soot 的化学反应机理,以获得准确的soot反应的热力学与动力学数据,为开发先进排放控制技术进行理论探索.在前期的研究[13]中,笔者基于量子化学中密度泛函理论(DFT),揭示了NO2高效氧化soot 的机理,且发现C(O)是NO2氧化的一种重要的中间体,但未对计算获得的化学动力学数据做进一步分析.Raj 等[11]基于DFT 计算,主要研究了O2氧化soot 的中间体C(O2)异构化并释放CO 与CO2的反应路径,而对O2如何吸附及裂解生成C(O)过程则缺乏详细描述.上述的微观机理研究单独分析了O2、NO2与soot 的反应机理,但是DPF 再生反应是O2与NO2两种氧化剂与soot 同时作用的化学反应,且两者对soot 的氧化并不是单独进行的,而是与soot 的反应可产生相同的中间体C(O),导致其氧化反应路径是相互交叉且相互影响.因而单独分析O2或NO2的反应机理并不能反映soot 氧化的真实情况,且不能揭示O2与NO2对soot 的氧化协同作用.
为了明确DPF 内微观再生反应过程,笔者基于DFT 计算,分析了O2/NO2氧化soot 过程的竞争与协同机理,并利用过渡态理论获得的化学动力学参数,构建soot 再生表面化学反应模型,结合Chemkin-Pro 的均相反应器,对soot 的氧化进行化学动力学分析.以微观机理结合宏观分析的手段,既揭示DPF 内O2-NO2-soot协同反应机理,又可定性与定量描述soot 的氧化历程,以及在此过程中的中间产物发展与变化规律,为DPF 入口的NO2/O2摩尔浓度的控制,实现DPF内soot 高效快速再生,提供相应的理论依据.
1 基于密度泛函理论的DPF 的soot-O2-NO2反应机理研究与分析
1.1 soot模型的选择与计算方法
soot 是由多环芳烃PAHs 层堆叠而成,质谱法试验表明soot 中3 环的菲、蒽与4 环的芘质量占比最大[14],且大分子PAHs 的氧化主要由自由边进行,占PAH 的65%[11].因此,选择芘基(A4-)结构作为soot 模型,计算模拟O2与NO2的吸附特性与反应机理.量子化学计算通过软件包DMol3 完成,采用GGA/DNP+计算方法,DNP+基组与高斯型基组6-31 G**相当,可实现高精度的计算.通过几何优化结合频率分析,保证中间体结构合理且无虚频,过渡态结构存在唯一虚频值;采用Mayer 计算方法分析键的强度[15].为证实理论计算方法的可靠性,采用GGA/DNP+计算方法,给出了O2与NO2气体几何优化参数,O2中的O—O 键长为0.122 7 nm,NO2中的 O—N 键长为 0.120 8 nm,其计算数值与文献[16—17]给出的O2与NO2键长数据基本吻合.
1.2 O2-NO2对soot表面活性位的化学吸附特性与解离机理
针对O2分子与soot 氧化反应研究[10,18]主要反应模式有:(1)C()+O2→C(O)+O;(2)2 C()+O2→2 C(O).反应(1)为O2与单活性位点的反应,而反应(2)是O2与相邻的双活性位点的反应.而对NO2分子与soot 氧化研究[19],主要的反应为C()+NO2→C(O)+NO.因此,笔者对柴油机排气的O2与NO2氧化剂在soot 表面活性位的吸附特性与解离机理进行了详细分析,如图1 所示.O2与NO2气态物质及吸附物的键长与键级数据,如表1 所示.为方便描述,反应物、中间体和产物表示为“CS”,过渡态表示“TS”,序号表示反应路径上不同物质.芘表面的2个活性碳原子分别以C1*、C2*表示,O2与NO2中的O原子分别以O1、O2和O3表示.
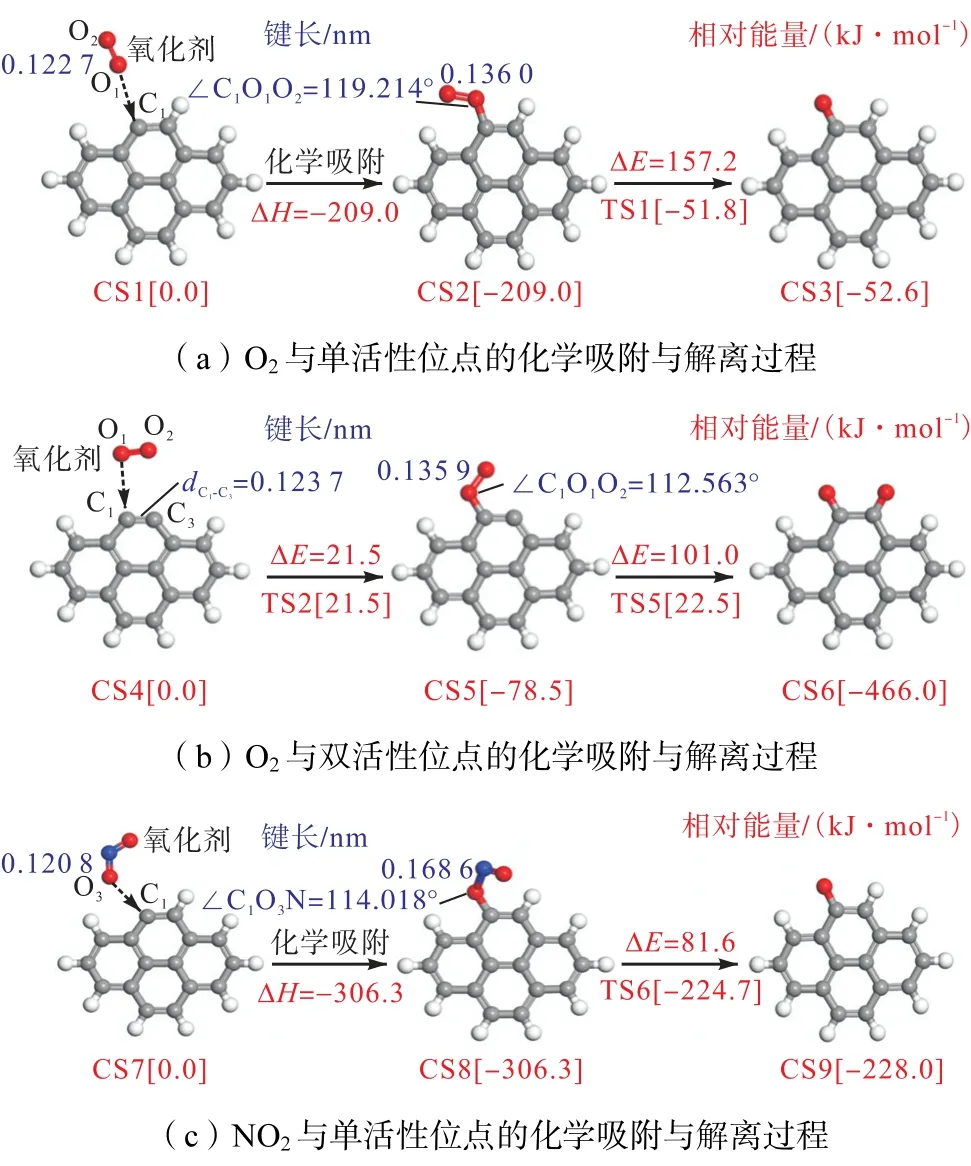
图1 O2 与NO2 的化学吸附与解离机理Fig.1 Chemical adsorption and dissociation process of O2 and NO2

表1 O2 与NO2 吸附构型的键长与Mayer键级的数据Tab.1 Bond length and Mayer bond orders of the adsorption configuration of O2 and NO2
O2与单活性位点的反应机理是:O2化学吸附于C1*原子并形成具有吸附态C1(O2)的CS2 结构,产生的∠C1O1O2夹角为119.214°,同时释放209.0 kJ/mol的能量.该吸附过程O2中的O—O 键长由气相分子的0.122 7 nm(表1 中序号1)拉伸到吸附态的0.136 0 nm(序号4),且O—O 键的键级由1.783 减小到1.107,表明吸附过程削弱了O—O 键的强度,导致吸附的O2倾向于分解.随后,CS2 需克服157.2 kJ/mol的能垒(图1 中CS2→CS3),破坏O1—O2键并释放出活性O*原子,同时在芘边缘留下C(O)化合物,该反应吸收156.4 kJ/mol 的热量.另外,该过程释放的O*具有强氧化活性,也可迅速与周围C 空位结合并形成C(O)化合物.
O2与双活性位点的反应机理是:CS4 中dC1-C3=0.123 7 nm(图1),C1*与C3*原子相距很近,两个原子相互影响,降低了活性C 原子周围对未成对电子的重组能力,使其活性大为降低,导致O2难以吸附于C*原子.因此,O2需克服21.5 kJ/mol的能量(图1中CS4→CS5),才可形成吸附态C1(O2),并需要翻越101.0 kJ/mol 的能垒(CS5→CS6),可实现C1(O2)的分解并生成C1(O)与C3(O),该分解反应释放387.5 kJ/mol的能量.从能垒的角度分析,CS5→CS6 的能垒值(101.0 kJ/mol)明显低于CS2→CS3(157.2 kJ/mol),因而反应2 C()+O2→2 C(O)明显优于C()+O2→C(O)+O,氧化反应过程中前者更占优势.以上单/双位点的A4(O2)吸附物的裂解能垒分别为 157.2 kJ/mol、101.0 kJ/mol 的能垒(CS2→CS3 与CS5→CS6),这些能垒值符合Stanmore 等[20]对soot 汽化试验给出的O2氧化soot 的活化能垒范围(102~210 kJ/mol).
NO2与碳活性位点的反应机理:NO2以∠C1O3N夹角为114.018°,化学吸附于C1*原子,形成吸附态C1(NO2),并释放出306.3 kJ/mol 的能量(图1 中CS7→CS8).该吸附过程中NO2的O—N 键明显被拉长,由气相的0.120 8 nm(序号2)拉伸到吸附态的0.168 6 nm(序号12),且O—N 键的键级逐渐变小(1.677→0.961),表明NO 逐渐从芘表面脱离.随后,CS14 仅需克服81.6 kJ/mol 的能垒值(CS8→CS9),破坏O3—N 键,形成C1(O),同时NO 分子摆脱O 原子的束缚,被释放到气相中.另外,比较 CS8 与CS2、CS5 中的芘表面活性位周围C—C 键的键级,可发现CS8 中的C1—C2、C1—C3键的键级(序号13与14)远大于CS2、CS5 中C1原子周围的C—C 键的键级,表明O2吸附于PAH 表面,对芳香环的稳定性的破坏能力高于NO2.
1.3 NO2氧化剂促进C(O)分解的反应历程分析
通过上述分析发现,O2与soot 的反应可为soot边缘提供大量的C(O)化合物.发动机排气中的O2和NO2分别对soot 的氧化均有不同的作用,NO2的主要作用是破坏O2与soot 的反应形成的C(O)的稳定性,促进其分解并释放CO 或CO2,即发生反应式为C(O)+NO2→CO+NO2/CO2+NO.通过前期研究,笔者已对NO2促进C(O)化合物分解成CO 或CO2的优势反应路径进行了探索[13],其反应机理见图2.
NO2仅克服8.8 kJ/mol 能垒(图2 中CS19→CS20),与C(O)发生快速的化合反应,变成稳定的氮基化合物C(ONO2).气相中的NO2促进C(O)化合物分解主要有:(1)NO2中的N 原子攻击C*(O).NO2中的N 原子攻击C(O)化合物中C1*原子,促进C1—C2键断开,使CS20 边缘的六元环变成开环结构,该开环反应仅需克服 77.9 kJ/mol 的能垒(CS20→CS21);(2)NO2中的O 原子攻击C(O).NO2中的O4原子将攻击C(O)中的C1*原子,加速C1—C2键断裂,该开环反应需克服53.5 kJ/mol 的能垒(CS20→CS28).Edwards 等[21]采用B3lyp/6-311 g(d,p)理论计算方法,研究了菲表面C(O)化合物的分解机理反应路径,发现自由边与锯齿边之间的C(O)分解的开环反应的能垒分别为231.0 kJ/mol、256.5 kJ/mol,对比笔者的研究,表明NO2可明显降低PAH 开环反应的活化能值.以上C(ONO2)化合物分解的两种方式的开环反应活化能也与Tighe 等[22]、Kirsten 等[23]试验测出的NO2与soot 反应的活化能((70±18)kJ/mol)一致,表明笔者计算的结果是准确、可靠的.
1.4 柴油机排气中的soot-O2-NO2协同反应机理
柴油机排气中的O2与NO2协同氧化soot 的反应机制,可分为以下3 个反应阶段.首先,气相氧化剂O2与NO2同时向soot 表面扩散,争夺有限的碳活性位点并发生化学吸附,形成吸附态 C(O2)和C(NO2).其次,soot 表面吸附的C(O2)、C(NO2)化合物发生分解,使 soot 表面形成 C(O)官能团.C(O2)与C(NO2)的分解相比,O2分子吸附于C原子,不仅分解形成C(O),还释放出高活性的O 原子,可迅速吸附于C*原子变成C(O),减少碳活性位点的数量,对NO2吸附于碳活性位造成障碍.特别是存在相邻2 个活性位时,仅需吸收较少的活化能,1个O2分子可同时形成2 个C(O)化合物,而1 个NO2分子只能产生1 个C(O)化合物.而气相中NO2分子倾向于吸附于C(O)化合物上,在soot 表面生成NO3-强氧化剂[24],导致soot 被氧化释放出CO 或CO2.因此,soot-O2-NO2协同反应的关键在于:O2为soot 表面提供C(O)化合物,而NO2的作用在于破坏C(O),释放氧化产物.soot-O2-NO2协同反应化学反应式为C+NO2+1/2O2→CO+NO2和C+NO2+1/2O2→CO2+NO.协同反应机制示意如图 3 所示.1 mol O2完全反应生成2 mol C(O)化合物,需要2 mol NO2将其完全反应,以实现soot 的快速氧化.因此,理论上氧化剂的最佳摩尔分数比M(O2)/M(NO2)=1/2.
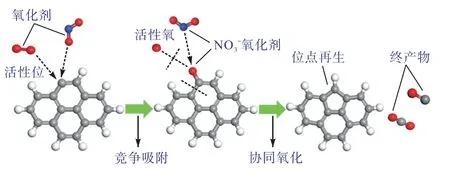
图3 O2 与NO2 竞争与协同反应机制示意Fig.3 Schematic diagram of the competition and synergistic reaction mechanism of O2 and NO2
2 基于过渡态理论的O2-NO2氧化soot 的化学反应动力学参数计算
以DFT 计算优化得到反应路径上各稳定点的反应物、过渡态的几何构型及反应物与过渡态的配分函数,频率分析确定其构型为局域极小点与鞍点.在此基础上计算出化学动力学参数,即反应活化能、指前因子及温度指数如表2 所示.采用经典过渡态理论,在300~1 000 K 的温度区间内计算反应速率常数k,其阿累尼乌斯公式[12]为
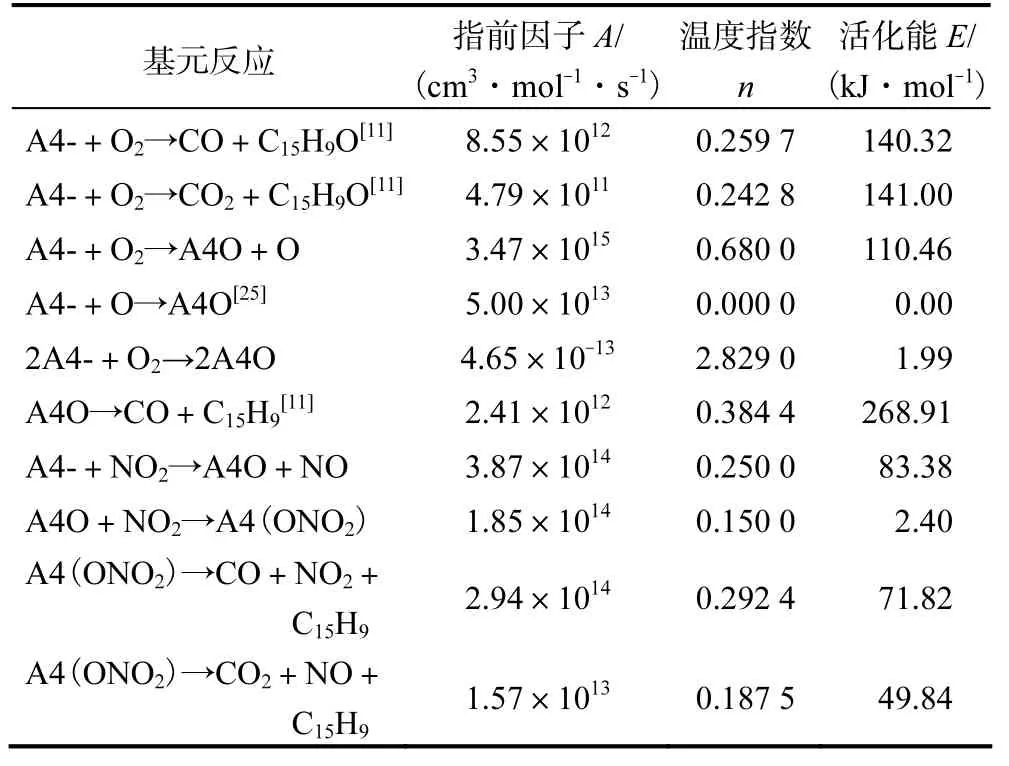
表2 O2 与NO2 的氧化反应式及反应动力学参数Tab.2 Oxidation reaction formula and kinetic parameters of O2 and NO2

式中:A 为指前因子;n 为温度指数;T 为热力学常数;R 为理想气体通用常数;Ea为活化能.
指前因子A 的计算公式为

式中:kB为玻耳兹曼常数;h 为普朗克常数;与QR分别表示过渡态与反应的配分函数.
活化能Ea的计算公式为

3 基于Chemkin 的DPF 内soot 的燃烧和排放特性的化学动力学分析
基于Chemkin 软件中的均相反应器,笔者以DFT 结合TST 计算的方法,构建soot 再生表面化学反应模型如表2 所示,并加入Golovitchev 的NOx的转化机理[26].以发动机测试获取的DPF 中氧化剂摩尔分数、温度及压力值对soot 的氧化历程进行定量的化学动力学分析.以D30 柴油机为研究对象(D30柴油机主要性能参数见表3),对加装DOC+DPF 后处理系统的发动机开展外特性稳态试验,发动机台架测试系统安装见图4.D30 柴油机的最大转矩转速为1 600~2 600 r/min,故选取柴油机的测试转速为2 000 r/min,待柴油机运行稳定后,使用气体分析仪与温度压力采集模块,分别采集DPF 前段入口处的O2摩尔分数、NO2摩尔分数和温度及压力值.测试结果:O2摩尔分数为6.68%,NO2摩尔分数为131×10-6,温度为742 K,压力为0.096 MPa.为考察不同温度对soot氧化的影响,设置温度为573、742 及873 K.为研究不同M(O2)/M(NO2)对soot 氧化的影响,设置了5组不同的M(O2)/M(NO2)方案,并采用N2替代柴油机排气的其他气体.柴油机排气组分设置方案如表4所示.

表3 D30柴油机主要性能参数Tab.3 Main performance parameters of the D30 diesel engine

图4 D30柴油机台架测试系统Fig.4 Bench test system of the D30 diesel engine

表4 柴油机排气O2 与NO2 氧化剂的摩尔分数设置方案Tab.4 O2 and NO2 oxidants component in diesel engine exhaust setting scheme
3.1 O2/NO2与A4-反应过程中A4-、A4O和A4ONO2的变化
图5 为相同摩尔分数的O2、NO2分别与A4-的氧化反应.相同摩尔分数的O2与NO2在不同温度条件下,NO2对A4-氧化性能明显高于O2,这归因于NO2活泼的化学性质,使其具有强氧化性.Stanmore等[27]测试等摩尔分数的O2与NO2对soot 的氧化速率差异,也发现反应速率r(NO2)>r(O2).

图5 相同摩尔分数的O2、NO2 分别与A4-的氧化反应Fig.5 Oxidation reaction of equal concentration of O2 and NO2 with A4-
图6 为不同温度下O2对A4O 与CO 生成的影响.由图6a 可知,温度处于低温(573 K),气相中O2只能吸附于A4 表面位点,处于A4(O2),此时的温度无法使A4(O2)裂解,导致573 K 下的A4O 的生成量极少.温度为中等温度(742 K),A4O 生成的量最多,且维持基本平衡,表明在此温度条件下吸附态的A4(O2)会大量分解为A4O,而A4O 则还未达到分解所需的活化能.温度处于高温(873 K),A4O 的量会先急剧升高,然后缓慢降低,说明高温条件足以提供A4O 自行分解的活化能,导致A4O 的量不断减少.由图6b 可知,A4O 分解生成CO 很大程度上取决于温度,随温度升高,CO 的生成量逐渐增加,即发生分解反应A4O→CO+C15H9.

图6 不同温度下O2 对A4O 及CO 生成的影响Fig.6 Influence of O2 on the formation of A4O and CO at different temperatures
图7 表示NO2与A4-反应中A4O、A4ONO2的变化.随温度的增加,NO2与A4-反应生成的A4O 逐渐增加,温度升高会使A4(NO2)更容易分解、生成A4O.而A4ONO2的变化趋势与A4O 相反,反应温度越高,A4ONO2的峰值越低,表明高温条件有利于A4ONO2分解成CO 或CO2,导致A4ONO2短暂的生成,随后迅速分解.将图7a与图6a 对比分析,发现相同温度下NO2与A4-反应产生A4O 的量大于O2,表明NO2相比O2有良好的低温反应性能.这与前文计算发现:A4(NO2)→A4O+NO(图1 中CS8→CS9)裂解所需的能垒(81.6 kJ/mol)远小于A4(O2)→A4O+O(CS2→CS3)的能垒(157.2 kJ/mol)的结论一致.

图7 不同温度下NO2 对A4O 及A4ONO2 生成的影响Fig.7 Influence of NO2 on the formation of A4O and A4ONO2 at different temperatures
3.2 不同O2/NO2摩尔分数比例对A4-氧化及终产物CO与CO2的影响
图8表示温度为742 K的不同M(O2)/M(NO2)对A4-氧化及氧化产物CO 与CO2的影响规律.在742 K的温度下,M(O2)/M(NO2)值分别为2、1和1/2 对A4-的10 s 再生效率分别为49.8%、65.8%和78.1%.这表明在柴油机排气中的M(O2)/M(NO2)值越低,即NO2摩尔分数越大,A4-的氧化速率越快,且氧化产物CO 与CO2也逐渐增加.A4-的氧化速率加快,这归因于随M(O2)/M(NO2)降低,并且越接近A4-O2-NO2协同反应的最佳组分M(O2)/M(NO2)=1/2,将导致反应倾向于协同反应机制.由于释放CO2的入口反应能垒为53.5 kJ/mol(图2 中CS20→CS28)低于释放CO 的能垒77.9 kJ/mol(CS20→CS21),从而导致随M(O2)/M(NO2)降低,CO2与CO 逐渐增多,且CO2的量大于CO.在3 组不同气体组分配比中,M(O2)/M(NO2)=1/2 对A4-氧化量最多,这与微观理论分析的最佳M(O2)/M(NO2)组分比例结论一致.

图8 不同M(O2)/M(NO2)对A4-氧化与产物CO 与CO2 生成的影响Fig.8 Influence of M(O2)/M(NO2)concentration ratio on A4-oxidation and the final products CO and CO2
4 结论
(1) O2与NO2可竞争吸附于soot 表面C*活性位,生成C(O2)与C(NO2)吸附态,前者分解的能垒显著高于后者;化学吸附可明显降低O2与NO2的键能,有利于其分解,且O2破坏PAH 的能力高于NO2;O2与双位点的吸附与裂解反应优于单位点.
(2) O2以2 C()+O2→2 C(O)反应方式为soot表面生成大量的C(O)官能团,而NO2易与C(O)生成NO3-氧化剂,以促进soot 表面的C*原子解离,实现O2-NO2对soot 的协同氧化;反应机理显示,氧化剂的最佳组分M(O2)/M(NO2)=1/2 可实现对soot的高效协同氧化.
(3) 随温度的升高,O2与NO2对A4-的氧化增强;在742 K 时,O2与A4-反应生成的A4O 的量最多;NO2与A4-反应生成的A4O 与温度呈正比;温度恒定,随着M(O2)/M(NO2)降低,A4-的再生效率增大,表明NO2摩尔分数越大,更易于触发协同机制,A4-的氧化速率也越快.
以上的结论可为开发先进DPF 的被动再生技术提供理论基础,也为精准地控制柴油机排气中M(O2)/M(NO2)组分比例提供有益的指导;但柴油机排气中的气体组分相当复杂,存在NO、H2O 气体组分对soot 氧化的影响,未来的研究需对soot 的氧化进行更深入地研究.

