高钛高炉渣富镁铝浸取液共沉淀-水热法制备镁铝水滑石*
王 澜,赵海迪,何思祺,彭同江,黄 晨,唐玉梅,王 岩
(1.西南科技大学 环境与资源学院,四川 绵阳 621010;2.广元海螺水泥有限责任公司,四川 广元 628000;3.绵阳师范学院 资源环境工程学院,四川 绵阳 621010;4.西南科技大学 矿物材料及应用研究所,四川 绵阳 621010)
0 引言
钢铁行业的产能过剩使得产生的含钛高炉渣大量堆积,增加了环境负荷[1]。高钛高炉渣含有多种有价金属,是宝贵的二次资源,但其结构复杂,回收处理较困难[2]。用硫酸处理高钛高炉渣可使其中的Ca、Mg、Al、Fe等酸溶性组分转入溶液[3-4],沸腾水解后,90%以上的钛可被提取[5]。提取钛后的溶液中仍有大量Mg、Al组分可以回收利用[6]。
溶液中Mg、Al的提取可以通过调节溶液pH的分步沉淀法实现,但沉淀产物Mg(OH)2和Al(OH)3的纯度不高[7]。沉淀法和水热法单独使用容易出现产品晶型不一致或晶相不单一现象[8],将两种方法联合使用可获得尺寸较大的晶体,同时团聚少且纯度较高[9]。
基于此,为了高附加值利用富Mg、Al浸取液中的镁铝成分,以该浸取液为原料,采用共沉淀-水热法合成镁铝水滑石。利用单因素法分析了水热温度、水热时间、溶液镁铝摩尔比对镁铝水滑石晶胞参数和晶粒大小的影响,以期为镁铝水滑石可控性制备寻找最佳操作条件。
1 试验部分
1.1 试验原料、试剂与装置
高钛高炉渣经浓硫酸焙烧、稀硫酸浸出、沸腾水解提取钛之后得到的富Mg、Al浸出液的主要金属离子组成见表1。

表1 浸取液中主要金属离子的质量浓度 单位:g/L
试剂:氢氧化钠(质量分数≥96%)、超纯水(电阻率>19 MΩ·cm)、碳酸钠(质量分数≥99.5%)、氢氧化镁(质量分数95.0%~98.0%)。
设备:不锈钢反应釜(100 mL)、pH计(pHS-3C)、集热式恒温加热磁力搅拌器(DF-101S)、电子分析天平(JF2004)、超纯水系统(UPT-Ⅱ-10)、电热恒温干燥箱(202-1)、循环水式真空泵(SHZ-DⅢ)。
1.2 试验原理与方法
碱性条件下,溶液中的镁铝离子分别与氢氧根离子结合形成无定形的镁铝氢氧化物,其在一定条件下容易转化为[Mg(OH)6]4-和[A1(OH)6]3-。生长基元之间脱水后形成Mg-O-Al键,再叠合成层状共棱的八面体结构[10]。带正电的层板通过静电作用吸附CO32-形成结构稳定的镁铝水滑石[11]。
取富含Mg2+、Al3+的浸出液50 mL,按一定镁铝摩尔比额外加入Mg(OH)2配制成悬浊液A;按n(CO32-)/n(OH-)=1/16称取Na2CO3和NaOH,将其溶于去离子水中,配制成溶液B;按1/10体积比量取A和B溶液均匀混合成溶液C,并向其中加入饱和NaOH溶液,将其pH调至12;将混合液C置于60 ℃水浴锅内,采用磁力搅拌器在25 r/min的转速下搅拌1 h。再在高压反应釜内保持试验设计温度继续反应至设计时间,反应结束降温后过滤沉淀物,并用去离子水洗涤至pH=7,最后置于65 ℃烘箱中烘干24 h,得到镁铝水滑石产物。
1.3 样品分析与表征
镁铝水滑石物相组成采用XRD测定,显微形貌采用扫描电子显微镜测定。
2 试验结果与讨论
2.1 水热温度对合成镁铝水滑石的影响
按试验方法将浸出液的镁铝摩尔比调至3.0∶1,保持水热时间为12 h、水热温度为140~190 ℃,以10 ℃为梯度升温。水热温度对镁铝水滑石合成的影响见图1。
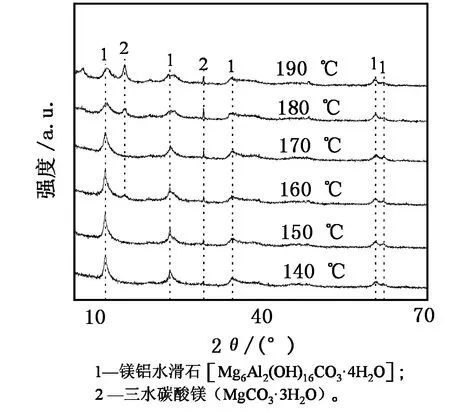
图1 不同水热温度下合成产物的XRD图谱
由图1可以看出:在170 ℃以下时特征衍射峰强度较高,峰型较尖锐;与标准卡片对比,2θ为11.6°、23.4°、34.6°、60.5°附近的衍射峰为碳酸根离子型镁铝水滑石的特征衍射峰;2θ为15°和29.5°的衍射峰为三水碳酸镁的特征衍射峰。
参照行业标准YS/T 785-2012 《NaA型沸石相对结晶度测定方法 X衍射法》中相对结晶度的计算方法得出镁铝水滑石的相对结晶度。将水热温度为150 ℃时的产物的衍射峰作为参比样品(也是所有单因素条件下相对结晶度计算的参比样品),计算合成的各样品的相对结晶度,结果如图2所示。

图2 不同水热温度下合成产物的相对结晶度
由图2可知,随着水热温度的升高,所得产物的相对结晶度升高,在160 ℃时达到峰值,之后逐渐下降。水热温度较低时,无定形氢氧化物转化为[Mg(OH)6]4-与[Al(OH)6]3-的速率较小[12]。一定范围内升高水热温度可提升转化速率,提高镁铝水滑石的相对结晶度;但温度过高会导致晶核的动能过大[13],加剧碰撞而导致晶核破坏[14]、晶体相对结晶度降低。
采用MDI Jade软件计算140~170 ℃时的晶胞参数[15],结果见表2。

表2 不同水热温度下的晶粒结构参数 单位:0.1 nm
由表2可知,晶胞参数a和c在水热温度为150 ℃时最大。理论模拟的镁铝水滑石晶胞参数a=0.313 8 nm,c=2.340 0 nm[16],本试验150 ℃时的晶胞参数最接近此理论值,晶胞最完整,因此确定本次试验的最佳水热温度为150 ℃。
沿a轴方向的d110及沿c轴方向的d003随水热温度的变化曲线如图3所示。由图3可知:晶粒尺寸随着水热温度的升高在150 ℃时取得最大值,之后逐渐减小;径厚比d110/d003随着水热温度的升高而增大,这有利于形成高硬度和低韧性的镁铝水滑石层板。

图3 沿a轴方向和沿c轴方向的晶粒尺寸随水热温度的变化曲线
2.2 水热时间对合成镁铝水滑石的影响
按试验方法,将浸取液镁铝摩尔比调至3.0∶1,保持水热温度为150 ℃,分别在水热时间为12、13、14 h时进行试验,结果见图4、图5、表3。

图4 不同水热时间下合成产物的XRD图谱

图5 不同水热时间下合成产物的相对结晶度

表3 不同水热时间下的晶粒结构参数 单位:0.1 nm
由图4、图5可以看出:各水热时间下的合成产物都是以镁铝水滑石为主物相,随着水热时间的延长,镁铝水滑石的相对结晶度升高。由表3可知:当水热时间延长至14 h时,晶胞参数a和c均接近理论模拟的镁铝水滑石晶胞参数,所得镁铝水滑石的晶体规整度有所提高。因此确定本次试验的最佳水热时间为14 h。
随着水热时间的延长,晶体变大,同时整个体系的结构更趋于完整[17]。试验范围内,14 h的晶体生长时间所得晶体更为完整,但在每一个反应时间中均存在MgCO3·3H2O的特征衍射峰。水热时间延长后,MgCO3·3H2O的特征衍射峰峰数增加,说明延长水热时间无法抑制MgCO3·3H2O的形成,需考虑优化其他反应条件。
2.3 镁铝摩尔比对合成镁铝水滑石的影响
按试验方法,保持水热温度为150 ℃,水热时间为14 h,调节浸取液镁铝摩尔比。图6、图7为镁铝摩尔比对合成产物的影响试验结果。

图6 不同镁铝摩尔比下合成产物的XRD图谱

由图6可以看出:随着镁铝摩尔比的增大,镁铝水滑石的衍射峰强度增大;但当镁铝摩尔比增大至3.0∶1时,产物中出现了MgCO3·3H2O,此时镁已过量,过量的Mg与体系中的CO32-反应生成了杂质MgCO3[18]。由图7可以看出:合成产物的相对结晶度随着镁铝摩尔比的增大呈先升高后降低的趋势;镁铝摩尔比为2.5∶1时最高。
不同镁铝摩尔比下的晶粒结构参数见表4。由表4可知:晶胞参数a和c也在镁铝摩尔比为2.5∶1时最大,且最接近理论模拟的镁铝水滑石晶胞参数。故确定本次试验的最佳镁铝摩尔比为2.5∶1。

表4 不同镁铝摩尔比下的晶粒结构参数 单位:0.1 nm
3 优化条件下所得镁铝水滑石的表征
以上通过单因素法考查了水热温度、水热时间、溶液镁铝摩尔比对镁铝水滑石合成的影响,并通过对相对结晶度和晶体结构的对比分析,确定了优化试验条件,即水热温度为150 ℃,水热时间为14 h、溶液镁铝摩尔比为2.5∶1。图8为优化试验条件下制得的镁铝水滑石的SEM图。由图8可以看出,此条件下镁铝水滑石的相对结晶度和晶型完整度均较高;微观形态为不规则片状结构,粒径为0.5~2.0 μm,无“sand-rose”形貌。

图8 优化试验条件下制得的镁铝水滑石的SEM照片
4 结论
a.升高水热温度有利于晶体沿径向生长,随着水热温度的升高,镁铝水滑石的相对结晶度呈现先升高后降低的趋势,一定范围内升高水热温度可提高产物的相对结晶度以及控制晶体生长的完整性。温度过高,不利于后期的陈化结晶,相对结晶度降低。
b.延长水热时间有利于晶体结构的生长,但会导致MgCO3·3H2O的特征衍射峰峰数增加,试验范围内延长水热时间无法抑制MgCO3·3H2O的形成。
c.适当增大镁铝摩尔比有利于镁铝水滑石的结晶,溶液中镁过量会导致镁铝水滑石纯度降低,过量的Mg会与体系中的CO32-反应生成杂质进入镁铝水滑石中,反而降低相对结晶度和晶体完整性,生产中应严格控制镁铝摩尔比。
d.以提取钛后的富Mg、Al浸取液为原料,采用共沉淀-水热法制备了镁铝水滑石,在水热温度为150 ℃、水热时间为14 h、镁铝摩尔比为2.5∶1时制备的镁铝水滑石的纯度、相对结晶度和晶型完整度均较高。微观形态为不规则片状结构,粒径为0.5~2.0 μm。

