酱鸭中优势背景菌群对金黄色葡萄球菌生长影响的预测模拟
张子叶,闫晓彤,王晔茹,丁 甜,王 军,王 翔,董庆利,方 婷,李长城*
(1 福建农林大学食品科学学院 福州 350002 2 国家食品安全风险评估中心 北京 100022 3 浙江大学生物系统工程与食品科学学院 杭州 310030 4 青岛农业大学食品科学与工程学院 山东 青岛 266109 5 上海理工大学健康科学与工程学院 上海 200093)
预测微生物学模型以数学和计算机语言为基础,描述食品中微生物的生长、失活规律,是微生物定量风险评估的基础[8-9]。目前,国内外已有关于生鲜猪肉[10-11]、广式腊肠[12]、烤鸭[13]、牛奶[14]等畜禽产品中金黄色葡萄球菌生长预测模型的研究,而未见有关酱鸭制品中预测微生物学模型的报道,且上述文献中关于金黄色葡萄球菌的生长预测建模均未考虑食品基质中背景微生物对其生长的影响。文献研究表明,食品中微生物的生长除受环境因子(温度、水分活度、pH 值)的影响外,还可能受其它种类微生物的制约[15-17],构建基于菌间竞争效应的相互作用模型可以更准确地描述目标微生物的生长。另外,从数值分析的角度,上述文献中金黄色葡萄球菌模型的构建均基于传统的两步法,相比于该领域近年来提出的一步法,其累积误差更大[18]。使用一步法建模,将可缩小累积误差,提高模型准确度[19]。
本研究拟研究酱鸭中金黄色葡萄球菌单独生长或与背景菌群共同存在时的生长特性,采用一步法构建酱鸭中金黄色葡萄球菌与背景菌群的生长预测模型,旨在为有效监控以酱鸭为代表的熟肉制品中金黄色葡萄球菌的风险评估提供参考。
1 材料与方法
1.1 材料与试剂
酱鸭,福州山姆会员超市。金黄色葡萄球菌(Staphylococcus aureus,S.aureus)菌株(CICC10786、CICC10787),中国工业微生物菌种保藏管理中心(CICC)。
利福平(Rifampin,Rif),北京索莱宝科技有限公司;胰酪大豆胨琼脂培养基(Tryptose soya agarmedium,TSA)、脑-心浸出液肉汤(Brain heart infusion broth,BHI),广东环凯微生物科技有限公司;蛋白胨粉,杭州微生物试剂有限公司。
1.2 仪器与设备
Bag Mixer-400 均质拍打器,法国Interscience公司;H-1850R 高速冷冻离心机,湖南相仪实验室仪器有限公司;SHP-250 细菌生化培养箱、LDZX-75KBS 立式压力蒸汽灭菌器,上海精宏实验设备有限公司;AIRTECH 生物安全柜,苏州安泰空气技术有限公司;KB115 低温恒温箱,德国BINDER公司;Whirl-Pak-207 mL 无菌均质袋,美国Nasco公司;VORTEX-5 漩涡混合器,上海习仁科学仪器有限公司。
1.3 试验方法
1.3.1 金黄色葡萄球菌培养与接种菌液的制备参照Fang 等[20]的方法,使用利福平逐步诱导金黄色葡萄球菌,获得对利福平耐受质量浓度为100 mg/L 的抗性菌株,并划线于利福平添加质量浓度为100 mg/L 的TAS 平板(TSA/R)培养,再于8 ℃保存。每次试验前,挑取2 株金黄色葡萄球菌的单菌落,分别转移至10 mL 利福平添加质量浓度为100 mg/L 的BHI 中,于37 ℃培养18~20 h。菌液于4 ℃条件下5 000 r/min 离心15 min,去掉上清液,菌体经无菌蛋白胨水(质量分数0.1%)清洗2次后,分别悬浮于5 mL 蛋白胨水中。将2 株金黄色葡萄球菌悬浮液按1∶1 的体积比混合,梯度稀释至~4.5 lg(CFU/mL),备用。
1.3.2 背景菌株分离及接种菌液的制备 在无菌条件下,称取(5±0.05)g 酱鸭样品置于均质袋中,加入20 mL 0.1%蛋白胨水,于均质拍打器中正、反两面各拍打2 min,均质液经梯度稀释后涂布于TSA 平板上,并于37 ℃培养18~24 h。从TSA 平板上挑取不同形态的典型菌落,经连续分离纯化后获得3 株优势背景菌株 (编号BG-1、BG-2、BG-3)。背景菌株经TSA 平板划线后保存于8 ℃培养箱。每次试验前,挑取单菌落接种至10 mL BHI 溶液中,37 ℃培养18~20 h,菌液于4 ℃条件下离心(5 000 r/min)15 min,菌体再经无菌蛋白胨水(0.1%)清洗2 次后,分别悬浮于5 mL 蛋白胨水中。3 株背景菌液等量混合后,梯度稀释至~5.5 lg(CFU/mL),备用。
(7)混煮。将过滤好的胶液加入姜汁和糖液混合液中,加热并充分搅拌均匀,在此基础上加入柠檬酸和β-环状糊精,继续加热,在微沸腾的状态下搅拌1 min。
1.3.3 样品接种 将酱鸭去皮、去骨,抽真空(2 kPa)包装,并于115 ℃杀菌15 min,以消除样品中的背景菌群。冷却后在无菌环境下将其切分,称取(5±0.05)g 若干份样品,装入无菌均质袋中。将称取的样品分为两大组,其中一组样品单独接种上述已制备的金黄色葡萄球菌悬浮液 (0.1 mL),另一组样品混合接种上述已制备的金黄色葡萄球菌和背景菌群悬浮液(各0.1 mL)。两组接种方式样品中,金黄色葡萄球菌的浓度均约102.5~103.0CFU/g,混合接种的样品中背景菌群的浓度约103.5~104.0CFU/g。
1.3.4 生长实验与取样计数 将接种后的样品分别置于10,12,16,20,25,30 ℃的恒温培养箱中培养,按预设时间间隔取样,以测定其生长浓度。取样时,向样品袋中加入20 mL 无菌蛋白胨水,并置于均质拍打器中正、反两面各拍打2 min。根据实际情况,将均质液经梯度稀释,并吸取合适稀释度下的均质液0.1 mL 或1 mL 涂布于TSA/R[20]培养基或TSA 培养基,其中,TSA/R 平板用于测定金黄色葡萄球菌菌落数,TSA 平板用于测定背景菌菌落数。将涂布后的平板置于37 ℃条件下培养,24 h 后计数,单位为lg(CFU/g)或ln(CFU/g)。所有生长试验均至少独立重复2 次。
1.4 生长模型
1.4.1 酱鸭中金黄色葡萄球菌的非竞争生长 金黄色葡萄球菌接种至灭菌的酱鸭样品单独培养时,因不受其它微生物的影响,其生长行为可用式(1)所示的微分方程进行描述,式(1)即Huang 模型[21],可用于包含迟滞期、对数期和稳定期的微生物生长描述。

式中,Y、Ymax——t 时刻和稳定期的细菌浓度,ln(CFU/g);μmax——细菌最大比生长速率(h-1);λ——迟滞期(h)。
温度对酱鸭中金黄色葡萄球菌最大比生长速率的影响可用Huang Square-Root(HSR)模型[22]予以描述,其表达式如式(2)所示;最大比生长速率与迟滞期的关系可用式(3)表示。

式中,T——环境温度(℃);Tmin——细菌的最低生长温度(℃);a、A 和m——回归系数。
1.4.2 酱鸭中金黄色葡萄球菌与背景菌群的竞争生长 当背景菌群与金黄色葡萄球菌混合接种于酱鸭样品共同生长时,由于前者本身是酱鸭样品中的优势分离菌株,一般更能适应样品的环境条件。另外,前者的初始浓度高于后者的初始浓度,由生长数据的直观体现可知,酱鸭样品中金黄色葡萄球菌与背景菌群共同生长时,未能完全表现其生长潜力,可能受到背景菌群的抑制作用。因此,本文假设酱鸭中金黄色葡萄球菌的生长受到背景菌群的单向抑制,其生长规律可由式(4)(根据Lotka-Volterra(LV)方程演化而来)表示[23-24];另外,背景菌群的生长受金黄色葡萄球菌的影响很小,忽略竞争效应和迟滞期,其生长规律可由式(5)表示。

式中,S 和B——金黄色葡萄球菌(S.aureus)和背景菌群 (Background microflora);Y、λ、μmax与式 (1) 相同;Ymax——酱鸭样品的最大载菌量,ln(CFU/g)。式(4)中的α×exp(YB)一项代表背景菌群对金黄色葡萄球菌的抑制效应,α——抑制系数。
竞争生长中,温度对金黄色葡萄球菌和背景菌群生长速率的影响仍可由HSR 模型来描述,分别如式(6)、式(7)所示。

式中,下标S 和B——金黄色葡萄球菌和背景菌群;Tmin和a 与式(2)相同。
1.5 数据处理与分析
将2 次独立试验下,不同恒定温度对应的试验数据合并成数据集{Y},通过一步法[18,24]估计细菌的生长动力学参数。若将初级模型和二级模型中待求的参数和系数记为{P},则酱鸭中金黄色葡萄球菌单独接种生长时,{P}={a,Tmin,A,m,Ymax};金黄色葡萄球菌和背景菌群混合接种生长时,{P}={aS,aB,Tmin,Tmin,B,A,m,Ymax,α}。本研究数值分析过程通过MATLAB 2018 软件编程来实现,分析过程中,采用四阶龙格-库塔法求解微分方程(1)或(4)、(5),获得细菌生长浓度的预测值{},再结合最小二乘法求解预测值{}与实测值{Y}之间的最小残差平方和(RSS)[25],其表达式如式(8),式中,n——总观察值的数量。当RSS 最小时,对应的{P}即为所求。

1.6 模型验证
通过另设不同温度条件下的生长试验,对模型和参数进行验证,采用均方根误差(RMSE)衡量预测值与观测值之间的差异,其表达式如式(9)。式中,n——观测值总数;p——模型中参数数量。

2 结果与分析
2.1 动力学参数估计与模型构建
2.1.1 金黄色葡萄球菌单独接种至酱鸭中的非竞争生长 本研究将金黄色葡萄球菌单独接种至已灭菌处理的酱鸭样品中,以考察其不受背景菌群干扰时的生长状况。试验时,酱鸭样品中金黄色葡萄球菌的初始接种浓度约为2.5~3.0 lg(CFU/g)。10 ℃贮藏时,在观测时间内(288 h),酱鸭样品中金黄色葡萄球菌的数量未见有显著增长(图1中未显示)。在12,16,20,25,30 ℃贮藏时,酱鸭样品中金黄色葡萄球菌的生长良好,总体呈S 型增长趋势;在观测时间内,除12 ℃贮藏条件下的最大生长浓度偏低以外,其余温度对应的生长曲线均包含滞后期、对数期及稳定期3 个阶段(图1)。因此,本研究仅将12,16,20,25,30 ℃条件下酱鸭样品中金黄色葡萄球菌的生长数据合并,再开展建模分析。

图1 酱鸭中金黄色葡萄球菌生长曲线一步法拟合分析Fig.1 One-step analysis of growth curves of S.aureus in sauced duck
通过一步法对12~30 ℃条件下酱鸭中金黄色葡萄球菌的生长数据(共计151 个数据点)进行分析,构建包含初级模型(Huang 模型)和二级模型(HSR 模型)的组合模型,求解最低生长温度、最大生长浓度、二级模型系数等参数,即{P}={a,Tmin,A,m,Ymax},其结果如表1所示。
由表1可知,构建的Huang-HSR 模型的均方根误差(RMSE)为0.47 lg(CFU/g),5 个生长参数的估计值均达到显著水平(P<0.05)。通过一步法估计酱鸭中金黄色葡萄球菌的最大生长浓度为21.63 ln(CFU/g),或9.39 lg(CFU/g),最低生长温度为9.28 ℃,其95%置信区间为 [8.95 ℃,9.61℃]。酱鸭中金黄色葡萄球菌最低生长温度的估计值及其置信区间的上限均略低于10 ℃,然而这并不与前述提及的10 ℃贮藏条件下,金黄色葡萄球菌的数量未见显著增长的现象相矛盾。本研究中,10 ℃条件下的测试时长(288 h)相对较短,而将a、A 和m 的估计值 (0.076,0.824 和1.301) 代入式(2)、式(3)可计算得10 ℃对应的迟滞期约为2 000 h,或83 d,这远大于酱鸭产品的货架期,因此,可以认为10 ℃条件下酱鸭中金黄色葡萄球菌不能正常生长。邹彦桐[12]、宇盛好等[13]、张微等[1]分别研究了广式烧腊、烤鸭和盐水牛肉中金黄色葡萄球菌的生长规律,其研究表明,10 ℃贮藏条件下,金黄色葡萄球菌仍能生长,这可能与食品基质不同有关,本研究所用的酱鸭样品在卤制加工过程中吸收的辛香料或其它添加成分可能对金黄色葡萄球菌的生长具有抑制作用。将一步法求解的参数{P}代入式(1)、式(3),可正向计算出各试验温度条件下酱鸭样品中金黄色葡萄球菌生长的预测曲线(图1),由图1可知,模型预测值与试验观测值相近,说明所构建的Huang-HSR 模型能够较准确地描述酱鸭中金黄色葡萄球菌的生长。

表1 酱鸭中金黄色葡萄球菌非竞争生长一步法分析结果Table 1 One-step analysis of non-competitive growth of S.aureus in sauced duck
2.1.2 金黄色葡萄球菌与背景菌群混合接种至酱鸭中的竞争生长 将金黄色葡萄球菌与分离的优势背景菌群混合接种至无菌酱鸭中,以考察两者之间的竞争效应。不同培养温度(12~30 ℃)条件下,两者的生长曲线如图2所示。混合接种生长试验中,金黄色葡萄球菌和背景菌群的初始浓度分别为2.5~3.0 lg(CFU/g)和3.5~4.0 lg(CFU/g)。由图2可知,各温度条件下,样品中背景菌群生长良好,且与金黄色葡萄球菌相比,背景菌群的迟滞期不明显或可忽略不计,接种后即可快速进入对数生长期,当其生长浓度达到约10 lg(CFU/g)时,进入稳定期,这表明背景菌群更能适应酱鸭样品的环境,其生长受金黄色葡萄球菌的影响较小。同时,如图2所示,金黄色葡萄球菌的生长曲线具有显著的迟滞期,且通过图形的直观对比可知,进入对数生长期之后,其生长速率均不同程度地小于背景菌群的生长速率,其生长浓度也始终低于背景菌群的生长浓度;当背景菌群的生长进入稳定期后,金黄色葡萄球菌的生长速率显著降低,其数量随着时间的延长而缓慢增长。因此,在混合接种的酱鸭样品中,金黄色葡萄球菌的生长受到背景菌群的抑制,且两者之间的竞争关系主要表现为后者对前者的单向抑制。

图2 酱鸭中金黄色葡萄球菌与背景菌群竞争生长一步法拟合分析Fig.2 One-step analysis of the competitive growth curves of S.aureus and background microflora in sauced duck
通过一步法对酱鸭中金黄色葡萄球菌和背景菌群的竞争生长数据(共计308 个数据点)进行分析,构建包含竞争模型和二级模型的组合模型,求解最大生长浓度、最低生长温度、二级模型系数和抑制效应系数等参数,即{P}={aS,aB,Tmin,Tmin,B,A,m,Ymax,α},其结果如表2所示。由表2可知,构建的LV-HSR 模型均方根误差(RMSE)为0.51 lg(CFU/g),8 个参数的估计值均达到显著水平(P<0.05)。通过一步法估计的金黄色葡萄球菌和背景菌群的最低生长温度分别为9.40 ℃和7.80 ℃,其中,关于金黄色葡萄球菌最低生长温度的预测与前述非竞争生长试验中预测的最低生长温度(9.28 ℃)几乎一致;估计的背景菌群的最大生长浓度 (即酱鸭样品的最大载菌量) 为22.87 ln(CFU/g),或9.93 lg(CFU/g),与前述非竞争生长试验中预测的金黄色葡萄球菌的最大生长浓度21.63 ln(CFU/g),或9.39 lg(CFU/g)相接近;此外,背景菌群对金黄色葡萄球菌的抑制效应系数为0.556。
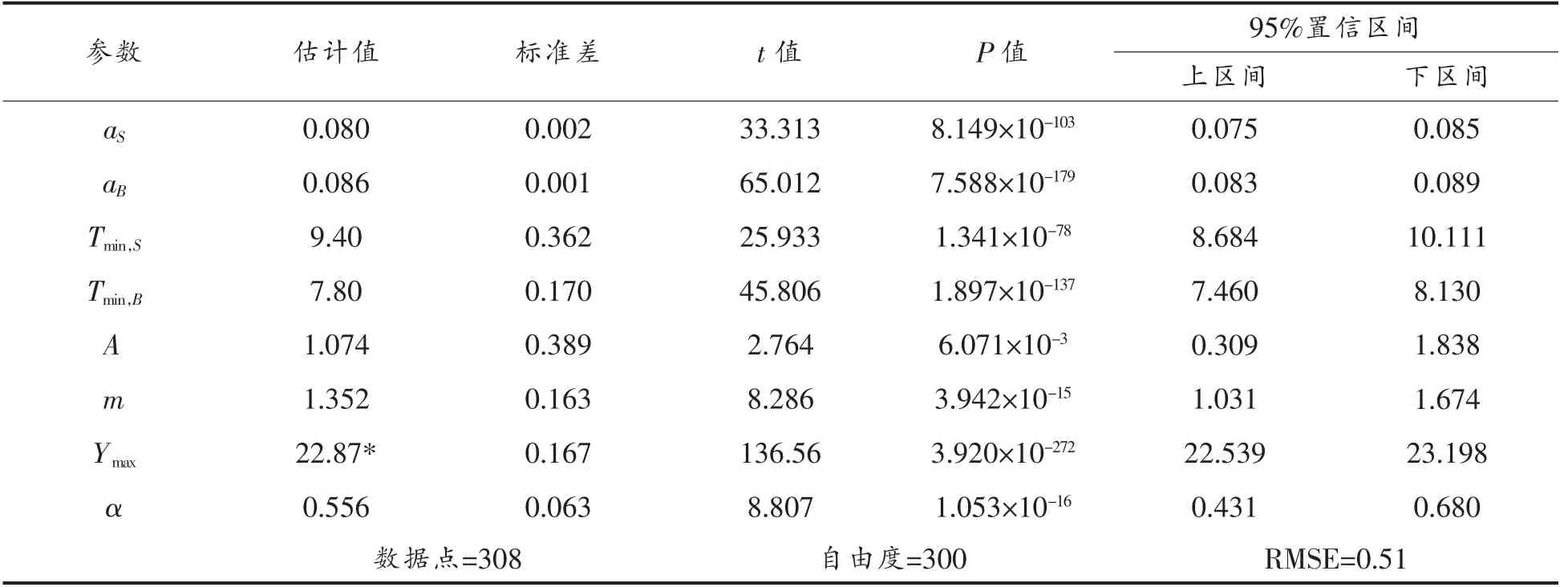
表2 酱鸭中金黄色葡萄球菌与背景菌群竞争生长一步法分析结果Table 2 One-step analysis of competitive growth of S.aureus and background microflora in sauced duck
2.1.3 迟滞期及生长速率比较分析 图3比较了温度对单独接种和混合接种状态下金黄色葡萄球菌的迟滞期及生长速率的影响。由图3a 可以看出,在同等温度条件下,非竞争状态下的金黄色葡萄球菌其迟滞期要低于混合接种状态下的金黄色葡萄球菌,表明背景菌群对金黄色葡萄球菌存在抑制效应。图3b 再次表明,金黄色葡萄球菌与背景菌群竞争生长过程中,前者的生长速率小于后者的生长速率,同时竞争状态与非竞争状态下的金黄色葡萄球菌的生长速率无显著差异,如前所述,当背景菌群的生长进入稳定期后,金黄色葡萄球菌的生长速率会显著降低,其数量随时间的延长而缓慢增长。图3b 还将本研究中金黄色葡萄球菌的生长速率与相关文献报道结果进行对比。当温度大于15 ℃时,本研究结果与广式烧腊[12]、烤鸭[13]、盐水牛肉[1]中金黄色葡萄球菌的生长速率相近,然而当温度低于15 ℃时,其生长速率低于上述文献报道结果。产生这种差异的原因有二,其一,正如前所述,金黄色葡萄球菌在酱鸭上与上述文献报道的产品中的生长本身存在差异;其二,本研究选择的二级模型(式2)和上述文献选择的二级模型[26][=a(T-T0)]不同,前者中Tmin为细菌的实际最低生长温度,而后者中T0为表观最低生长温度,一般而言,Tmin>T0[27]。
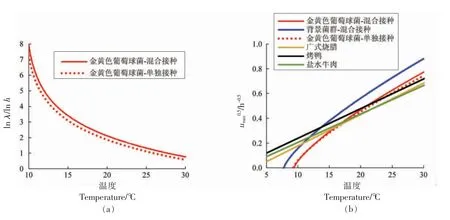
图3 金黄色葡萄球菌迟滞期(a)及生长速率(b)的比较分析Fig.3 Comparative analysis of lag time (a) and growth rate (b) of S.aureus
2.2 模型验证
2.2.1 非竞争模型验证 本研究构建酱鸭中金黄色葡萄球菌的非竞争生长模型时,因10 ℃条件下观测期内未见显著生长,仅选取12~30 ℃的数据用于一步法分析,而10 ℃条件下的数据仍可用于模型验证,图4表明模型预测值与试验观测值相接近,RMSE 为0.16 lg(CFU/g)。此外,本研究还通过另设的恒温条件下酱鸭中金黄色葡萄球菌的生长试验(20 ℃) 来验证模型和所求解参数的准确性,由图4可知,模型的预测值与观测值的差异较小,其RMSE 为0.56 lg(CFU/g),表明一步法构建的非竞争模型可准确地预测无菌酱鸭中金黄色葡萄球菌的生长。
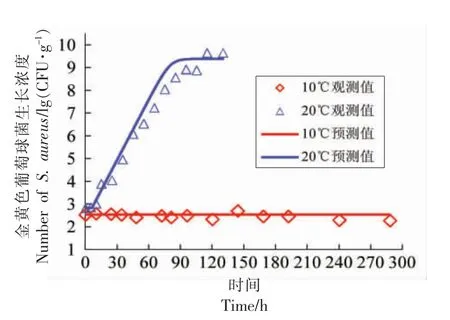
图4 非竞争模型验证:不同温度条件下酱鸭中金黄色葡萄球菌的生长Fig.4 Validation of the non-competitive model:growth curves of S.aureus in sauced duck at different temperatures
2.2.2 竞争模型验证 本研究通过另设13 ℃和20 ℃条件下酱鸭中金黄色葡萄球菌与背景菌群混合接种的生长试验来验证所构建的竞争模型及其参数的准确性(图5)。图5a 和图5b 分别比较了13 ℃和20 ℃条件下金黄色葡萄球菌和背景菌群竞争生长时,模型预测值和实测值之间的差异,由图可知,其差异较小,均方根误差(RMSE)分别为0.49 lg(CFU/g)和0.63 lg(CFU/g),表明所构建的模型可较为准确地描述酱鸭中金黄色葡萄球菌与背景菌群的竞争生长。

图5 竞争模型验证:13 ℃(a)和20 ℃(b)条件下酱鸭中金黄色葡萄球菌和背景菌群的生长Fig.5 Validation of the competitive model:growth curves of S.aureus and background microflora in sauced duck at 13 ℃(a) and 20 ℃(b)
3 结论
本文考察了不同温度条件下,金黄色葡萄球菌单独接种或与背景菌群混合接种至酱鸭中的生长特性,并通过一步法构建包含初级模型(非竞争或竞争模型)和二级模型的组合模型;无菌酱鸭样品中单独接种金黄色葡萄球菌时,由非竞争模型估计的金黄色葡萄球菌的最低生长温度为9.28℃,最大生长浓度为9.39 lg(CFU/g);与非竞争状态相比,金黄葡萄球菌与背景菌群混合接种时的迟滞期略长,最大比生长速率无显著差异,然而当背景菌群的生长进入稳定期时,金黄色葡萄球菌的生长速率显著降低,表现出抑制效应(抑制效应系数α=0.556);竞争状态下,由竞争模型估计的金黄色葡萄球菌和背景菌群的的最低生长温度分别为9.40 ℃和7.80 ℃,背景菌群的最大生长浓度为9.93 lg(CFU/g);验证试验表明构建的模型能够较为准确地预测酱鸭中金黄色葡萄球菌的非竞争生长及其与背景菌群的共同竞争生长。综上所述,一步法是预测微生物学建模的有效分析方法,本文所构建的预测模型可用于描述酱鸭中金黄色葡萄球菌和背景菌群的生长,为相关产品中金黄色葡萄球菌的定量风险评估及货架期的预测提供理论支持。

