咖啡园土壤硝化作用研究
黄广一,喻好好,李世钰,2,黄家雄,吕玉兰,何飞飞**
(1.云南大学 农学院,云南 昆明 650500;2.云南省瑞丽市农场管理委员会,云南 瑞丽 678600;3.云南省农业科学研究院 热带亚热带经济作物研究所,云南 保山 678000)
硝化作用是土壤氮素转化的关键过程,决定着植物可利用氮素形态的数量和相对比例.就农业生产和环境保护领域而言,硝化过程产生的NO3−极易淋失并造成水体污染;NO3−是反硝化作用的底物,土壤中NO3−的增加会加速土壤氮素的气体损失和温室气体N2O 的排放,氮素流失也导致氮肥的使用量增加,生产成本上升;硝化过程H+的释放和累积可引起土壤酸化,继而导致土壤退化并使作物减产[1].因此,了解硝化过程及影响硝化作用的主导因素,对生态系统健康和农业生产力提高都有重要意义.
酸性土壤的硝化活性一般较弱[2-3],但长期施用氮肥和有机肥会明显提高酸性土壤硝化活性[4-5],导致酸化加剧[6-7].因此,深入研究酸性土壤硝化作用,是退化土壤修复和土壤质量提升的重要基础.咖啡是云南重要的经济作物,种植面积和产量占全国的98%以上[8],是云南省热区边疆农民的主要收入来源之一,对云南省的经济社会发展和边疆乡村振兴具有重要影响.有研究表明,云南咖啡主产区超过50%的土壤pH 值已低于适宜范围5.5~6.5[9],土壤酸化趋势明显.云南咖啡产区气温高,雨量大,高温多雨会加快土壤氮素转化,硝化作用强烈[10-12],由此带来的氮素损失和土壤酸化风险较高.因此以咖啡园土壤为典型材料开展硝化作用研究,通过测定净硝化速率和氨氧化微生物,阐明云南热区咖啡园土壤硝化作用特征及其关键影响因子,能为该区域防治土壤酸化提供科学依据,预期成果还可以为其它类型土壤酸化研究提供参考.
1 材料与方法
1.1 土壤采集区概况云南热区总面积81 110 km2左右,占云南省土地总面积的21%,≥10 ℃年积温6 000 ℃以上,年平均气温≥17.5 ℃,年降雨量600~2 700 mm,5—10 月为雨季,降雨量占全年的86%,年日可照时数1 750~2 250 h.土壤类型主要是砖红壤、赤红壤、燥红壤和褐红壤,pH=4.1~6.5.
云南咖啡产区主要分布在怒江、澜沧江、红河、金沙江等流域海拔500~1 800 m 之间的热区,南部与越南、老挝、缅甸接壤,北部抵达金沙江流域.土壤采集区域设置在保山市潞江坝和德宏州芒市.保山市潞江坝是南亚热带干热河谷气候,德宏州芒市属于南亚热带季风湿热气候.
1.2 土壤样品采集2017 年咖啡采摘结束后,选择种植年限5~20 a 咖啡园土壤,按S 形取样法取10 个点合成1 个混合样,每块取样地重复采集3 次,采集深度0~20 cm 耕层.采集的土样存于冰盒中带回实验室,存于4 ℃冷库中备用.供试土壤基本情况见表1.

表1 供试土壤基本信息和理化性质Tab.1 Basic information and physicochemical properties of the soil samples
1.3 土壤硝化作用培养实验将保存于4 ℃冷库中备用的新鲜土样取出,称取40 g 置于250 mL 三角瓶中,调节土壤含水量至45%最大持水量,用透气保水膜封口,在30 ℃黑暗条件下预培养1 周以激活微生物,每个处理重复3 次.预培养结束后的土样中加入硫酸铵,铵态氮(NH+−N)添加量为20 mg·kg−1,同时把土壤含水量调至60%最大持水量,于30 ℃黑暗条件下继续培养,在第0、1、2、4、7 d 测定土样中的NH4+−N、硝态氮(NO3−−N)质量比,其中0 d 为加入硫酸铵2 h 后采样,净硝化速率计算见文献[13].
1.4 土壤性质和DNA 分析全氮:凯氏定氮法;有机碳:低温外热重铬酸钾−容量法测定有机质,参考张维理等[14]计算方法将有机质换算成有机碳;速效钾:乙酸铵提取−火焰光度计法;有效磷:碳酸氢钠浸提−钼蓝比色法;土壤pH∶液土质量比为5∶1,pH 仪 (inolabpH7300) 测定.土壤NH4+−N∶按液土质量比5∶1 加入100 mL 浓度为2 mol·L−1KCl 浸提,靛酚蓝比色法测定;土壤NO3−−N:紫外分光光度法测定[15];土壤最大持水量:把过20 目筛(孔径0.85 mm)的风干土样20 g 置于用棉球塞住的漏斗中,加去离子水浸泡2 h,加盖,除去棉塞,让水分自由下渗,放置过夜后,测定土壤质量含水量作为土壤最大持水量.
土壤DNA 提取及PCR 扩增及测序:土壤基因组DNA 提取试剂盒(天根生化科技有限公司,北京)提取样本的微生物基因组DNA.根据测序的土壤细菌16S rRNA 基因V4 区选择特异引物515F和806R 进行PCR 扩增[16].PCR 反应体系如下 (50 μL) :2×Phusion Master Mix 25 μL,515F Primer (10 μmol/L)2.5 μL,806R Primer (10 μmol/L) 2.5 μL,1 ng/μL gDNA 10 μL (5-10 ng),H2O 10 μL.PCR 反应程序为:98 ℃预变性30 s;98 ℃ 10 s;50 ℃ 30 s;72 ℃30 s,循环30 次;72 ℃延伸5 min.利用2%的琼脂糖胶电泳和GeneJET 胶回收试剂盒(Thermo Scientific,USA)对PCR 产物进行纯化回收.随后,PCR产物送至北京诺禾致源科技股份有限公司进行文库构建和高通量测序(基于IonS5TMXL 测序平台).
1.5 土壤数据分析IonS5TMXL 测序数据经过Cutadapt (v1.9.1)软件过滤和按barcode 拆分样本后,利用Uparse 软件(v7.0.1001)进行OTUs (Operational Taxonomic Units)聚类和物种分类分析[17].根据OTUs聚类结果,利用Silva 数据库[17],对每个OTU 的代表序列进行物种注释.同时,对OTUs 进行基于物种的丰度分布情况分析,根据所有样品在属水平上的物种注释及丰度信息,筛选氨氧化微生物(AOA和AOB)和亚硝酸盐氧化细菌(NOB),从物种层面进行5 个样品聚类,绘制成热图.热图对应的值为每一行物种相对丰度经过标准化处理后得到的Z值,即一个样品在某个分类上的Z值为样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差所得到的值.
利用SPSS 25.0 进行数据分析,多重比较采用Duncan 检验,相关分析采用Pearson 相关系数表示,多元线性回归分析采用后退法,通径系数即多元线性回归中的标准回归系数.
2 结果与分析
2.1 土壤硝化特征添加NH4+源后,除土样B 外,其余土样的NH4+−N 质量比在培养期间随时间增加下降,特别在培养2 d 后,土样A、D 和E 的NH4+−N 质量比下降较为迅速,土样C 则下降幅度较小,可能是硝化作用受到了抑制.培养期间,土样B 的NH4+−N 质量比增加,可能与矿化作用较强有关(图1(a)),其原因有待进一步研究.培养初始,土样C 的NO3−−N 质量比最高,且NO3−−N 质量比在培养过程中小幅增加,其余土样在培养2 d 内NO3−−N质量比增幅较快,培养2~4 d 时,NO3−−N 质量比增加缓慢,土样D 还出现下降趋势,可能发生了微生物固定.培养4 d 后,除土样C 外,其余土样的NO3−−N 质量比又开始增加,其中,土样E 增幅最大 (图1(b)).
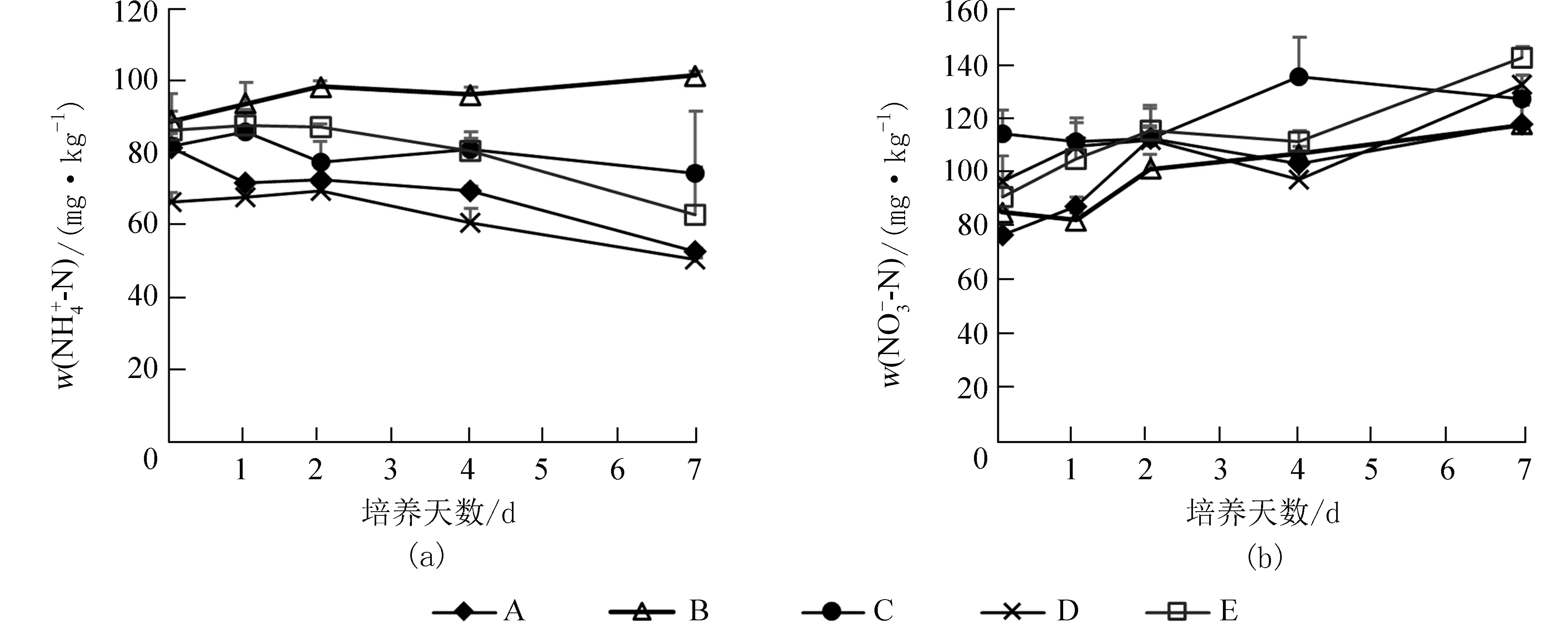
图1 培养期间NH4+−N (a) 和NO3−−N (b) 质量比动态变化Fig.1 Dynamics of soil NH4+−N (a) and NO3−−N (b) content in the incubation experiment
5 个土样0~7 d 净硝化速率如图2 所示,5 个土样的净硝化速率大小顺序为E (7.42 mg·kg−1·d−1) >A (5.91 mg·kg−1·d−1) >D (5.11 mg·kg−1·d−1) >B (4.69 mg·kg−1·d−1) >C (1.83 mg·kg−1·d−1).结合表1 土 壤性质,土样C 的pH 值最低,为4.44,说明低pH 值能抑制土壤硝化作用.

图2 各供试土样0~7 d 的净硝化速率Fig.2 The net N nitrification rates of the experimented soils from 0 to 7 day
2.2 氨氧化微生物和硝化细菌的相对丰度利用5 个咖啡种植地土样的微生物样品16S rDNA 扩增子测序数据[18],根据物种注释结果筛选硝化作用相关微生物,结果发现5 个咖啡种植地土样是主要由氨氧化古菌(Ammonia-oxidizing archaea,AOA)、氨氧化细菌(Ammonia-oxidizing bacteria,AOB)和亚硝化氧化细菌(Nitrite oxidizing bacteria,NOB)的7 个属进行硝化作用(图3).其中,氨氧化古菌(AOA)可能是云南热区咖啡种植地土壤中起主要氨氧化作用的微生物[18].
硝化作用相关微生物的相对丰度在不同产区和种植年份均存在明显差异(图3).其中,Candidatus Nitrosotalea相对丰度在样点B 最高,样点C 和E最低,样点A 和D 居中(图4).从土壤性质来看(表1),氨氧化古菌相对丰度与有效磷含量变化一致,并且,有效磷和速效钾含量高的样点A、B 和D,其氨氧化古菌相对丰度高于有效磷和速效钾含量的低的样点C 和E.
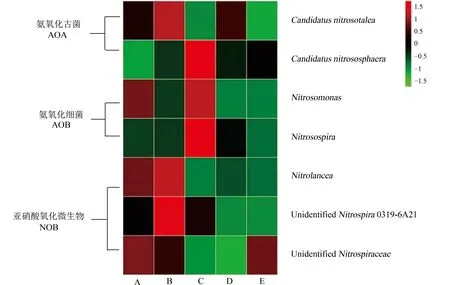
图3 云南热区咖啡种植地土壤中氨氧化古菌和硝化细菌的相对丰度热图Fig.3 Heatmap of relative abundance of ammonia-oxidizing archaea and nitrifying bacteria in coffee-growing regions of Tropical Yunnan
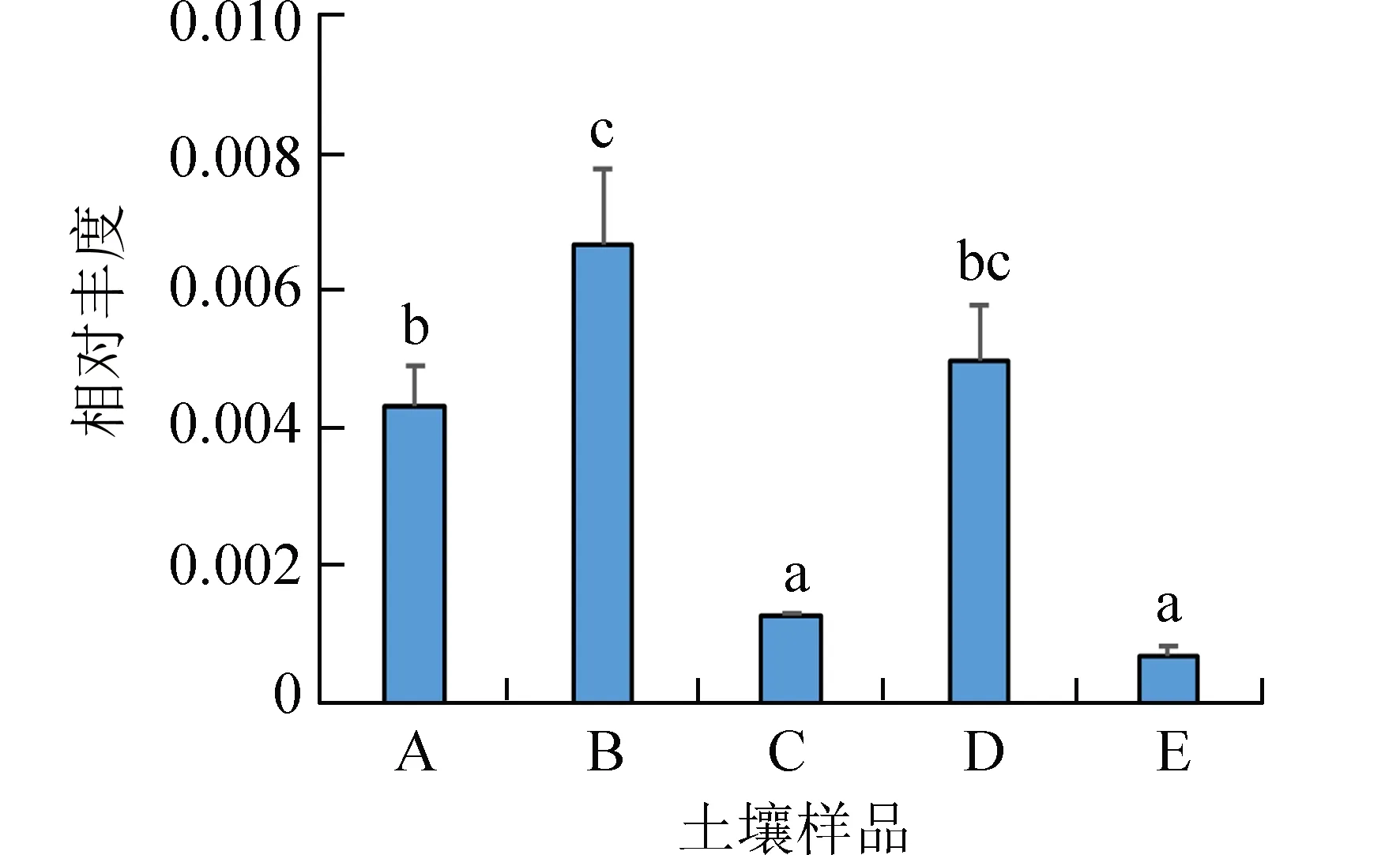
图4 供试土壤氨氧化古菌Candidatus nitrosotalea相对丰度Fig.4 Relative abundance of Candidatus nitrosotalea (group I.1a-associated ammonia-oxidizing archaea) in soil samples
2.3 净硝化速率与土壤性质的关系从表2 可知,净硝化速率与土壤pH 值呈极显著正相关关系(p<0.01),说明低pH 值能抑制硝化作用.有机碳和全氮与净硝化速率分别呈极显著(p<0.01)和显著负相关关系(p<0.05),并都与土壤pH 值呈极显著负相关(p<0.01),可能与低pH 值条件下微生物活性受到抑制,导致碳氮转化速率下降有关.氨氧化古菌相对丰度与有效磷和速效钾均呈极显著正相关关系(p<0.01),因为磷、钾能改善微生物生存的营养环境,最终,氨氧化古菌丰度得以增加.有机碳与全氮呈极显著正相关(p<0.01),有机氮一般占全氮的98%以上,土壤氮的含量与供应取决于有机质的积累和分解.

表2 净硝化速率与土壤性质的相关性Tab.2 Correlation between net nitrification rate and physicochemical properties with soil samples
将净硝化速率与土壤性质作逐步回归分析,得到y=− 0.004x1+6.225x2− 26.180 (r2=0.776),x1为速效钾,x2为pH 值,通径系数为x2(0.891) >x1(0.359),对净硝化速率影响最大的土壤因子是土壤pH 值,两者呈正相关关系.
2.4 土壤酸度变化供试土样在硝化培养期间的pH 值变化见表3.培养1 d 时,一部分略微升高 (土样A、B 和C),另一部分土样pH 值保持不变 (土样D 和E).培养2 d 时,土样A、B 和C 的pH 值下降,土样D 和E 则小幅升高或基本不变.培养4 d时,除土样C 的pH 值增加外,其余土样的pH 值在下降.至培养7 d 时,全部土样的pH 值都有所降低.整个培养期间内,5 个土样pH 值均下降,幅度分别为0.20、0.22、0.05、0.04 和0.14.结合图2 来看,除土样D 外,有较高净硝化速率的土样A (5.91 mg·kg−1·d−1)、B (4.69 mg·kg−1·d−1) 和 E (7.42 mg·kg−1·d−1),其ΔpH 分别为0.20、0.22 和0.14,显著高于净硝化速率低的土样C (1.83 mg·kg−1·d−1)的0.05.土样D 的净硝化速率为5.11 mg·kg−1·d−1,但ΔpH 仅为0.04,说明其对酸的缓冲能力较强.结合表1,土样D 速效钾含量极高,K+是土壤盐基离子组分之一,可能其较高的缓冲性能缓解了土壤酸化,具体原因有待进一步研究.

表3 供试土壤培养期间pH 值变化特征Tab.3 Dynamics of pH values of the soil samples during the incubation experiment
3 讨论
土壤pH 值是影响硝化作用的重要因子.一般认为低pH 值能抑制土壤硝化作用[19-20],但pH>4.5 的酸性土壤硝化速率明显增强[21].本试验条件下,初始pH 值在4.67~5.04 的土样(土样A、B、D和E),净硝化速率显著高于初始pH 值4.44 的土样(土样C),通径分析表明土壤pH 是影响净硝化速率最主要的因素,与前人研究结果一致[13,22].酸性土壤硝化活性提高的主要原因是长期施用氮肥和有机肥,由于NH3或NH4+硝化成NO3−会在其第一个反应步骤,即氨氧化过程中产生2 个H+,硝化作用增强,加速了土壤酸化[5-6,23].本试验条件下,硝化培养结束时,净硝化速率高的土样pH 值下降0.14~0.22,显著高于净硝化速率低的土样的0.05,与前人的报道的pH=4.34~5.14 的土壤其酸化速率与硝化速率呈显著线性关系一致[24-25].
盐基离子淋溶是土壤酸化的重要原因[26],盐基离子的组成和数量是pH 缓冲容量增加的主要机制[27-28],如果盐基离子与致酸离子(交换性H+、Al3+)发生交换反应,潜性酸含量可能下降,利于减缓酸化.本试验条件下,净硝化速率较高的土样D,硝化培养结束时,pH 仅下降0.04,无酸化现象,推测与其速效钾含量较高有关.研究表明,土壤pH值与交换性盐基含量呈显著正相关关系[29-30],土壤交换性酸的减少与交换性盐基的释放呈线性关系[31-32],由于缺乏更详细的结果,需进一步加强盐基离子与土壤酸化方面的研究.
氨氧化过程主要由氨氧化细菌(AOB)和氨氧化古菌(AOA)驱动.酸性红壤中AOA 比AOB 与硝化作用的关系更为密切[33-34],并且有了AOA 是酸性土壤活性氨氧化微生物的直接证据[35].本试验条件下,在属水平上的细菌群落的物种丰度聚类分析表明,相对丰度排名前35 的属,仅发现AOA Group I.1 a-associated(Candidatus Nitrosotalea),AOB的排名在80 位以后,说明低pH 土壤中AOA 数量占主导优势.尽管本试验条件下AOA 相对丰度与净硝化速率没有关系,但给出了中等酸度土壤(pH=4.44~5.04)AOA 数量高于AOB 的证据.
4 结论
土壤pH 是影响咖啡园酸性土壤硝化作用的重要因子,低pH 值能抑制土壤硝化作用,土壤pH值与净硝化速率呈正相关关系,净硝化速率高的土壤酸化明显.咖啡园酸性土壤AOA 相对丰度高于AOB.在净硝化速率高的土壤中存在酸化不明显现象,通过调控盐基离子增加土壤对酸的缓冲能力的作用机制和实践需要进一步研究.

