超重力场中非均相催化臭氧降解苯酚表观反应动力学
高克昌,吕 行,李知行,任高妙,景佳鑫,张竞文,刘有智,焦纬洲
(中北大学 化学工程与技术学院,超重力化工过程山西省重点实验室,太原 030051)
含酚废水是煤化工生产过程中产生的主要废水[1-2],尤其以苯酚的含量最大。苯酚能够引起人体皮肤和黏膜的灼伤或腐蚀,损害中枢神经系统,严重时则导致肝脏功能衰竭[3]。即使经过酚氨回收预处理,出水中仍有残留的苯酚等有机物,其COD含量约占煤化工废水COD总量的60%左右[4]。因此,进一步去除残留的有机污染物对环境至关重要。
近年来,高级氧化法(AOPs)如臭氧氧化法[5]、Fenton氧化法[6]、电催化氧化法[7]、光催化氧化法[8]等以氧化彻底、反应迅速等特点被研究者们广泛关注。臭氧(O3,E0=2.07 V)作为一种强氧化剂能有效攻击含有共轭双键或芳环的有机污染物的分子结构[9],然而由于O3具有选择氧化能力,初始攻击产生的中间小分子化合物不能被O3进一步矿化,需要由O3分解产生的羟基自由基(·OH,E0=2.80 V)进行氧化[10],随之,催化臭氧氧化法应运而生。非均相催化臭氧氧化法[11]采用固体氧化物作为催化剂,解决了均相催化臭氧氧化法中催化剂难以回收、对环境造成二次污染等问题。但是,由于O3从气相到液相的传质是催化臭氧氧化的控制步骤[12],O3在水中的低溶解度不利于提高有机物的矿化率。因此,提高O3的气液传质效率成为提高O3利用率和有机物降解效率的关键因素[13]。
超重力技术[14]是一种具有广泛应用前景的过程强化技术,通过旋转填料床(rotating packed bed,RPB)中高速旋转的填料产生的离心力模拟超重力场,在气液接触反应过程中改变相界面的流动形态,将液体剪切成液体微元,增强了气液相界面的快速更新,能够显著强化气液、液固之间的接触和反应[15]。DU et al[16]制备了MgO/γ-Al2O3催化剂,将其作为RPB的填料用于降解甲醛废水,结果表明,处理60 min后废水中甲醛和TOC的去除率分别为99.85%和97.37%,与鼓泡反应器(bubbling reactor,BR)相比,去除率分别提高了16.5%和25.28%。因此,超重力技术与非均相催化臭氧氧化法相结合可以提高O3的传质效率[17],加速O3分解为·OH,从而提高有机物的降解效果。O3与水中有机物的反应分为O3与有机物的直接反应,以及水中O3发生分解生成·OH与有机物的间接反应[18]。关于超重力场中非均相催化O3降解苯酚的研究已有报道[19],但缺少相应表观反应动力学的研究。通过表观反应动力学的研究,可实现超重力装置的优化设计以提高臭氧利用率。
在本研究中,通过改变不同的工艺参数(超重力因子β、溶液pH值、液体流量qL与温度T)探究超重力场中非均相催化O3与苯酚表观反应速率常数的影响。在O3与苯酚的直接反应中,加入自由基清除剂叔丁醇(TBA)[20]抑制·OH的间接反应,采用溶质消耗法研究直接反应表观动力学;在·OH与苯酚的间接反应中,加入·OH探针化合物对氯苯甲酸(pCBA)[21],研究间接反应表观动力学,确定超重力场中O3和·OH与苯酚的表观反应速率常数,并建立表观反应动力学经验模型。
1 实验部分
1.1 材料与设备
实验材料:苯酚(PhOH)、对氯苯甲酸(pCBA),分析纯,国药集团化学试剂有限公司;叔丁醇(TBA)、氢氧化钠(NaOH)、硫酸(H2SO4)、硫代硫酸钠(Na2S2O3)、碘化钾(KI),分析纯,天津市光复精细化工研究所;纯氧,99.99%,山西泰能气体有限公司。本研究以直径为3~5 mm的Fe-Mn-CuOx/γ-Al2O3球形颗粒作为催化剂,其特征参数如表1所示。
仪器设备:臭氧发生器,CF-G-3-20 g,山东青岛国林科技有限公司;高效液相色谱(HPLC),Ultimate 3000型,美国戴安公司;pH分析仪,FE28-Standard,瑞士M.T.集团;气相臭氧浓度检测仪,3S-J5000,北京同林科技有限公司;溶解臭氧分析仪,DOZ5500,北京同林科技有限公司;RPB(旋转填料床),山西省超重力化工工程技术研究中心,填料的相关特征参数如表2所示。

表1 Fe-Mn-CuOx/γ-Al2O3的特征参数Table 1 Characteristic parameters of Fe-Mn-CuOx/γ-Al2O3
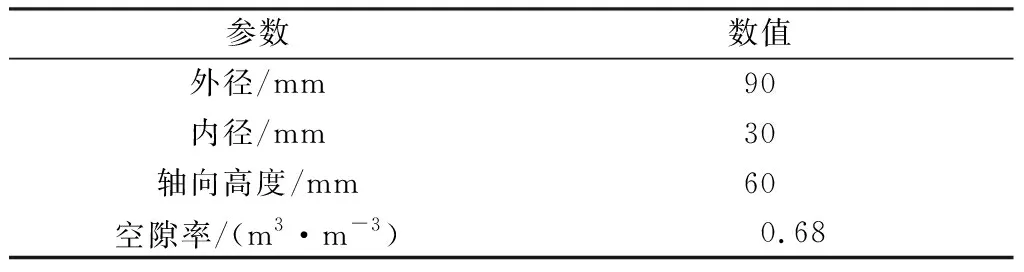
表2 RPB填料的特征参数Table 2 Characteristic parameters of packing
1.2 工艺流程
本实验工艺流程图如图1所示,RPB的填料为Fe-Mn-CuOx/γ-Al2O3催化剂,通过调节不同的操作参数(β、溶液pH值、qL与T)探究超重力场中非均相催化臭氧降解苯酚的表观反应动力学。来自钢瓶中的O2经过臭氧发生器产生O3与O2的混合气,以60 L/h的气体流量进入RPB气体入口,经气相臭氧浓度检测仪检测其质量浓度为30 mg/L.配制质量浓度为100 mg/L的苯酚模拟废水,其循环量为2 L,调节pH值(5,6,7,8)后倒入储液槽,通过使用加热装置控制溶液的温度(20,40,60 ℃),经过离心泵送入液体管路,调节液体流量(60,80,100,120 L/h)后经过位于转子中心的液体分布器进入转子内缘。调节超重力因子(10,20,30,40)使液体经高速旋转填料的剪切作用分散为液丝、液滴、液膜,与轴向通过填料的O3接触并进行反应。溶液由溶解臭氧分析仪检测其中O3的浓度,反应后的溶液汇集到储液槽,进行循环。一定时间间隔取样,向取出的样品中立即滴加0.01 mg/L的Na2S2O3溶液来终止溶液中的反应,样品中苯酚的浓度由HPLC测定。出口未反应的O3连接尾气处理装置,经KI溶液吸收后排空。
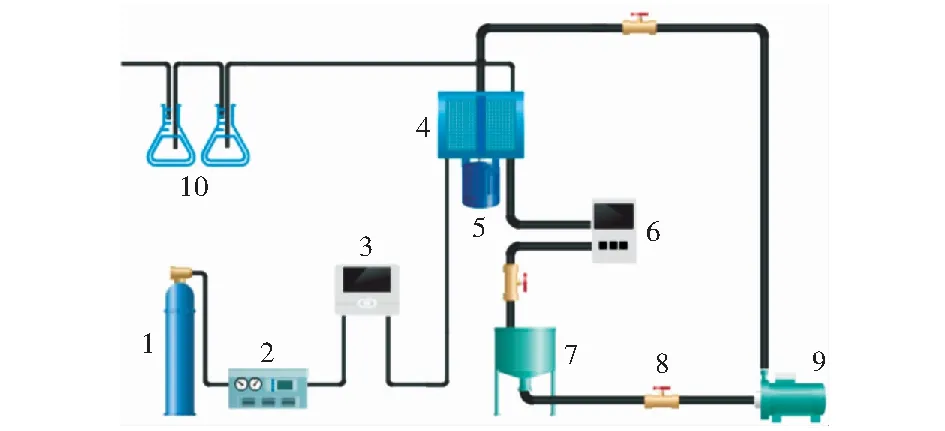
1-氧气钢瓶;2-臭氧发生器;3-气相臭氧浓度检测仪;4-旋转填料床;5-电机;6-液相臭氧浓度检测仪;7-储液槽;8-阀门;9-离心泵;10-尾气处理装置图1 实验工艺流程图Fig.1 Schematic diagram of experimental setup
1.3 分析方法
1.3.1有机物质量浓度的检测
苯酚的浓度使用高效液相色谱(HPLC;Dionex UltiMate 3000)进行测定,其测量条件为:色谱柱为C18反相柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水,体积比为60∶40,流速为1.0 mL/min,柱温为25 ℃,检测波长为270 nm,进样量为20 μL.苯酚去除率ηPhOH的计算公式如式(1)所示:
ηPhOH=[(ρ0-ρt)/ρ0]×100% .
(1)
式中:ρ0与ρt分别为初始和t时刻苯酚的质量浓度,mg/L.
对氯苯甲酸的检测方法与苯酚相似,差别在于其流动相为甲醇-磷酸(体积分数10%),体积比为70∶30,柱温为40 ℃,检测波长为236 nm.
1.3.2表观反应动力学
由于旋转填料床为半间歇反应器,在实验过程中保持气相O3持续通入,因此在研究反应动力学时,将O3的传递过程与化学反应对苯酚降解的影响相结合,统一为表观反应动力学。超重力因子β、初始pH值、液体流量qL和温度T均会影响PhOH的降解速率,不同参数对PhOH降解的影响可通过幂指数拟合经验模型式来表述[22-23],如式(2)-(4).对表观反应速率常数进行线性拟合,得到各参量,即可得到表观反应动力学模型。
c(PhOH)=c0(PhOH)exp(-kPhOHt) .
(2)
(3)
lnkPhOH=lnA-Ea/RT+mlnc(OH-)+nlnN+plnqL.
(4)
式中:kPhOH为O3或·OH与苯酚反应的表观速率常数,L·mol-1·s-1;A为指前因子,Ea为反应表观活化能,J/mol;R为气体常数,8.314 J·mol-1·K-1;T为反应温度,K;c(OH-)为溶液中的OH-的浓度,mol/L;N为RPB的转速,r/min;qL为液体流量,L/h;m,n,p分别为反应阶数。
1.3.3O3与苯酚的直接反应表观速率常数(kPhOH/O3)
苯酚的降解速率可以用O3和·OH与苯酚反应的二阶反应动力学方程表示,如式(5):
-dc(PhOH)/dt=kPhOH/O3c(O3)c(PhOH)+kPhOH/·OHc(·OH)c(PhOH) .
(5)
式中:kPhOH/O3表示O3与PhOH的直接反应速率常数,L·mol-1·s-1;c(O3)为t时刻溶解在水中的臭氧的浓度,mol/L;c(PhOH)为t时刻苯酚的浓度,mol/L;kPhOH/·OH为苯酚与·OH间接反应的速率常数,L·mol-1·s-1;c(·OH)是t时刻水中的·OH的浓度,mol/L.
加入过量TBA后,间接反应被抑制,式(5)可变形为式(6):
-dc(PhOH)/dt=kPhOH/O3c(O3)c(PhOH) .
(6)
积分得式(7):

(7)

1.3.4·OH与O3的暴露比率(RCT)
在臭氧氧化的过程中,理想的·OH探针化合物仅与·OH反应,而不与O3或其次级氧化剂发生反应[21]。因此,通过测定·OH探针化合物的反应情况确定·OH的浓度。由于pCBA与O3分子的反应活性很低(kpCBA/O3<0.15 L·mol-1·s-1),而与·OH的反应活性很高(kpCBA/·OH=5×109L·mol-1·s-1).因此,将pCBA作为·OH探针化合物,反应动力学方程为:
-dc(pCBA)/dt=kpCBA/·OHc(pCBA)c(·OH) .
(8)

(9)
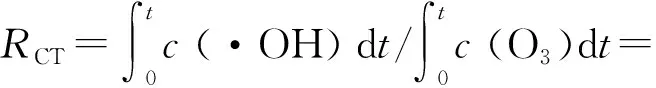
(10)
将式(10)代入式(9)得式(11):

(11)
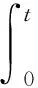
1.3.5·OH与苯酚的间接反应表观速率常数(kPhOH/·OH)
经过上述的分析,式(5)进行变形为:
-dc(PhOH)/dt=kPhOH/O3c(O3)c(PhOH)+kPhOH/·OHRCTc(O3)c(PhOH) .
(12)
-dc(PhOH)dt=(kPhOH/O3+kPhOH/·OHRCT)c(O3)c(PhOH) .
(13)

(14)
2 实验结果与讨论
2.1 超重力场中非均相催化O3降解苯酚表观反应动力学
2.1.1TBA对O3与苯酚反应的影响
在研究O3与PhOH的直接反应时,通过加入TBA清除溶液中的·OH.TBA与·OH反应速率常数为4.6×108L·mol-1·s-1,与O3的反应速率常数仅为3.0×10-2L·mol-1·s-1[25-26],因此当溶液中存在过量TBA时,·OH可被完全清除,从而抑制间接反应。
图2表示加入不同体积TBA后对PhOH降解率的影响。由图2可知,当TBA用量由0 mL增加到5 mL时,ηPhOH从98.5%下降到86.7%;当TBA用量继续增加到10 mL时,ηPhOH几乎不变。其原因是未加入TBA时,PhOH既可以与O3反应,又可以与·OH反应[27],从而使PhOH达到很高的去除率;当加入5 mL TBA后,·OH被清除,抑制间接反应,使ηPhOH下降;继续增加TBA的量,ηPhOH不会下降,说明在此条件下,间接反应完全被抑制,只有直接反应发生[28],符合研究直接反应动力学的要求。
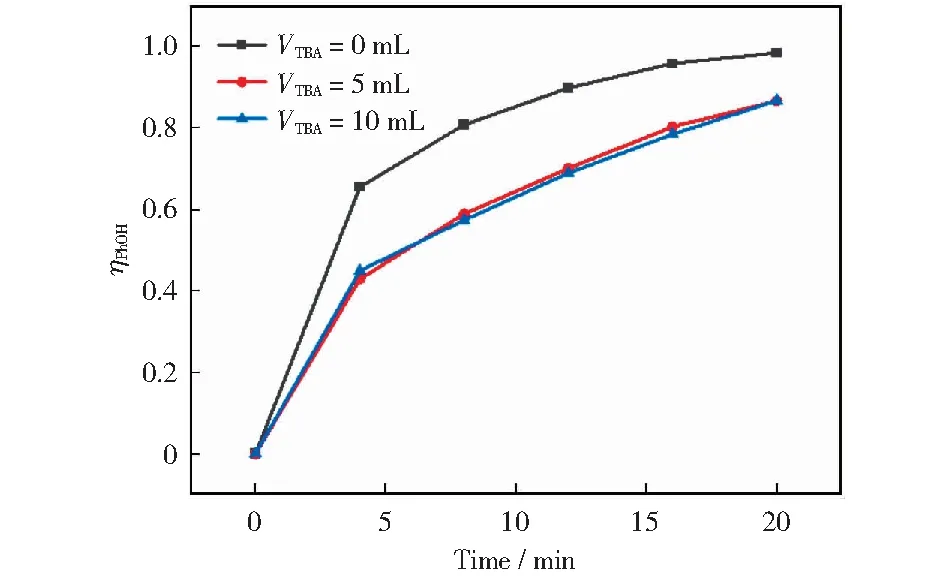
pH=6, β=30, θ=20℃, ρ(O3)=30 mg/L, ρ(PhOH)=100 mg/L, qG=60 L/h, qL=80 L/h图2 加入不同体积TBA对PhOH降解率的影响Fig.2 Effect of TBA dosage on the removal rate of phenol
2.1.2超重力因子的影响
超重力因子β是离心加速度与重力加速度的比值,表示超重力场强度的无量纲参数[29]。图3和表3表示随着β的增大,kPhOH/O3和kPhOH/·OH均呈现先增大后减小的趋势,在β=30时,反应速率常数最大。这表明,β的增大使O3体积传质系数增加,促进气相O3进入液相[12],一方面会使得kPhOH/O3增加,另一方面使O3分解产生更多的·OH,kPhOH/·OH增加。RPB的强湍流状态有利于O3的分解[17],因此,kPhOH/·OH增加。但是,由于液体在填料的停留时间与β成反比,继续增大β,导致液体在填料中的停留时间变短[30],使能耗与成本增加。
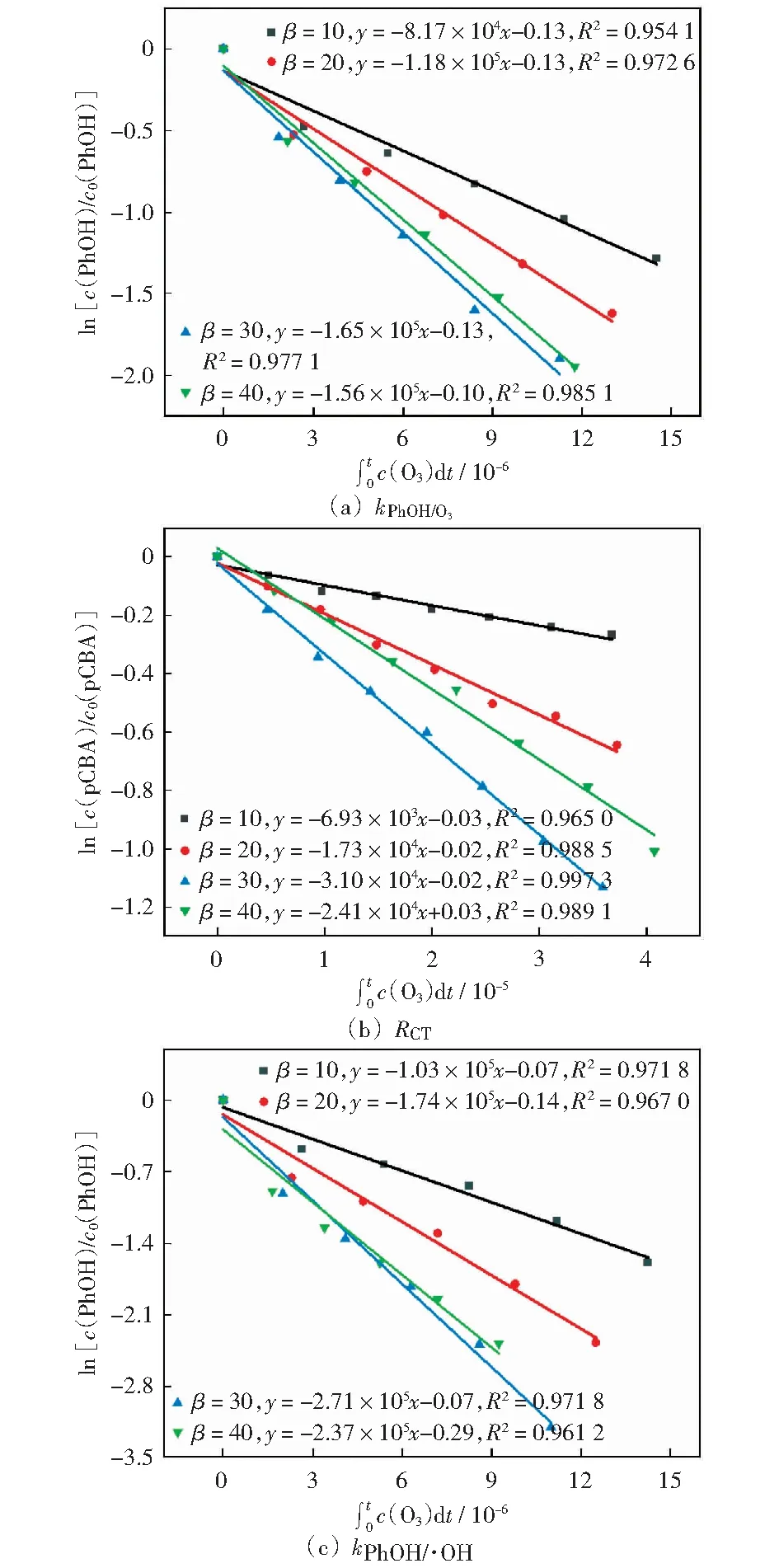
β=10, 20, 30, 40, pH=6, θ=20 ℃, qL=80 L/h图3 不同β对反应的影响Fig.3 Effect of β on the reaction
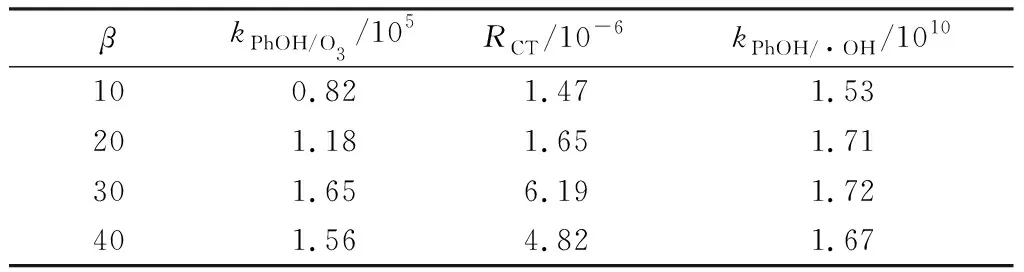
表3 不同β下,kPhOH/O3, RCT与kPhOH/·OH的值Table 3 Values of kPhOH/O3, RCT, and kPhOH/·OH under different β
2.1.3溶液pH值的影响
溶液pH值是影响有机物降解的重要因素,在实验过程中通过加入H2SO4与NaOH溶液调节pH值在5~8的范围内进行研究。
由表4可知,随着溶液pH值的升高,kPhOH/O3随之增大,而kPhOH/·OH先增大后减小。对于O3与PhOH的直接反应来说,增加pH值加速了O3的分解反应,提高O3的溶解量[31],但随着溶液pH值的增大,使O3气液传质速率加快,由于存在过量TBA,·OH被捕获,二者的共同作用促进了O3传质,使kPhOH/O3增大。对于·OH与PhOH的间接反应来说,由O3分解反应可知,OH-是O3发生链式反应的引发剂,随着pH值的升高,OH-的浓度增大,产生·OH的浓度随之增大,使kPhOH/·OH增加。但当pH值过高时,部分·OH会相互碰撞,发生猝灭反应[24],导致·OH的消耗。

表4 不同pH值下,kPhOH/O3, RCT与kPhOH/·OH的值Table 4 Values of kPhOH/O3, RCT, and kPhOH/·OH under different pH
2.1.4液体流量的影响
液体流量的大小对废水的处理量、接触时间等因素都有影响,进而影响反应速率常数与降解效果[32]。如表5所示,当qL从60 L/h升高到120 L/h时,kPhOH/O3和kPhOH/·OH先增大后减小。这是因为qL的改变影响填料润湿程度,从而直接影响废水的处理效能。
(15)
Lmin=lw·a.
(16)
式中:L为平均液体喷淋密度,m3·m-2·h-1;qL为液体流量,L/h;r为转子内径,m;h为RPB的转子高度,m;Lmin为最小液体喷淋密度,m3·m-2·h-1;lw为最小润湿率,m3·m-2·h-1,在散装填料时取0.08 m3·m-2·h-1;a为填料层比表面积,m2/m2.
计算得最小喷淋密度Lmin=13.45 m3·m-2·h-1.在qL=60 L/h时,L=10.24 m3·m-2·h-1
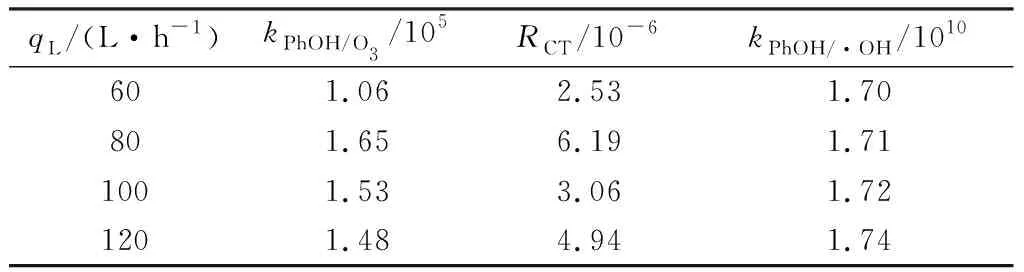
表5 不同qL下,kPhOH/O3, RCT与kPhOH/·OH的值Table 5 Values of kPhOH/O3, RCT, and kPhOH/·OH under different qL
2.1.5温度的影响
在JIAO et al[12]的研究中表明,温度对有机物的降解有重要影响。许多反应的速率常数和温度之间存在一定的指数关系,其通过阿伦尼乌斯方程表述如下:
lnK=-Ea/RT+lnA.
(17)
式中:K为温度为T时的反应速率常数,L·mol-1·s-1.
表6说明kPhOH/O3和kPhOH/·OH随着温度的升高而增大,其原因为,温度的升高会降低化学反应的活化能,活化分子碰撞次数增多,反应速率常数随着温度的升高而增大。对于直接反应来说,根据ZHAO et al[34]的研究,温度升高对O3的传质不利,但是活化能对反应的影响强于气-液传质[35],因此kPhOH/O3是增大的;对于间接反应来说,温度升高会加快O3分解反应速率[17],使溶液中·OH浓度增加,kPhOH/·OH增加。

表6 不同温度下,kPhOH/O3, RCT与kPhOH/·OH的值Table 6 Values of kPhOH/O3, RCT, and kPhOH/·OH under different temperature
2.1.6不同反应装置速率常数的对比
表7表示了RPB与BR的表观反应速率常数,从中可知RPB的kPhOH/O3和kPhOH/·OH显著高于BR,RPB中的kPhOH/O3是BR中的10倍,kPhOH/·OH则为1.63倍。由于RPB巨大的离心力作用,液体被剪切为液体微元,在单位时间内不仅可以增大气液、液固的接触面积,提高O3的液相体积传质系数[36],而且可以提高O3在催化剂表面的分解能力[37],加速生成·OH,从而使RPB中的表观反应速率常数相比于BR有显著的提高。

表7 不同反应装置中kPhOH/O3, RCT与kPhOH/·OH的值Table 7 Values of kPhOH/O3, RCT, and kPhOH/·OH under different reaction devices
2.2 超重力场中非均相催化O3与苯酚表观反应动力学模型
2.2.1直接反应动力学模型
表观反应动力学模型的建立如式(2)-(4),未知参量A、Ea、m、n和p通过表观反应速率常数与每个影响因素的拟合关系求得,如图4所示。图4(a)分别描述了lnkPhOH/O3与lnc(OH-)、lnN的拟合关系,斜率分别为0.19和1.27;图4(b)分别描述了lnkPhOH/O3与lnqL、1/T的拟合关系,斜率分别为3.76和4 097.61,可以求得Ea为34.07 kJ/mol.将数据分别代入式(3)得到A=5.09×1012L·mol-1·s-1,直接反应表观动力学模型如式(18):
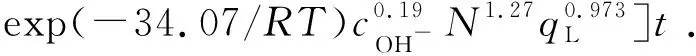
(18)

图4 直接反应动力学模型的建立Fig.4 Establishment of the kinetic models of the direct reaction
2.2.2间接反应动力学模型
图5(a)分别描述了lnkPhOH/·OH与lnc(OH-)、lnN的拟合关系,斜率分别为0.03和0.21;图5(b)分别描述了lnkPhOH/·OH与lnqL、1/T的拟合关系,斜率分别为0.02和64.35,可以求得Ea为0.53 kJ/mol.将数据分别代入式(3)得到A=2.21×1010L·mol-1·s-1,间接反应表观动力学模型如式(19)

(19)
2.2.3直接反应与间接反应表观动力学模型的比较
通过两个反应模型的比较可知,间接反应的活化能显著低于直接反应,说明·OH的反应能量壁垒低,易攻击有机物,这也体现在表观反应速率常数上,·OH的间接反应速率常数比O3的直接反应速率常数高5个数量级;根据对反应动力学模型中各因素的反应阶数的大小比较可知,直接反应中β、溶液pH和qL对反应速率的影响更大,这是由于O3与PhOH的反应为快反应[38];在各个影响因素中β的反应阶数是最大的,说明β对反应速率常数的影响最大;TBA的加入使PhOH的降解率下降了11.8%,说明PhOH降解过程中直接反应的贡献率大于·OH间接反应。

图5 间接反应动力学模型的建立Fig.5 Establishment of the kinetic models of the indirect reaction
3 结论
1) 在直接反应中,O3与苯酚的表观反应速率常数介于8.17×104~8.80×105L·mol-1·s-1之间;在间接反应中,·OH与苯酚的表观反应速率常数介于1.54×1010~1.78×1010L·mol-1·s-1之间,并且间接反应的活化能显著低于直接反应,苯酚的降解过程中O3直接反应的贡献率大于·OH间接反应。
2) 通过对不同反应条件下的表观反应速率常数进行线性拟合,得到了动力学经验模型,其表明超重力因子β、溶液pH值、液体流量qL与温度T均会对表观反应速率常数产生一定影响,其中β的影响最大。
3) 与鼓泡反应器相比,超重力装置的强湍动、高剪切作用会显著加快表观反应速率常数。超重力技术与非均相催化臭氧氧化法结合,可有效提升苯酚废水的处理效能。

