金属元素修饰碳基材料光/电还原CO2研究进展
寇丽芳,张小超,张长明,官修帅,樊彩梅
(太原理工大学 a.化学工程与技术学院,b.矿业工程学院,太原 030024)
能源短缺和环境恶化是人类面临的主要危机。众所周知,化石燃料是一种不可再生能源,而化石燃料燃烧排放出的大量CO2是温室效应的主要气体,导致气候危机,严重威胁人类健康。如果能将CO2转化为高附加值化学品和碳氢燃料,对降低化石能源比重、缓解能源短缺和环境危机具有重大意义[1-3]。到目前为止,研究者已采取各种各样方法(如光催化[4]、电催化[5]、光电催化[6])实现“碳达峰碳中和”目标。然而,CO2分子的高活化势垒以及催化剂CO2吸附能力低、表面贫乏的反应位点严重阻碍CO2还原的效率和选择性[7]。因此,开发一种高活性、高选择性、高稳定性的催化剂体系来推动CO2还原的纵深发展是至关重要的。
碳基材料由于具有丰富的自然资源,可调整的多孔结构、高比表面积、高导电率、高温稳定性和环境友好等特性引起广泛研究[8-10]。早在1996年,YONEYAMA et al[11]发现活性炭作为吸附剂载体可提高TiO2光催化降解污染物的活性,但对材料的结构和反应机理尚未研究清楚。2008年,GRAY et al[12]发现将TiO2与碳纳米管(CNTs)复合可提高反应性比表面积,阻碍光生载流子复合,增强光催化氧化性能。2013年,KUMAR et al[13]采用聚丙烯腈为前驱体制备了碳纳米纤维催化剂并用于电催化CO2还原,结果显现出可与贵金属相媲美的还原活性。随着对碳基材料不断深入研究,发现金属元素修饰的多孔碳材料具有独特的结构特性和催化性能,尤其是碳基材料负载金属催化剂在CO2还原领域的报道越来越多,并取得重大研究进展[14-16]如图1所示。例如,石墨烯[17]、碳纳米管[18]、活性炭[19]等碳基材料均可被用作载体来促进金属的分散,并暴露更多活性位点,形成更丰富的多孔结构和表面化学基团,进而有利于吸附和活化CO2[20-22]。因此,研究不同金属元素与碳基材料之间构效关系对CO2还原的影响是相当有意义的。
本文简单介绍了光催化、电催化和光电催化CO2还原的基本原理,重点概括了不同金属元素(Fe,Co,Ni,Cu)以及双金属元素修饰碳基材料的制备方法和CO2还原性能,讨论了金属纳米颗粒、金属单原子、金属配合物或金属氧化物对CO2还原产物活性和选择性的影响。最后,总结与展望金属元素修饰碳基材料未来的设计原则、研究发展及应用前景。
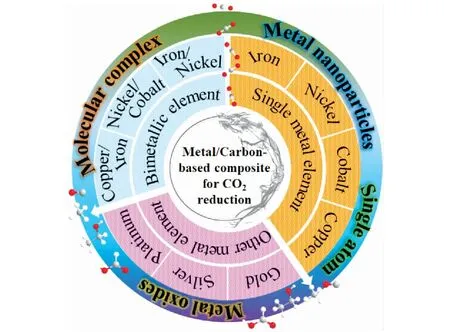
图1 金属修饰碳基材料用于CO2还原的策略及存在形式Fig.1 Strategy and existence form of metal-modified carbon-based materials for CO2 reduction
1 CO2资源化利用

1.1 光催化还原CO2
光催化还原CO2是利用清洁太阳能实现CO2绿色资源化转化利用的经济策略之一。其原理是当光子吸收的能量大于等于半导体带隙的能量时,半导体价带(VB)上的电子会被激发跃迁到导带(CB)参与还原反应并将CO2还原为CO和碳氢化合物,而在VB上留下的空穴则参与氧化反应放出氧气。因此,合理的光催化剂应满足以下要求[23-24]:1) 良好的CO2吸附能力是电子从催化剂传递到CO2的首要条件,光催化剂比表面积越大,其表面吸附CO2的活性位点越多,由于CO2是Lewis酸性分子,碱式催化剂可提高CO2吸附能力;2) 具备合适带隙充分吸收太阳能是光还原CO2的前提条件;3) 优异的光生载流子分离迁移能力决定光还原CO2的活性;4) 合理导价带位置对产物分布及目标产物收率具有重要影响;5) 表面对目标产物的脱附能力。因此,构建独特的光催化剂是提高光催化CO2转化目标产物活性及选择性的先决条件。
1.2 电催化还原CO2
电催化还原CO2是在施加电位下CO2在电池阴极上直接得电子生成CO和碳氢化合物的过程,其特点是:1) 电化学反应系统紧凑、模块化,易于扩大应用规模;2) 电化学还原产物可通过氧化还原电位、反应温度、电解质等反应参数进行调节;3) 电力作为动力,可借助可再生能源(如太阳能、风能等)来实现而无二次污染[25-26]。然而,电催化还原反应机制复杂,涉及多个质子耦合电子转移步骤,易形成气体(CO、CH4等)和液体(HCOOH、CH3OH、C2H5OH等)产物的混合物,导致选择性降低。其次,催化剂稳定性差,难以长期发挥作用,进而带来成本高、效率低、产物选择性低、电催化失活快等亟待解决的难题。因此,探索一类低成本、高性能催化剂是电催化还原CO2纵深发展的首要任务。
1.3 光电催化还原CO2
光电催化还原CO2被认为是光催化和电催化的结合。光电催化体系通常使用半导体材料作为光电极,以光电阴极p型半导体为例,当p型半导体与电解液接触时,由于电解液费米能级高于p型半导体,电子将从电解液流向半导体并在半导体界面附近形成内建电场而导致半导体能带向下弯曲。一方面,当半导体受光激发产生电子-空穴对时,界面附近的光电阴极导/价带弯曲对相反方向的电子/空穴产生施加力,将电子推向界面参与还原反应,空穴离开界面在外加电压作用下迁移至光电阳极参与氧化反应,进而促进了光生电子-空穴对的有效分离。另一方面,从电催化角度看,利用太阳能可提供额外电荷,显著降低电能消耗。值得注意的是,在水等质子溶剂中,通常会发生质子还原为H2,与CO2还原形成竞争,在很大程度上限制了CO2还原活性和选择性。而事实上,太阳能和电能转换成化学能也是复杂的,因为在阴极和阳极可形成多种产物[27-28]。因此,选择合适的光电催化材料作为优异电极是提高光电催化还原CO2效率的关键科学问题。
2 单金属元素修饰
2.1 Cu元素修饰
将CO2还原成C2+烯烃和含氧化合物,对实现CO2减排和减缓能源危机有重大意义。铜储量丰富、价格低廉、且Cu基催化剂具备良好的催化加氢性能,将其与高比表面碳基材料,创造活性位点,构筑高效光/电催化CO2还原材料,备受众多科研人员的广泛关注[29-42],主要涉及以下几类:Cu纳米颗粒、Cu2O、Cu2O/Cu、Cu单原子等修饰碳基材料。
2.1.1Cu纳米颗粒
BENAMMARA et al[29]采用均相沉积沉淀法将质量分数为10%的铜纳米颗粒沉积在碳球上(10Cu-CSs),作为p型阴极半导体,其中,纳米铜粒子沉积电极上有效地促进光生e--h+对的分离,增强其在NaHCO3电解质中CO2光转化为甲酸的收率。研究发现,Cu纳米颗粒催化还原作用取决于纳米颗粒大小、表面Cu配位位点和碳氢化合物的吸附强度[30]。DONGARE et al[31]采用湿化学还原法制备了氮掺杂石墨烯负载Cu纳米颗粒(Cux/NGN)催化剂,其中Cu载量为20%时,显示出最优的CO2制乙醇活性,伴有少量乙酸生成。研究发现,Cu20/NGN活性增强的原因在于氮掺杂石墨烯中的吡啶氮促进了CO*在Cu金属上的稳定化学吸附,提高C—C耦合反应速率。但是,Cu载量过多时会导致Cu纳米颗粒聚集成块,从而降低活性。王路喜等[32]采用一步炭化活化法制备了Cu纳米颗粒修饰含氮多孔碳复合材料,不仅可阻碍Cu纳米颗粒聚集,而且暴露更多活性位点,进而加快电子传导,促进Cu与碳底物接触,降低中间体结合能,有效提高目标产物CO选择性。
2.1.2Cu2O
Cu2O为Cu基氧化物之一,其制备方法温和简易,具备高效加氢还原性能,被认为是还原CO2领域潜在的理想催化剂之一。由于CO2还原过程中,Cu+稳定性较差,容易被还原成Cu0,从而影响催化活性。基于此,2016年,YU et al[33]通过化学氧化法-炭化法在铜箔上合成了碳涂层Cu2O介孔纳米棒,碳涂层保护Cu2O不受光腐蚀并抑制了光生载流子复合,加之碳涂层介孔结构提供高比表面积有利于对CO2的吸附,进而在可见光照射下,该类催化剂显示出优异的CO2加氢还原成CH4和C2H4的活性与稳定性。随后,LI et al[34]通过简单的超声后水热合成了一种表面含有CQDs和碳薄膜的Cu2O基光催化剂(CL@CQDs/Cu2O),CL@CQDs层不仅能保护Cu2O活性中心免受光照射下的氧化/还原作用,而且能增强其光吸收和促进光生载流子分离与迁移能力,2.5 h可见光照射后甲醇产量达249 mmol/g且伴有少量甲烷的生成,其光催化原理如图2所示。
2019年,NING et al[35]以抗坏血酸为还原剂合成Cu2O/NRGO电催化剂,其选择性电催化还原CO2生成C2H4的产率高达136.1 mmol/h/g,其中,NRGO中吡啶N不仅增强Cu2O稳定性,而且促进Cu位氢化和碳碳偶联反应,生成C2H4.此外,他们研究团队还以石油沥青为前驱体制备了氮掺杂碳壳来负载Cu2O催化剂,显示出较高的C2H4法拉第效率和稳定性[36]。但是,Cu2O与吡啶-N协同提高C2H4选择性的反应机理还需进一步探究。

图2 CL@CQDs/Cu2O可见光催化还原CO2机理[34]Fig.2 Mechanism of photocatalytic CO2 reduction over CL@CQDs/Cu2O under visible light irradiation[34]
2.1.3Cu2O/Cu
LI et al[37]将核壳结构Cu2O/Cu@C负载于氮掺杂石墨烯表面,实现N与Cu基反应位点间协同作用,促进Cu活性位点均匀分布,增强CO2吸附和界面电荷转移能力,并抑制Cu位上竞争的析氢过程,留下更多用于还原CO2的活性位点,进而显示出优异的目标产物甲酸的选择性与稳定性。此外,该课题组通过炭化Cu-btc(btc为苯-1,3,5-三羧酸盐)制备了氮掺杂多孔炭骨架锚定的Cu2O/Cu纳米颗粒催化剂,Cu2O晶格中较高的氮含量可通过改变Cu2O的电子结构来降低*OCHO的结合能,有效促进甲酸生成,当炭化温度为800 ℃时,该催化剂对甲酸的活性和选择性均最佳[38]。
2.1.4Cu单原子

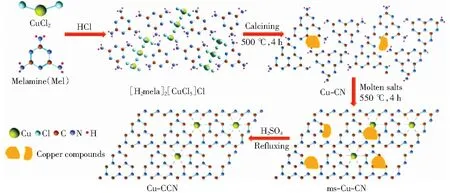
图3 Cu-CCN样品的合成示意图[39]Fig.3 Synthesis process of Cu-CCN samples[39]
Cu-N-C类催化剂被证明可将CO2还原为多碳产物。例如,KARAPINAR et al[41]合成的Cu-N-C材料对CO2还原生成乙醇具有很高的选择性,法拉第效率达55%.其研究还发现,还原过程中Cu-N4活性位点在电解过程中会部分瞬间转化为Cu纳米颗粒,而在电解后又转回为Cu-N4位点,发生可逆提高其稳定性。ZHAO et al[42]在氮掺杂多孔炭包覆单原子铜(Cu-SA/NPC)催化剂上成功实现了将CO2电还原为多碳产物丙酮,产率为336.1 μg/h,同时伴有甲酸、甲醇、乙酸、乙醇的生成。DFT计算结果表明其活性位点是Cu-吡咯N4位点,相比于Cu-吡啶N4位点,Cu-吡咯N4位点降低了CO2活化所需的反应能量,促进了C—C耦合,易于形成C2和C3产物,并提出了一种CO2还原反应路径:CO2→COOH*→CO*→COCO*→COCOH*→COC*→COCH*→COCH2→COCH3*→COCOCH3*→COHCOCH3*→CCOCH3*→CHCOCH3*→CH2COCH3*→CH3COCH3.
2.2 Fe元素修饰
2.2.1单原子Fe
实验与DFT理论计算结果已证明Fe-N4位点是将CO2选择性还原成CO的活性位点,为此研究者采用各种各样的方法来合成高效Fe-N-C催化剂,其中利用碳载体来分散金属活性位点、促进质量传输以及在碳载体中引入N原子与金属原子配位的合成方法已成为研究热点[43]。
ZHANG et al[44]以氧化石墨烯(GO)作为前体,在700~800 ℃的Ar/NH3气氛中对GO和FeCl3的混合物进行退火,通过N键将Fe原子高负载于石墨烯上,抑制了任何铁基纳米晶体产生。氮掺杂石墨烯基体中微量铁原子的引入可形成Fe-N4位,改善CO2吸附和活化性能,提高电化学还原CO2活性过程如图4所示。PAN et al[45]在不加铁源的情况下,以通过化学气相沉积法制备的多壁碳纳米管残留的铁作为铁源来与N配位,形成原子分散的Fe-N4位点,而碳纳米管与其化学解压缩产生的紧密附着在碳纳米管外壁的石墨烯纳米层(GNR)促使Fe-N4位点作为活性和选择性中心,抑制析氢反应,促进CO2活化还原,生成CO法拉第效率高达96%.LI et al[46]使用吸附策略制备了Fe掺杂g-C3N4,再经热解构建了孤立Fe-N4活性位点,获得良好的电催化还原CO2制CO活性和选择性,CO法拉第效率达93%.最近,WANG et al[47]将预先确定数量的预成型ZIF-8前体被扩散二茂铁配体蒸汽碳化,进一步转化为Fe1NC/SX-Y(X代表粒子尺寸,Y代表热解温度)。结果发现,Fe1NC/S1-1 000对电还原CO2具有超高活性,CO法拉第效率达96%.研究发现,其活性位点是Fe-N3活性中心而不是Fe-N4活性中心,且Fe-N3活性中心可显著降低中间羧基和生成CO的能垒,与石墨N物种协同效应,诱导电荷重新分布并增强电子传输,从而提高其CO2还原性能。

图4 (a) 石墨烯层Fe-N4位点电还原CO2自由能;(b)石墨 烯层Fe-N4的优化结构及其氮取代俯视图[44]Fig.4 (a) Free energies of electrocatalytic CO2 reduction for Fe-N4 site in graphene layers; (b) optimal structure of Fe-N4 in graphene layers and a top view of nitrogen substitution[44]
2.2.2Fe配合物
CHOI et al[48]通过静电吸附作用制备了Fe(Ⅲ)卟啉/石墨烯复合材料(FePGF),借助多孔框架结构的石墨烯扩大Fe(Ⅲ)卟啉与CO2间接触面,增强电子转移能力,进而用于在含水电解质中玻璃碳电极上的CO2电催化还原,产物为CO,在550 mV过电位下法拉第效率达97%.MO et al[49]采用回流法合成酞菁铁(FePc)与g-C3N4混合光催化剂(FePc/g-C3N4).研究发现在可见光照射下g-C3N4导带上的电子会转移到FePc的LUMO轨道形成活性铁物种,与CO2结合催化转化CO产量最高达1 696.96 μmol/g.工程化应用试验将该催化剂负载于聚酯纤维(PET)表面,发现在模拟太阳光和自然太阳光下CO产率分别为493.35 μmol/g和490.53 μmol/g,其性能如图5所示。LIU et al[50]通过溶剂热法将石墨烯量子点(GQDs)与铁基金属有机框架(MOFs)[MIL-101(Fe)]结合形成GQD/MIL-101(Fe)复合材料。研究发现,CO2分子被复合材料中铁位上特殊的Fe3+-O团簇吸附生成CO,Fe3+在可见光下通过电子转移形成Fe2+,Fe2+可与O2-直接诱导生成Fe3+,GQDs促进光生电子快速有效迁移。因此,GQD/MIL-101(Fe)光催化剂生成CO产率为224.71 μmol/h/g明显高于MIL-101(Fe)(46.20 μmol/h/g).
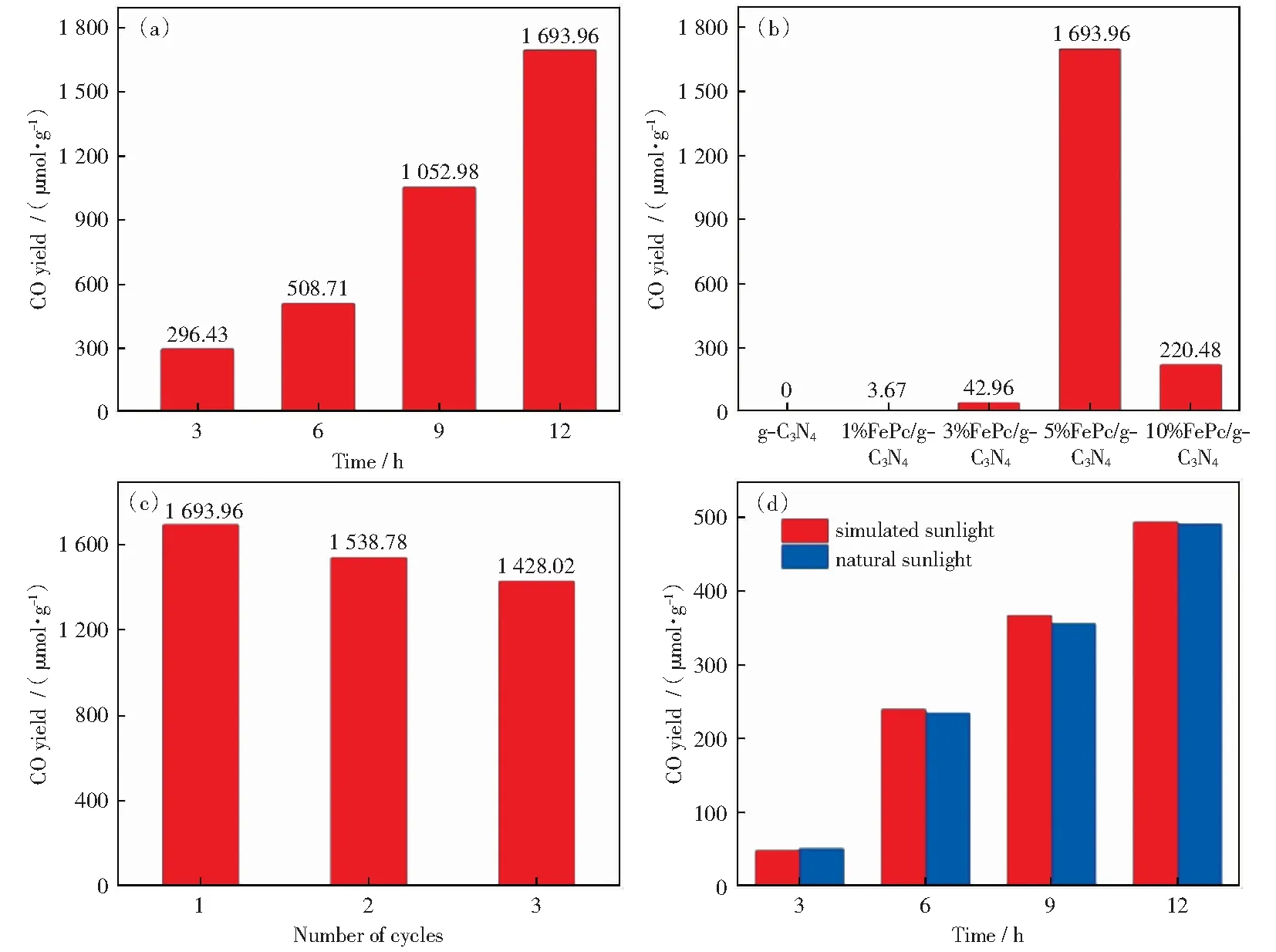
图5 (a) 5% FePc/g-C3N4在12 h内的CO生成图;(b) 不同比率FePc/g-C3N4的活性图; (c) 5% FePc/g-C3N4的循环性能图;(d) FePc/g-C3N4 @PET的活性图[49]Fig.5 (a) CO generation diagram of 5% FePc/g-C3N4 in 12 h; (b) catalytic activity of FePc/g-C3N4 with different FePc content; (c) cycle performance of 5% FePc/g-C3N4; (d) catalytic activity of FePc/g-C3N4 @PET[49]
2.2.3Fe氧化物
α-Fe2O3是窄带隙(~2.2 eV)的n型半导体,具有高稳定性和良好可见光响应能力。然而,较高的光生载流子复合率及较低的导带位置使其无法满足CO2还原需求。因此,通过构建异质结将α-Fe2O3与其他材料复合来提高光催化活性是有必要的[51]。JIANG et al[52]构建Z型α-Fe2O3/g-C3N4光催化剂,借助铁碱性使α-Fe2O3产生相当强CO2吸附位点促进CO2吸附,独特的Z型结构有效促进光生电子-空穴对分离,提高g-C3N4导带上电子还原能力,实现无助催化剂和牺牲剂光催化还原CO2生成CO(27.2 μmol/g/h).MU et al[53]引入超薄氧化石墨烯(USGO)纳米片用作电子传导介质,构建高效Z型CsPbBr3/USGO/α-Fe2O3光催化剂,结果证明具有极好电子迁移率的USGO显著加快CsPbBr3与α-Fe2O3之间光生载流子的分离和迁移,使其CO产率高达147.6 μmol/g/h.
2.3 Ni元素修饰
单金属镍-氮掺杂碳材料(M-N-C)催化剂被认为是高效理想且具有吸引力的还原催化剂之一,在CO2还原领域备受瞩目,Ni元素主要存在形式为:Ni纳米颗粒、Ni单原子以及Ni纳米颗粒和单原子共存[54]。
2.3.1Ni纳米颗粒
负载型镍纳米颗粒催化剂由于比贵金属成本低、含量高且具备良好加氢还原作用,在CO2还原领域备受关注,但裸露的镍纳米颗粒通常稳定性较差,若将其封装到碳材料中,可有效改善催化剂的光/电催化还原CO2性能。例如,LIN et al[55]通过在N2气氛下对含Ni金属有机骨架(Ni-MOF)进行热退火制备了具有大表面积和高孔隙结构的Ni@GC中空球,金属Ni纳米粒子被几层石墨碳(GC)包围,表现出石墨壳极好的电荷迁移率以及Ni-C键合,形成富电子Ni位点,光致电子可快速传输到Ni中心,促进了CO2的亲电活化和转化以生成CO,在可见光照射下与钌光敏剂配合使用,CO产率为9.0 mmol/h/g(如图6).此外该课题组还合成了由碳壳内高度分散的Ni纳米粒子组成的分层多孔Ni@C空心球,可提供高表面积和丰富的孤立活性位点,用于CO2吸附/活化和氧化还原过程,显示出优异的CO2甲烷化反应性能,具备良好的选择性和稳定性[56]。

图6 Ni@GC光敏化CO2还原过程[55]Fig.6 Photosensitized CO2 reduction process of Ni@GC[55]
此外,YUAN et al[57]将镍纳米颗粒(NPs)原位包封到N掺杂碳纳米管和纳米片基底(Ni/N-CHSs)中优化氮掺杂碳(N-C)的CO2还原反应,研究发现Ni NPs的加入可调节反应表面的局域电子分布,大幅度降低CO2还原反应的活化势垒进而提高CO2还原活性。JIA et al[58]采用碳包覆Ni纳米颗粒,可有效抑制析氢显著提高电催化还原CO2为CO的活性,0.59 V超电势下,CO法拉第效率约为94%,甚至可与最佳单原子Ni位相媲美。密度泛函理论计算表明,N掺杂碳材料主要是石墨氮和吡咯氮以及金属Ni通过稳定化*COOH而不影响*CO的脱附能力来增强活性,如图7所示。最近,WANG et al[59]报道了一种还原氧化石墨烯负载N掺杂碳封装镍纳米颗粒的(Ni@N-C/rGO)催化剂,并对金属与碳包覆层之间的相互作用机理进行深入研究。结果表明,吡咯氮能够促进CO2吸附和活化,Ni 3d电子向N-C骨架π轨道的自发电荷转移促使*CO易于从活性位脱附,从而提高了电催化还原CO2转化CO的性能。
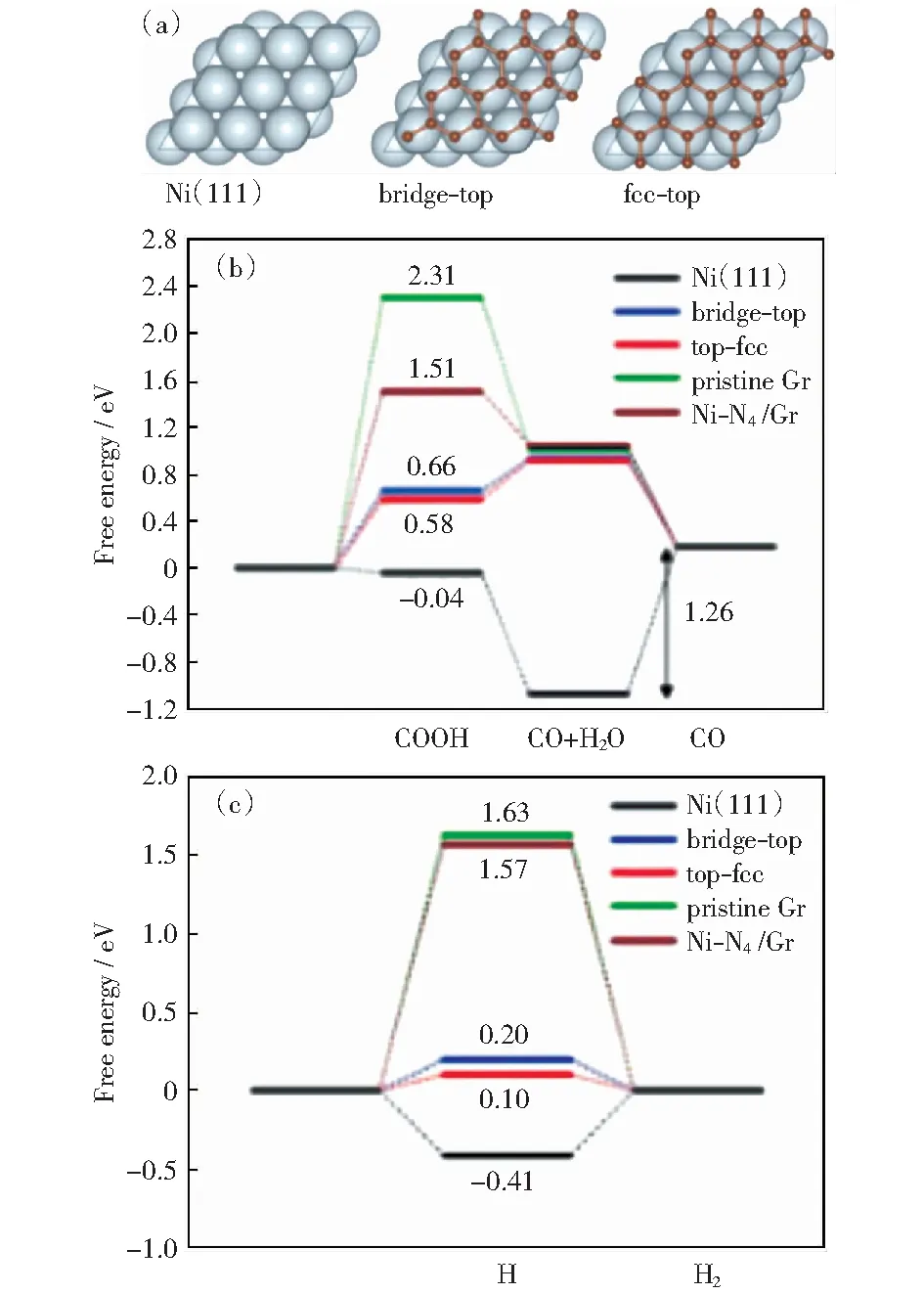
图7 (a) Ni(111)和Gr/Ni(111)两种石墨烯结构的计算模型; (b) 不同催化剂电化学还原CO2为CO的自由能 和(c)析氢反应的自由能[58]Fig.7 (a) Calculation models of Ni(111) and Gr/Ni(111) graphene structures; (b) free energies of electrochemical CO2 reduction to CO and (c) hydrogen evolution for different catalysts[58]
光催化还原CO2领域,MATEO et al[60]研究了缺陷石墨烯负载NiO/Ni纳米颗粒用于在200 ℃左右H2辅助光催化还原CO2的活性,发现CH4产率达244.8 μL/h.热辅助是去除反应生成中不利的H2O分子加之连续流动条件,可使NiO/Ni-G光催化剂比间歇模式更容易脱去不良水分子,此外,石墨烯促进了光生电子-空穴对的有效分离,增强了CO2生成甲烷的活性和稳定性。HAN et al[61]在真空条件下,将Ni2+光还原成Ni颗粒沉积在石墨碳化氮(g-C3N4)上。空气气氛时,Ni颗粒表面被氧化形成NiO壳由此形成了Ni/NiO/g-C3N4光催化剂,光照2 h后CO产率达27.9 μmol/g/h.
2.3.2Ni单原子
原子分散金属(M)中心与富氮碳材料中的氮原子键合来构造金属-氮-碳(M-N-C)基材料已被证明是获得单原子催化剂的有效方法,其中N原子可锚定单个M原子并避免其在合成或反应期间聚集成纳米颗粒。例如,LU et al[62]将聚多巴胺(PDA)涂覆在多孔g-C3N4表面随后从金属前体溶液中锚定Ni2+,再通过热解稳定金属原子中心并形成Ni-N配位活性中心,有效促进CO2转化CO高选择性和活性。YUAN et al[63]以SiO2/聚多巴胺球体为氮和碳源并有效吸附Ni2+离子,热解后聚多巴胺球体转化为N-C空心球,Ni2+离子在高温下会被炭化的有机分子还原,并进一步被N-C基体中N原子束缚,形成原子分散Ni物种的氮掺杂中空碳球体(SA-Ni/N-Cs)新型CO2还原电催化剂,如图8所示,显示出良好的CO2转化为CO活性和选择性。

图8 SA-Ni/N-CS的(a,b)SEM,(c) TEM,(d) HAADF-STEM,(e) SAED和(f)EDS元素映射[63]Fig.8 (a,b) SEM images, (c) TEM images (d) HAADF-STEM images (e) SAED pattern, and (f) EDS element mapping of SA-Ni/N-CS[63]
另外,HOU et al[64]采用自牺牲模板方法,通过裂解ZnO@ZIF-NiZn核-壳纳米棒和去除ZnO,成功地在多孔氮掺杂碳纳米管(NCTs)中制备原子分散Ni-N物种的高活性CO2还原电催化剂,与ZIF-NiZn多面体热解法制备的多孔炭Ni单原子(Ni/NC)相比,Ni/NCTs生成CO的活性显著提高,CO法拉第电流效率高达100%。除了上述的自牺牲模板法以外,一步热解法也被用来合成单原子催化剂。例如,MA et al[65]通过在900 ℃热解柠檬酸和三聚氰胺制备了Ni单原子均匀分散的氮共掺杂碳纳米片(Ni-N-CNSs)(厚度约1.5 nm)催化剂,其中,氮锚定Ni单原子有利于CO2吸附和CO解吸,并抑制了竞争性的析氢反应,从而获得了优异的CO2还原活性。
2.3.3Ni纳米颗粒和单原子共存
GANG et al[66]利用一步化学气相沉积法获得了一种在氮掺杂碳纳米片(CNS)和碳纳米管(CNT)混合物上共存单原子Ni位点和Ni纳米颗粒的催化剂(Ni-N-CNS/CNT),其中,CNS和CNT的分层结构提供高比表面积和低电荷转移阻力,石墨层包覆Ni纳米粒子可抑制析氢反应,形成Ni-N活性位使该复合催化剂获得CO高选择性与活性。WEN et al[67]认为氮加入可优化镍位电子结构从而将惰性反应位激活为具有低价镍的活性反应位。实验结果证明以单Ni位原子分散和表面N配位Ni NPs存在的低价Ni位在促进CO2吸附、CO解吸及CO2转化CO过程中起到关键性作用。
2.4 Co元素修饰
钴(Co)具有高导电性、热稳定性、高还原催化性能、多种氧化态(如CoⅡ、CoⅢ和CoⅣ)等诸多优点。因此,钴基催化剂负载于高比表面积碳材料成为光/电催化CO2还原领域研究热点之一。
2.4.1Co基氧化物
BHARATH et al[68]水热法将自组装Co3O4纳米球接枝N-RGO同时在碱性条件下阴极还原CO2和阳极降解甲基橙(MB)染料,作用机理如图9所示。N-RGO可诱导形成更多Co2+活性物种同时形成异质结构,进而电解水分子产生大量羟基自由基用于降解MB放出H+和e-,随后与阴极CO2发生还原反应高选择性生成CH3OH.因此,Co3O4/N-RGO被证明是一种高效稳定的双功能电催化剂。CALVILLO et al[69]采用水热法设计了N掺杂石墨烯负载纳米立方形Co3O4(NG-Co3O4)体系,不仅对金属氧化物结构形貌调控,而且在CO2还原过程将Co3O4还原为CoO及少部分Co,而CoO是催化过程中真正的活性物种,明显增强了电催化还原CO2活性。
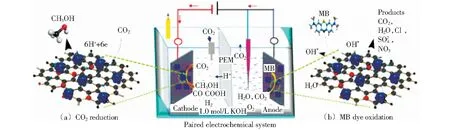
图9 Co3O4/N-RGO阴极还原CO2和阳极氧化有机物的机理示意图[68]Fig.9 Mechanism diagram of cathodic CO2 reduction and anodic oxidation of organics over Co3O4/N-RGO[68]
2020年,YANG et al[70]报道了封装在碳纳米管尖端内超小型Co3O4纳米颗粒的电还原CO2催化剂(Co/CNTs).一方面,独特结构增大比表面积,暴露更多活性位点用于活化CO2,同时防止Co3O4纳米颗粒在电解过程中聚集或腐蚀;另一方面,Co3O4纳米颗粒周围高度石墨化的石墨烯层有助于电子转移,致使Co/CNTs显现出了优异的还原CO2活性和稳定性。然而,HUANG et al[71]采用一锅合成策略将5 nm钴纳米颗粒分散在氮掺杂单层石墨烯(SL-NG)上,部分氧化的Co纳米颗粒中适量Co3O4有利于CO2吸附和活化,SL-NG的高比表面积和导电性促进CO2还原所需的质子和电子生成与转移,将CO2电催化还原为甲醇与甲酸。值得注意的是,Co3O4含量过多时活性下降,归因于Co3O4比Co导电性低,降低了CO2与电极表面之间的电子迁移效率。
2.4.2Co配合物
有机金属卟啉和金属酞菁催化剂在化学稳定性、分子水平结构剪裁等具有优势,研究者以碳纳米管和石墨烯等碳材料作为导电基底,固定金属配合物进行催化CO2还原,表现出优越的CO2还原活性[72-74]。但也存在金属配合物易聚集导致溶解度低、加工困难等问题。为此,CHOI et al[75]通过π-π堆积将高可溶性、空间受阻的Co(Ⅱ)酞菁(CoPc-A)固定在化学转化石墨烯(CCG)上,与类似的钴酞菁/石墨烯催化剂相比,CCG/CoPc-A分子结构的空间位阻改善(CO2、H+和CO)质量传输进入催化活性Co物种,而长烷氧基链有助于抑制石墨烯片上的酞菁聚集,并通过创建疏水空间,允许CO2更好地进入,显著增强其活性,如图10(a)所示。GU et al[76]研究了氨基取代钴卟啉(CoTAP)共价接枝在碳纳米管(CNTs)表面的电催化还原CO2活性如图10(b)所示,发现引入氨基可提高Co中心的电子密度,CoTAP与碳纳米管表面之间的共价连接既缓解了卟啉催化剂聚集,又加快界面间电子迁移,从而提高其反应速率。此外,光催化还原CO2领域已报道,如ROY et al[77]通过原位聚合方法将钴酞菁(CoPPc)沉积到介孔氮化碳(mpg-CNx)上形成可见光选择性还原CO2的混合催化剂(mpg-CNx/CoPPc),结果表明光激发的电子可从CNx导带转移到CoPPc,生成CoI中心,与CO2结合,随后与(mpg-CNx)*或(mpg-CNx)-第二次电子转移反应生成CO.ZHAO et al[78]将光敏多孔金属和磁性1 200 Co-C复合材料(PMMCoCC-1200)与[Ru(bpy)3]Cl2光敏剂偶联,中心金属Co是激活吸附的CO2分子的活性位点,钴金属表面的石墨碳涂层促进了光敏剂Ru(bpy)32+的三重态金属到配体的电荷转移,从而提高CO2还原效率和CO选择性。
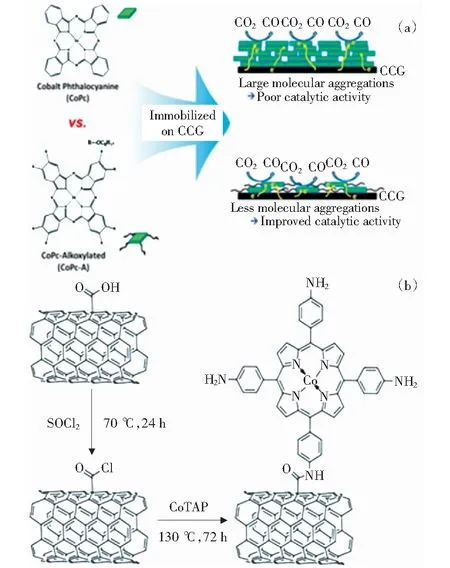
图10 (a) CCG/CoPc和CCG/CoPc-A还原CO2机理; (b) CoTAP/碳纳米管的共价连接示意图[75-76]Fig.10 (a) CO2 reduction mechanism of CCG/CoPc and CCG/ CoPc-A complexes; (b) covalent connection diagram of CoTAP and carbon nanotubes[75-76]
2.4.3单Co位点

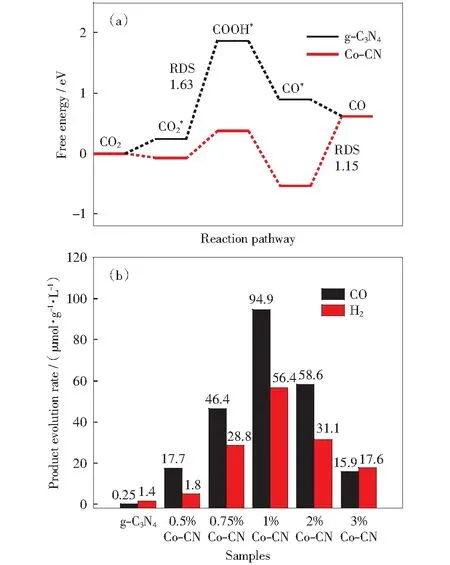
图11 (a) g-C3N4和Co-CN还原CO2为CO自由能; (b) 不同钴载量g-C3N4的CO产生速率[80]Fig.11 (a) Free energies of CO2 reduction to CO over g-C3N4 and Co-CN; (b) CO evolution rate of g-C3N4 with different Co loading[80]
2.5 其他金属元素修饰
ZARANDI et al[81]将组胺修饰的还原氧化石墨烯(His-rGO)和铂(Pt)先后沉积于玻璃碳电极(GCE)上形成Pt@His-rGO/GCE用于电催化还原CO2.组胺作为一种杂环化合物,具有富电子环,使rGO功能化,增强CO2吸附能力。Pt纳米颗粒改性还原氧化石墨烯可提供CO2还原为甲醇所需氢自由基。ZHAO et al[82]研究了不同胺类对rGO负载超细Au纳米颗粒(rGO-Au)电催化还原CO2的影响规律,研究发现,线性油胺促进CO形成,而支化多胺则抑制CO生成。LYU et al[83]将三聚氰胺泡沫浸渍在氧化石墨烯和硝酸银混合溶液中,再经热解合成3D石墨烯包裹N掺杂碳泡沫负载的Ag纳米颗粒催化剂(Ag-G-NCF),其电还原CO2生成乙醇的法拉第效率达85.2%(-0.6 V).DFT计算表明,吡啶N具有最高的束缚能(2.42 eV),促使Ag纳米粒子将CO*中间体转化为C2产物。最为重要的是,三维大孔层次结构的3D石墨烯大比表面积提供了丰富催化位点,并与CO2和CO*发生相互作用,将CO*留在体系中进行二聚还原,从而提高乙醇的选择性和活性。
3 双金属元素修饰
近年来,除碳基材料负载单金属元素构筑光电催化还原CO2体系外,双金属元素修饰碳基材料催化剂体系也取得了一定进展,如双金属氧化物[84-85]、单原子共存[86-87]、合金纳米颗粒[88-89]等。
3.1 双金属氧化物
WOYESSA et al[84]采用水热法合成Cu2O-FeO/g-C3N4复合催化剂,借助混合金属氧化物氧空位提高CO2吸附能力,与g-C3N4形成界面效应构建高电化学活性界面,增强电催化吸附活化还原CO2活性和选择性。DONGARE et al[85]采用共沉淀法制备了N掺杂石墨烯负载的氧化锌和氧化铜纳米颗粒(CuZnx/NGN)催化剂,并通过调整ZnO的负载量来调控电催化还原CO2成多碳产物的产率。结果表明ZnO负载量为20%的CuZnx/NGN显示出了最高的乙醇产率(在-0.8 eV下FE为34.25%),并提出了可能生成乙醇的原因是ZnO纳米粒子产生的CO增加了*CO在CuO上的局部表面覆盖,从而提高了C—C耦合率,有利于多碳产物的产生。
3.2 双金属单原子共存
JIAO et al[86]报道了Fe、Ni共掺杂ZnO纳米颗粒组装成MOF材料并构建N桥接的单原子Fe1-Ni1-N-C催化剂,其中,单原子Fe和Ni位点协同作用增加CO2吸附量同时降低COOH*能垒,进而提高电催化CO2还原为CO活性和选择性。CHENG et al[87]合成了具有原子分散的M-Nx物种的N掺杂多孔碳嵌入CuCo纳米颗粒的混合催化剂(CuCo/NC)用于光电还原CO2,结果显示从Co原子到Cu原子的电子转移增强,使得COOH*和CO*吸附更稳定,并使CO*转化为甲醇。
3.3 双金属合金纳米颗粒
LU et al[88]引入Fe/Ni纳米合金包裹在氮掺杂碳框架结构构建高效电催化剂,在-1.0 eV(相对于可逆氢电极)下,电还原CO2为CO法拉第效率高达96%.WANG et al[89]通过静电纺丝、磷化、炭化等步骤制备了多通道中空炭纤维(MHCFs)限域于镍钴氧磷化纳米粒子(NiCoOP NPs)光还原CO2催化剂(NiCoOP-NPs@MHCFs),高导电性能碳基体促进光生载流子的有效分离与迁移,中孔结构增强光吸收能力,多通道和开口端提高CO2吸附量且抑制氧磷化金属NPs团聚,表现出良好光还原CO2活性,其结构形貌如图12所示。

图12 NiCoOP-NPs@MHCFs的FESEM图(a-d)和TEM图(e,f)[89]Fig.12 FESEM (a-d) and TEM images (e,f) of NiCoOP-NPs@MHCFs[89]
4 结束语
深入推进“双碳”目标进而缓解能源危机和CO2资源化利用是目前中国乃至全世界极度关注的重点课题。近年来,构筑金属修饰碳基材料体系,实现金属与碳基载体之间协同作用与界面效应,最终取得优异的催化还原CO2活性已成为该领域的研究热点。本文总结单金属元素(Fe、Co、Ni、Cu)及双金属元素修饰碳基材料的制备方法、作用原理及其增强CO2还原活性和选择性的关联规律。虽然,金属修饰碳基材料体系在CO2还原应用领域已取得一定研究进展,但仍存在许多问题亟待解决与挑战:
1) 从单金属元素纳米颗粒、氧化物、配合物、单原子等不同形式修饰碳基材料体系光/电还原CO2领域可知,Cu基催化剂还原CO2为多碳产物能力较强,但副产物导致其选择性较差;Fe、Ni基催化剂还原CO2为CO具有优异选择性和活性,但将CO2还原成其他产物能力仍有待提高;Co基催化剂对目标产物甲醇、甲酸、CO生成表现出良好活性,但稳定性仍待提高。
2) 从双金属元素修饰碳基材料体系方面可知,相比于单金属,双金属协同作用表现出更高的活性和选择性,且可把CO2还原为CO、乙醇、甲醇等产物,但两种金属比例精确控制和制备过程较为困难,更重要的是增强CO2还原活性的作用机理尚不清晰,仍有待深入探究。
3) 针对金属元素修饰碳基材料体系而言,在碳基材料中引入N原子可促进金属分散均匀并改变金属电子结构进而增强CO2吸附活化还原性能。其中,单原子金属-氮掺杂碳材料体系颇受欢迎。虽然实验和理论计算已证明金属与N原子之间存在相互作用,但由于含氮官能团的多样性,仍缺乏坚实理论基础来阐明与金属发生相互作用的含氮官能团的确切种类,以及氮掺杂碳材料和金属纳米颗粒之间的形成机制仍不清晰。
4) 对于未来催化剂实际应用方面,需要发展金属元素修饰碳基材料体系的简易温和、低廉操作、高效可控的制备方法进行规模化生产。
因此,氮掺杂碳基材料负载金属体系作为光/电催化还原CO2的理想催化剂体系之一,应注重于开发多级孔结构的新特性氮掺杂碳基材料负载金属催化剂的制备方法,侧重于研究氮掺杂碳材料与金属之间的形成机制并找出影响热解过程的关键因素;此外,着重于控制只有单一含氮官能团的氮掺杂碳材料负载金属催化剂的合成,并结合理论计算理解含氮官能团与金属之间的相互作用,建立催化剂微观结构与宏观性能的关联规律,以期研制高效光/电还原CO2的理想催化剂体系。

