3例结直肠癌肝转移患者行同期NOSES的MDT诊疗体会
王玉柳明,胡汉卿,王春林,熊寰,刘明,汤庆超△,王贵玉△,王锡山
1 哈尔滨医科大学附属第二医院结直肠肿瘤外科 黑龙江哈尔滨 150081
2 国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院结直肠外科 北京 100021
结直肠癌是全球常见的恶性肿瘤之一[1]。世界卫生组织国际癌症研究机构最新统计数据显示,结直肠癌的发病率位于恶性肿瘤的第三位,死亡率位于第二位[2]。肝脏是结直肠癌最常见的转移部位,外科治疗在结直肠癌肝转移(colorectal liver metastases,CRLM)中发挥重要作用。目前的研究表明,手术切除仍然是CRLM的最佳治疗选择。如果手术能完全切除原发灶及转移瘤,那么CRLM患者5年的总生存率(overall survival,OS)可达50%,10年OS可达25%[3-4]。
结直肠癌的规范化诊疗尤为重要。近年来,中国临床肿瘤学会(CSCO)和中华医学会相关指南均建议将结直肠癌患者,尤其是转移性结直肠癌患者纳入MDT评估[5-6]。MDT实施过程中,多学科医师共同分析患者的临床表现及影像学、病理学、分子生物学资料,对患者一般状况、疾病诊断、侵犯范围、发展趋势和预后作出综合评估,并以当前国内外的诊疗规范、指南和循证医学为依据,结合现有的治疗手段,制定适合患者的整体治疗策略[5-8]。在MDT模式下对转移性结直肠癌患者进行手术治疗,更有利于实现同期R0切除手术或通过综合治疗达到无疾病 (no evidence of disease,NED) 状态[7-8]。NOSES是使用腹腔镜、机器人、肛门内镜微创手术或软质内镜等设备平台完成腹盆腔内各种常规手术操作(切除与重建),经人体自然腔道(直肠、阴道或口腔)取标本的腹壁无辅助切口手术[9]。NOSES已在国内多中心广泛开展,被誉为“微创中的微创”[10-12]。目前,国内部分医学中心已经采用NOSES对转移性结直肠癌患者进行治疗。笔者团队在3例CRLM患者的MDT诊疗过程中开展了同期NOSES,取得了较好的治疗效果,现将诊治经验分享如下。
1 结肠癌肝转移同期经阴道NOSES病例
1.1 初诊情况
患者女性,62岁,因“间断性便血7天”于2020年4月25日入住哈尔滨医科大学附属第二医院结直肠肿瘤外科。患者否认既往病史,否认肿瘤家族史。
入院体格检查:浅表未触及肿大淋巴结,心肺查体未见明显异常;直肠指诊未触及肿物。ECOG评分:1分。PS评分:1分。CRS评分:3分。体表面积(body surface area,BSA):1.65 m2。
辅助检查:肠镜示距肛门65 cm处有一肿物,占肠腔2/3周,阻塞肠腔致无法继续进镜。肠镜病理示腺癌。CT平扫示升结肠管壁不规则增厚,病变累及浆膜面,系膜内多发肿大淋巴结,肝多发占位,可疑转移瘤。进一步行肝胆脾256排增强CT示肝Ⅳ、Ⅵ、Ⅷ段各有一枚转移瘤,最大直径27 mm。肿瘤标志物:CEA 6.64 ng/mL,CA19-9 13.26 U/mL。
临床诊断:结肠腺癌(cT3NxM1a)Ⅳa期,肝多发转移瘤。
1.2 诊疗过程
1.2.1 第一次MDT讨论及治疗情况
1.2.1.1 第一次MDT讨论(2020年5月6日) 影像科及病理科:患者经病理确诊为结肠腺癌,影像分期考虑为cT3NxM1a期,诊断为转移性结肠癌。
肝脏外科:患者三处肝转移瘤评估为初始可切除,但患者CRS评分较高,目前手术创伤较大且复发风险高。
结直肠肿瘤外科:患者原发灶有间断性出血症状,全身状态尚可,无贫血,可优先进行综合治疗。
放疗科:右半结肠癌肝转移优先全身化疗,暂不考虑加入放疗。
肿瘤内科:患者基因检测结果为BRAF、EZH2、FAT4、SPEN基因错义突变,微卫星稳定型(MSS),建议行新辅助治疗后再次评估,但应警惕原发灶出血、肠梗阻等情况。
讨论总结:患者为CRLM初始可切除组,考虑患者临床表现且CRS评分较高,建议优先进行新辅助治疗,拟采用XELOX+贝伐珠单抗治疗4周期后再次进行MDT评估。
1.2.1.2 治疗情况 患者于2020年5月7日开始行2周期XELOX+贝伐珠单抗治疗。完成第2周期的治疗后,出现腹痛、便血症状,腹痛以右上腹为主,呈阵发性,伴间断性停止排气、排粪。2020年6月13日查体:右上腹压痛,无反跳痛,轻度肌紧张。腹部立位平片提示腹部肠管扩张积气,部分肠管内可见气液平,考虑肠梗阻。复查肝胆脾256排增强CT(图1),未见新增转移病灶,三处肝转移瘤直径变化不明显。患者复查血常规无贫血指征,肿瘤标志物未查。按肠梗阻给予对症治疗。
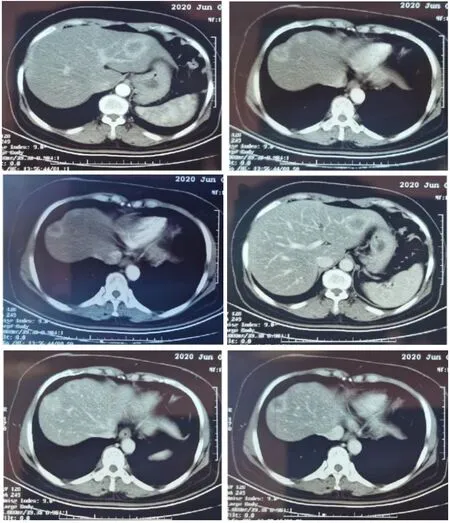
图1 复查肝胆脾256排增强CT结果
1.2.2 第二次MDT讨论及手术治疗
1.2.2.1 第二次MDT讨论(2020年6月16日) 肿瘤内科:患者原发灶症状明显,应中止内科治疗,考虑外科介入。
结直肠肿瘤外科:患者原发灶有出血、肠梗阻表现,拟行手术治疗。
肝脏外科:患者一般状态尚可,复查增强CT未见新增转移病灶,三处肝转移瘤为初始可切除,可试行同期手术。
讨论总结:患者第一次MDT讨论诊断为转移性结肠癌,考虑患者临床表现且CRS评分较高,建议优先进行新辅助治疗,拟采用XELOX+贝伐珠单抗治疗4周期后再次进行MDT评估。但患者完成第2周期治疗后出现腹痛、便血及肠梗阻症状,根据患者病情变化,需要中止内科治疗,行原发灶切除手术。结合肝脏外科意见,拟同期手术治疗,术后根据病理情况继续全身治疗。
1.2.2.2 手术治疗 患者于2020年6月18日于全麻下行腹部无辅助切口经阴道取标本的腹腔镜下右半结肠癌根治术+左半肝切除+肝Ⅵ、Ⅷ段转移瘤切除术。术中探查,肿瘤位于升结肠上段,未侵出肠壁,肝Ⅵ、Ⅷ段转移瘤于肝表面可见。术中沿肠系膜上静脉走行方向依次结扎回结肠动静脉,右结肠动静脉及中结肠动脉右支,清扫至第3站淋巴结。充分游离系膜,裸化横结肠及距回盲部10 cm处回肠系膜,行腹腔镜下回肠—横结肠侧侧吻合,切除标本并放入标本袋内封闭(同NOSES-Ⅷ式操作步骤)。而后于腹腔镜下切除左半肝及肝Ⅵ、Ⅷ段转移瘤,另置标本袋内。助手以碘伏水冲洗阴道后,术者以超声刀打开阴道后穹窿,经阴道拖出标本,倒刺线关闭阴道后穹窿切口。术后标本及腹壁图片见图2、图3。手术时间350 min,术中出血量50 mL,手术过程顺利。病理为ypT3N1bM1a期,切缘均阴性,达到R0切除。
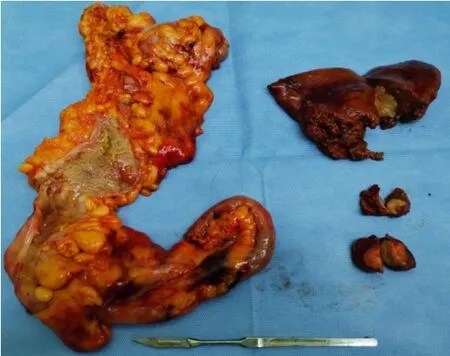
图2 手术标本图片
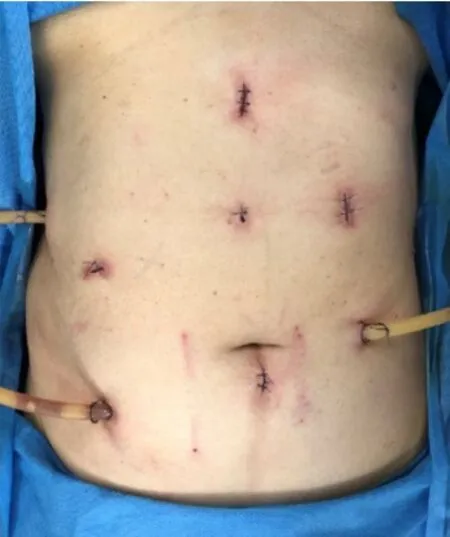
图3 术后腹壁图片
患者术后恢复顺利,无明显疼痛感。术后1个月复查肿瘤标志物均正常,继续于我院完成Xelox+贝伐珠单抗方案治疗6周期。术后半年复查未见复发及转移征象,复查时肿瘤标志物为CEA 2.13 ng/mL,CA19-9 9.44 U/mL。现患者规律随访中,一般状态良好,无复发及转移征象。
2 直肠癌肝转移同期借道NOSES病例
2.1 初诊情况
男性患者,51岁,因“排粪习惯改变1月”于2020年12月16日入住哈尔滨医科大学附属第二医院结直肠肿瘤外科。患者否认既往病史,否认肿瘤家族史。
入院体格检查:浅表未触及肿大淋巴结,心肺查体无明显异常;直肠指诊未触及肿物,退指指套见染血。患者ECOG评分:1分。PS评分:1分。CRS评分:3分。BSA:1.87 m2。
辅助检查:肠镜示距肛门10~13 cm有一巨大菜花样病变,表面糜烂,质脆易出血,占肠腔3/4周,内镜尚能通过。病理示腺癌。CT平扫示直肠占位、肝多发占位。肝胆脾1.5 T增强MRI示肝多发转移瘤(S3段直径13 mm,S5段直径26 mm,S7段直径31 mm)(图4)。直肠MRI示直肠癌T3N1期,标本环周直径约6.2 cm。肿瘤标志物:CEA 161.31 ng/mL,CA19-9>1 200 U/mL。

图4 肝胆脾1.5 T增强MRI结果
临床诊断:直肠腺癌(cT3N1M1a)Ⅳa期,肝多发转移瘤。
2.2 诊疗过程
2.2.1 第一次MDT讨论及治疗情况
2.2.1.1 第一次MDT讨论(2020年12月20号) 影像科及病理科:患者经病理确诊为直肠腺癌,影像分期为cT3N1M1a期,诊断为转移性直肠癌。
肝脏外科:患者为潜在可切除组,S5段肝转移瘤位置较深,与肝中静脉属支关系较为密切,且CRS评分较高,目前手术创伤较大且术后易复发。
结直肠外科:患者原发灶无明显出血、肠梗阻等症状,可先行全身治疗。
放疗科:转移性直肠癌治疗先以全身化疗为主,且患者原发灶无明显症状,暂不考虑加入放疗。
肿瘤内科:患者属于转移性直肠癌潜在可切除组,建议行基因检测,根据基因型给予转化治疗后再次评估并制定后续治疗方案。
讨论总结:完善基因检测,进行转化治疗,并定期评估。
2.2.1.2 治疗情况 患者完善基因检测,基因型为KRAS突变型,NRAS、BRAF野生型,微卫星稳定型(MSS)。于2020年12月28日开始行4周期FOLFOX+贝伐珠单抗方案治疗。2021年3月3日复查肝胆脾1.5 T增强MRI,转移瘤退缩明显(表1)。CT提示直肠原发灶亦有缩小。CEA 26.27 ng/mL,CA19-9>1 200 U/mL。

表1 肝转移瘤转化治疗前后直径对比mm
2.2.2 第二次MDT讨论及手术治疗
2.2.2.1 第二次MDT讨论(2021年3月8日) 肿瘤内科:患者肝脏病灶退缩明显,但标志物水平仍较高,可以继续行内科治疗,也可以考虑外科介入。
结直肠肿瘤外科、肝脏外科:患者目前为原发灶、转移瘤可切除状态,一般状态尚可,可试行同期手术治疗。
讨论总结:患者目前肝脏病灶退缩良好,为可切除状态,拟行外科手术治疗。为减少创伤,制定手术方案如下:直肠原发灶及S3、S7段转移瘤行同期手术切除,S5段转移瘤位置较深,拟行射频消融治疗。术后根据病理结果进行后续治疗。
2.2.2.2 手术治疗 患者于2021年3月12日于全麻下行经肝切口取标本的腹腔镜下直肠癌根治术+开腹肝S3、S7段转移瘤切除术(借道NOSES)。术中探查,肿瘤位于直肠上段腹膜返折上方,肝S3、S7段转移瘤于肝表面可见。术中高位清扫+低位结扎肠系膜下动脉,保留左结肠动脉,完成系膜裁剪及肠管裸化后经肿瘤下方预切线处打开肠壁,利用无菌保护套建立通道,助手经肛门送入抵钉座。于肿瘤上方预切线处开口,置入抵钉座后于肿瘤上、下方离断肠管,标本放入标本袋内封存,而后经结肠远侧断端切开小口,显露抵钉座。经肛门置入吻合器体部,完成端—端吻合(操作同NOSES-IV式)。而后经肝切口取出标本(借道NOSES),并于直视下行肝S3段、肝S7段转移瘤切除术(图5)。手术时间305 min,术中出血量50 mL,手术过程顺利。

图5 术后标本图片
术后第2天患者恢复排气并离床活动,术后第3天少量流质饮食。术后1周行超声引导下射频消融术(图6),灭活S5段转移瘤,至此达到NED状态。患者术后病理为ypT3N1bM1a期,术后1个月复查,CEA 10.17 ng/mL,CA19-9 858.80 U/mL。患者术后继续于我院行辅助治疗,拟行8周期FOLFOX+贝伐珠单抗方案治疗,在完成6个周期的治疗后,患者因个人原因停止继续治疗,术后半年复查未见明显异常,现规律随访中,术后1年复查结果待完善。
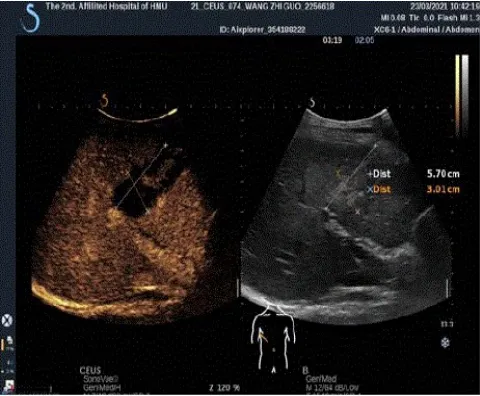
图6 射频消融后彩超造影图
3 直肠癌肝转移同期经肛门NOSES病例
3.1 初诊情况
男性患者,50岁,因“便血2月余,加重伴间断性停止排气排粪1周”于2021年4月20日入住哈尔滨医科大学附属第二医院结直肠肿瘤外科。患者否认既往病史,否认肿瘤家族史。
入院体格检查:浅表未触及肿大淋巴结,心肺查体无明显异常。直肠指诊未触及肿物,退指指套见染血。患者ECOG评分:1分。PS评分:1分。CRS评分:3分。BSA:1.62 m2。
辅助检查:肠镜示距肛门口12 cm可见一巨大不规则生长肿物,环肠腔生长,表面充血、破溃,镜身无法通过。病理示腺癌。CT平扫示肝脏多发低密度灶。完善肝胆脾1.5 T增强MRI示肝内多发异常信号,考虑肝转移瘤(图7)。直肠MRI示直肠癌T3N1期,标本环周直径约5.2 cm。
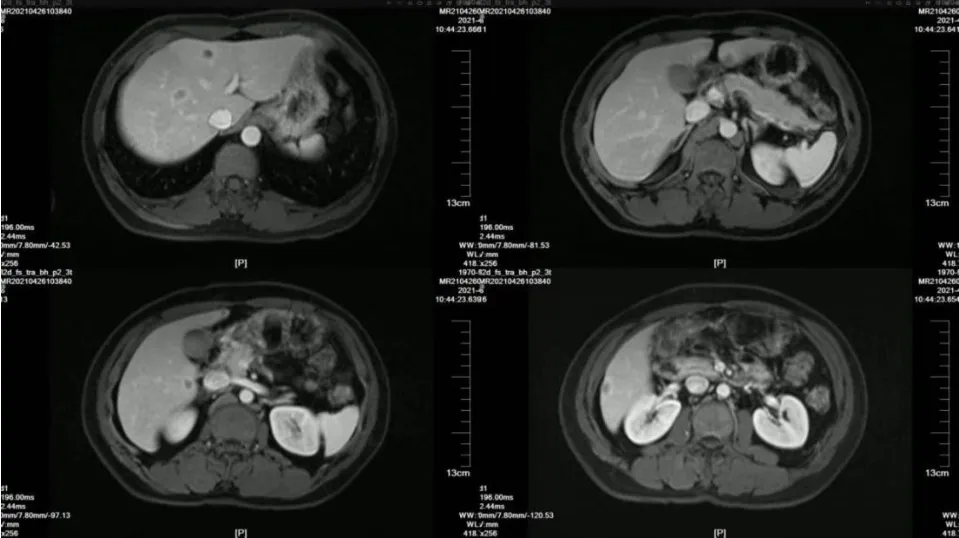
图7 肝胆脾1.5 T增强MRI结果
临床诊断:直肠腺癌(cT3N1M1a)Ⅳa期,肝多发转移瘤。
3.2 诊疗过程
3.2.1 第一次MDT讨论及手术治疗
3.2.1.1 第一次MDT讨论(2021年4月25日) 影像科及病理科:患者经病理确诊为直肠腺癌,影像分期为cT3N1M1a期,诊断为转移性直肠癌。
肝脏外科:MRI提示患者共有七处转移瘤,部分表浅转移瘤可同期切除,深在肝转移瘤可术后行超声引导下射频消融治疗,但CRS评分较高,需警惕术后复发风险。
结直肠肿瘤外科:患者一般状态尚可,可耐受手术治疗。原发灶目前有出血、肠梗阻等症状,需予以手术治疗,可争取原发灶与转移瘤同期手术。
放疗科:患者原发灶症状明显,应优先手术治疗。
肿瘤内科:综合分析患者病情,建议先行手术切除,术后补充射频消融治疗,力争达到NED状态,术后应根据基因检测结果补充辅助治疗并监测随访。
讨论总结:患者为转移性直肠癌,原发灶有出血、肠梗阻等症状,需行原发灶切除手术。结合肝脏外科意见,表浅转移瘤可以试行同期手术切除,其余转移瘤于术后行射频消融治疗。
3.2.1.2 手术治疗 患者于2021年4月27日于全麻下行腹部无辅助切口经肛门拖出标本的3D腹腔镜下高位直肠癌根治术(即NOSES-Ⅳ式)联合肝S3、S5、S8段转移瘤切除术。术中探查,肿瘤位于直肠上段腹膜返折以上,肝S3、S5、S8段转移瘤于肝表面可见。首先于腹腔镜下切除肝S3、S5、S8段转移瘤,置入标本袋内封存,暂留左上腹。随后行直肠癌根治术,术中高位清扫+低位结扎肠系膜下动脉,保留左结肠动脉,完成系膜裁剪及肠壁裸化后经肿瘤下方预切线处离断直肠,打开直肠残端,利用无菌保护套建立通道。助手经通道送入抵钉座,于肿瘤上方预切线处开口,置入抵钉座后离断肿瘤上方肠管,标本放入标本袋内封存。将肝转移瘤标本袋和直肠标本袋分别经肛门拖出,闭合直肠残端。经结肠远侧断端切开小口,显露抵钉座,闭合直肠残端,置入吻合器体部,完成端—端吻合(操作步骤同NOSES-Ⅳ式)。手术时间210 min,术中出血量50 mL,手术过程顺利(图8)。
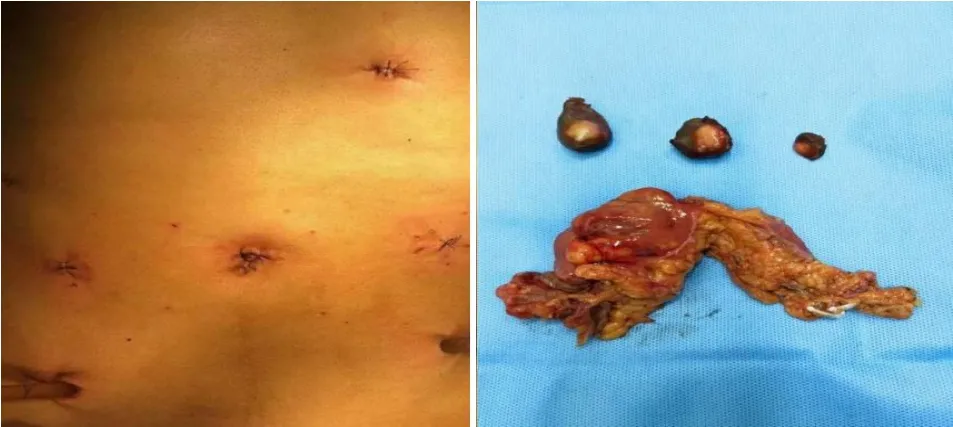
图8 术后患者腹壁及标本图片
患者术后恢复顺利,无明显疼痛感。术后第3天复查血常规提示白细胞、中性粒细胞、血红蛋白数值均在正常指标范围内。肿瘤标志物未复查。
3.2.2 第二次MDT讨论及治疗情况
3.2.2.1 第二次MDT讨论(2021年4月30日) 肝脏外科、结直肠外科:患者原发灶及三处浅表转移瘤已经同期切除,另有四处转移灶位置较深且体积较小,行手术治疗创伤较大,拟行超声引导下射频消融术。
肿瘤内科:患者基因检测结果为KRAS突变型,建议先行射频消融,如能达到NED状态,继续行辅助化疗。
讨论总结:针对剩余四处肝转移瘤行射频消融治疗,力争达到NED状态。根据病理结果和基因检测结果,行术后辅助化疗,靶向药物建议加用贝伐珠单抗,并监测随访。
3.2.2.2 治疗情况 患者于术后第8天行超声引导下射频消融术,灭活S4、S5、S6、S8段四处转移瘤,超声造影检查见病灶呈灭活状态,未见其他病灶,至此达到NED状态。复查肿瘤标志物:CEA 10.61 ng/mL,CA19-9 60.84 U/mL,标志物水平均较入院时明显下降。患者术后恢复良好,病理为pT3N1bM1a期,继续于我院行FOLFOX+贝伐珠单抗方案治疗6周期,后因个人原因回当地医院继续化疗,术后半年复查未见明显异常,目前规律随访中,术后1年复查待完善。
4 讨论
肝脏是结直肠癌最常见的远处转移器官[13]。对于CRLM,原发灶与肝转移瘤应该选择同期手术还是分期手术仍存在较大争议[14]。研究表明,与分期手术相比,同期手术治疗CRLM术中出血量更少,手术时间和住院时间更短[15-16]。近年来,腹腔镜技术在结直肠手术和肝脏手术中应用广泛,且在CRLM同期手术中具有创伤小、术后疼痛轻、恢复快等优势[17]。术前对患者的身体情况、原发灶及转移瘤等情况进行充分评估,制定有针对性、周全的手术计划,能够提高同期手术的安全性[18]。
本研究3例CRLM患者同期NOSES的成功施行,关键在于准确把握适应证,制定有针对性的手术计划:(1)选取合适的患者。本研究3例患者最大年龄为62岁,最小年龄为50岁,属于相对年轻的肿瘤患者。且3例患者均否认既往史、家族史,心肺查体无明显异常,ECOG评分和PS评分均为1分,一般状态尚可,能够耐受原发灶与肝转移瘤同期手术,术中出血量均维持在50 mL左右,术后并未出现如腹腔出血、腹腔感染、吻合口漏等常见并发症。未来,对于有基础疾病或高龄的CRLM患者能否施行同期NOSES,尚需要谨慎探索。(2)制定有针对性的手术计划。术前需通过肝胆脾增强MRI(或增强CT)对转移瘤的位置、大小、数目以及其与周围血管组织等的关系进行分析,并由肝脏外科、结直肠肿瘤外科医师共同商讨手术方案。对于浅表、孤立的转移瘤可以在保证切缘≥1 mm的前提下进行肿瘤切除术,尽可能避免破坏肿瘤紧邻的重要管道(血管、胆管等)[17]。如转移瘤体积较大,位于肝左叶且位置较深,可酌情考虑行肝左叶切除术(病例一),但应注意评估转移瘤数目和残余肝脏体积。若转移瘤位置较深或紧邻重要管道,手术创伤较大时不建议行转移瘤的R0切除,可考虑术后射频消融治疗,通过综合治疗达到NED状态。(3)合理选择取标本途径。《结直肠肿瘤经自然腔道取标本手术专家共识(2019版)》提出,施行NOSES的患者肿瘤浸润深度以T2~T3为宜,经肛门取标本以标本最大环周直径<5 cm为宜,经阴道取标本要求标本最大环周直径5~7 cm为宜[9]。根据肠系膜肥厚程度、自然腔道解剖结构等情况,灵活掌握手术适应证。病例一为女性右半结肠癌患者,标本系膜一般较为肥厚,若经直肠切口取出,难度较大,考虑经阴道后穹窿取标本,术前征得患者的同意,并对阴道进行充分的冲洗消毒。经阴道后穹窿取标本优势在于后穹窿便于在腹腔镜下寻找和暴露,具有良好的切口愈合能力。其余两例男性患者均为高位直肠癌,考虑经肛门取标本。其中,病例三的转移瘤和原发灶直径相对较小,顺利经肛门取标本。而病例二原发灶标本直径较大,术中见直肠肠管较细,标本经直肠和肛门拖出难度较大,且术中探查肝S7段转移瘤在腹腔镜下切除较为困难,遂行开腹肝转移瘤切除,经肝切口取出原发灶及转移瘤肿瘤标本。
笔者团队认为MDT模式下CRLM同期NOSES,既保证了诊疗的规范化,又比传统的腹腔镜手术更加微创,更契合加速康复外科理念。本研究3例患者术后均早期排气,早期离床活动,能够尽早地恢复流质饮食。2例经自然腔道取标本的患者术后均无明显疼痛感。患者术后的快速康复,有助于术后尽早开始后续的射频消融治疗和辅助治疗,更好地控制病情进展。但MDT模式下CRLM同期NOSES并非适用于所有CRLM患者,需要严格遵循以下注意事项:(1)MDT的实施须符合现行指南与共识的要求,并且尊重患者的意愿。CRLM患者的初诊应经过全面检查后由多学科团队进行评估,应充分评估原发灶有无症状,转移瘤是否可切除,CRS评分等信息,并与患者及其家属充分沟通病情及治疗方案,获得患者及其家属的知情同意。(2)灵活选择治疗方式,力争达到R0切除或NED状态。根据患者病情变化及时进行MDT讨论,制定针对性的诊疗方案。病例一患者肝转移瘤虽初始可切除但CRS评分高,因此先给予新辅助治疗。但化疗过程中出现明显腹痛、便血和肠梗阻症状,经再次MDT讨论后认为需行原发灶手术治疗。复查影像学资料提示肝脏无新发转移瘤,结合肝脏外科意见后遂决定进行同期手术。病例二患者的转化治疗较为成功,但S5段转移瘤位置较深,紧邻重要管道,经MDT讨论后行同期手术切除其余转移瘤联合术后射频消融能够减少损伤,达到NED状态。病例三患者因原发灶出血、肠梗阻症状入院,行原发灶、浅表转移瘤同期切除,深部转移瘤术后经射频消融达到NED状态。但这3例患者的CRS评分均较高,应充分警惕术后肿瘤复发。(3)术后应根据病理结果、基因检测情况和已完成治疗的次数来补充辅助治疗,并对患者进行密切监测和随访。对于术前行新辅助治疗的患者,术后可根据术前的治疗情况补充辅助治疗至完整的6个月。若术前新辅助治疗的方案有效,可继续沿用。病例二患者和病例三患者并未于我院完成全疗程辅助治疗,需警惕术后复发,密切随访。
综上所述,在充分把握适应证的前提下,对特定的CRLM患者行同期NOSES有助于实现R0切除或达到NED状态。然而,CRLM同期手术对手术团队的技术经验和综合实力要求较高,NOSES的开展也要求手术团队熟练掌握腹腔镜操作。因此,建议外科诊疗团队在临床工作中谨慎探索。最后,期待更多相关报道及研究成果问世,为开展此类手术提供更多的循证医学证据。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。

