腹腔镜下腹壁侵袭性纤维瘤切除一期腹壁重建的病例报告
钟家健,马东恒,陈斯聪*,赵永灵
1 病例资料
患者为31岁女性,G5P2,既往2014年、2016年、2021 年5 月共3 次人工流产史。因“发现左腹部肿物6 天”于2021 年12 月20 日入院。患者于入院前6 天无意中发现左腹部肿物,约呈鹅蛋大小,质硬,无疼痛及压痛,无其他不适,肿物至发现起无明显增大。专科查体:左下腹可扪及肿物,大小约5 cm×5 cm×4 cm,肿物无压痛,质地硬,边界尚清,活动度差。
辅助检查:全腹CT 平扫+增强:左下腹内斜肌内肿块,多考虑富含纤维的偏良性肿块,孤立性纤维瘤亦需考虑(图1)。
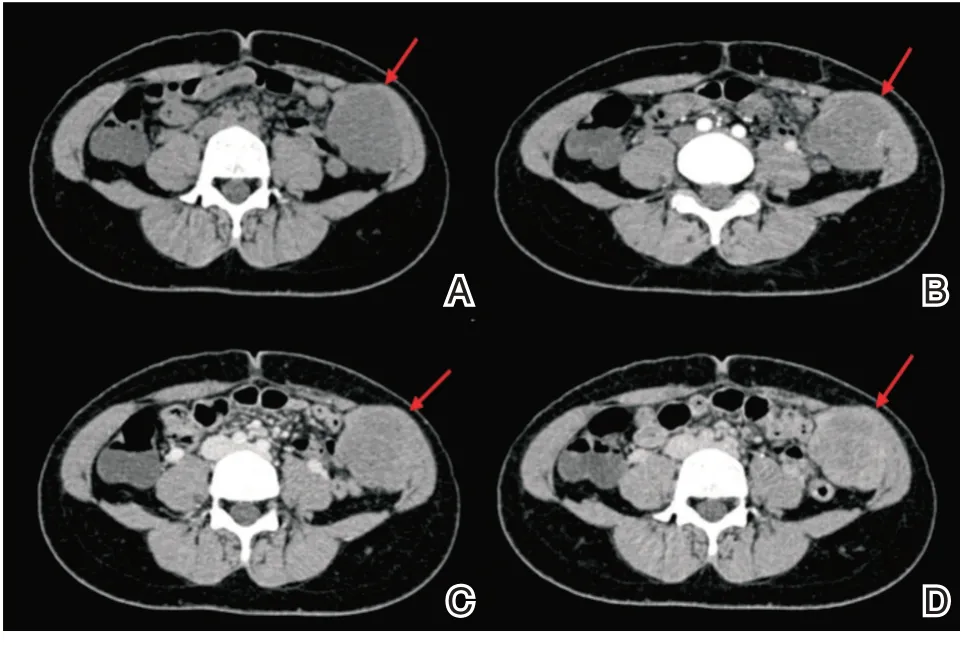
图1 CT 扫描 A:平扫发现左下腹内斜肌内类圆形稍低密度影,边界欠清晰,大小53 mm×44 mm×56 mm,CT 值约32HU;B~D:分别为动脉期、门脉期及静脉期,可见病灶呈渐进性延迟强化,强化欠均匀,病灶突向腹腔,周围肌肉组织无明显受侵
手术方法:于2021 年12 月23 日在全麻下行腹腔镜下腹壁肿瘤切除+腹壁补片修补术。全麻后,于脐上1 cm 切口置入10 mm Trocar 入镜探查,直视下于麦氏点及耻骨联合上方分别置入10 mm 及5 mm Trocar,麦氏点Trocar 为观察孔,术中见左下腹腹壁可见一约6 cm×6 cm 肿物,向腹腔突出,边界清楚(图2),网膜及腹壁未见转移结节,电钩打开腹膜,见肿瘤与腹壁肌肉关系密切,超声刀沿肿瘤边界,将肿瘤完整切除后装入标本袋内。做左下腹斜形切口,长约4 cm,将标本取出后送快速冰冻病理检查,提示梭形细胞肿瘤。消毒术野,游离腹膜,连续缝合关腹,置入美国柯惠聚丙烯和聚乳酸复合自固定补片PP1509G 型号1 张并铺平,连续缝合肌肉层,间断缝合切口。左侧腹股沟处腹带加压包扎固定。术中出血10 mL,手术时间2 h,术后予抗感染、腹带加压治疗,于术后第4 d 出院。术后病理提示:CD117(-)、Dog-1(-)、CD34(-)、S-100(-)、Desmin(-),SMA 局灶(+),Ki67<1%(+),梭形细胞肿瘤,结合免疫组化结果,病变考虑为侵袭性纤维瘤(图3)。
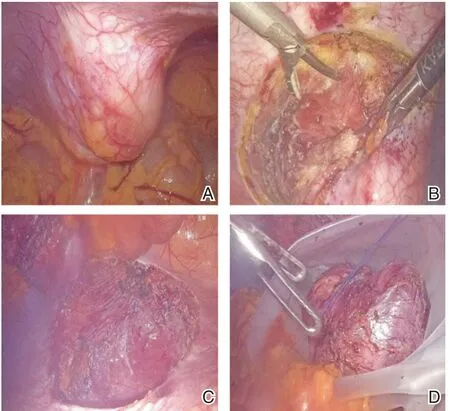
图2 腹腔镜手术截图 A:腔镜下可见一腹壁肿瘤向腹腔内凸出,包膜完整,未向远处侵犯;B:可见肿瘤与腹内斜肌关系密切,未侵犯腹外斜肌;C:完整切除肿瘤后可见缺损的腹壁,无明显渗血;D:将肿瘤装入标本袋
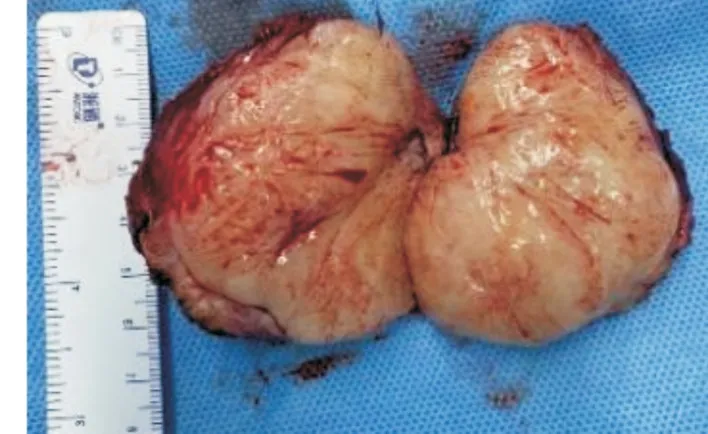
图3 肿物大体标本 肉眼可见肿物有完整包膜,大小约7 cm×5 cm×5 cm,实性,质地中,将肿物纵行切开后见肿物切面隆起,色灰黄,呈均质鱼肉状,边界清,未见编织状条纹,内未见坏死
2 讨 论
腹壁侵袭性纤维瘤(aggressive fibromatosis,AF)又称硬性纤维瘤、韧带瘤、纤维组织瘤增生、腱膜纤维瘤或软组织韧带纤维瘤等[1]。AF 最先于1832 年由MacFarlane 发现并提出,根据发生部位分为腹内型、腹外型和腹壁型[2],好发于育龄期女性,全球发病率在0.0005%左右,生物学特点介于良恶性之间,是一种罕见的低度恶性软组织肿瘤[3]。AF 发病机制尚不明确,可能与β-蛋白或APC 基因的突变有关,家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)、高雌激素水平、腹部外伤史及手术史等是其发病的高危因素[4,5]。AF 常用的诊断方法有B 超、CT、MRI、FNAC 等,其中,MRI 的诊断价值最高,术后病理仍是诊断该病的金标准[6]。
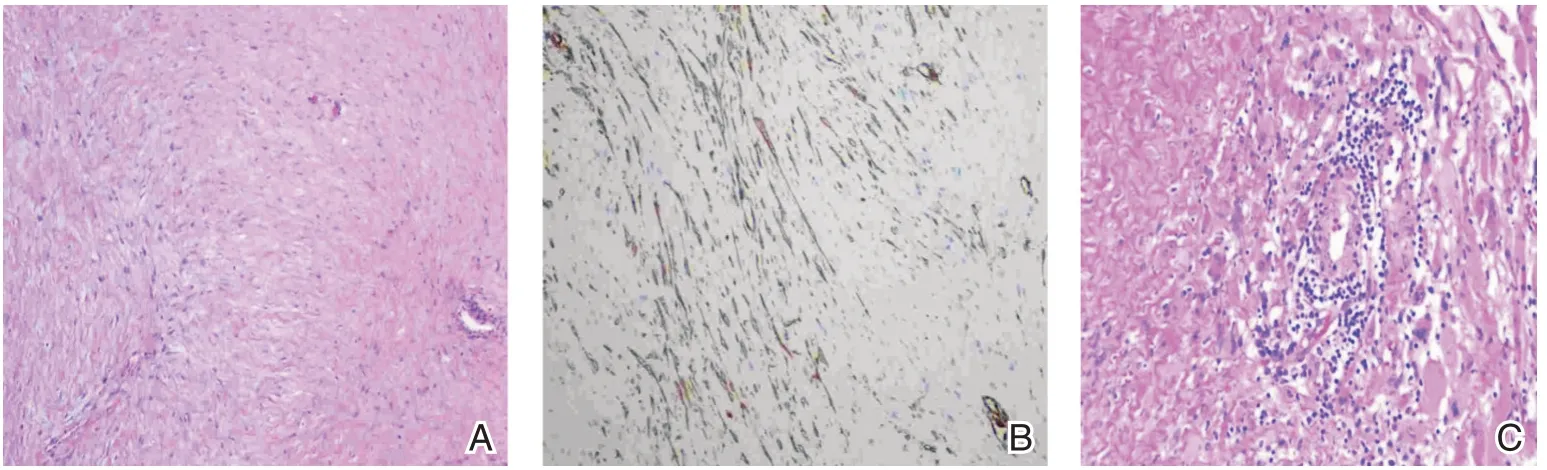
图4 术后石蜡病理 A~C:HE 染色及SMA 染色,免疫组化一抗用福州迈新公司产品、二抗用Roche 公司产品并用Roche 自动免疫组化染色仪染色,结果:CD117、CD34 均为阴性,排除胃肠道间质瘤;S-100 阴性,排除神经源性肿瘤;Desmin 阴性,SMA 大部分区域阴性,局灶阳性,Ki67<1%阳性,考虑为侵袭性纤维瘤
目前AF 没有标准的治疗方法,治疗主要包括手术、放疗、化疗、靶向治疗及激素治疗[7]。手术是目前AF 的主要治疗方式,主张肿瘤R0 切除即保证切缘阴性>3 cm,以期降低AF 的复发风险,但也有相关研究报道完整切除肿瘤与R0 切除的复发风险差异无统计学意义[8]。切除后若无明显感染征象,尽量行一期无张力疝修补术一期重建缺损腹壁,术后注意抗感染及腹带加压治疗[9]。术式可分为传统开放手术和腹腔镜下切除,目前术式以开放手术为标准,而腔镜下切除联合腹壁补片一期重建是一种新术式,其安全可行,尤其适用于腹壁型及腹内型AF[10]。近来有部分研究指出,较于传统开放手术,腹腔镜下切除可以降低AF合并FAP 的患者的复发风险[11],并且能够提供更广的手术视野,更易完整切除肿瘤或达到R0 切除,对腹壁的损伤更小,术后恢复快,切口更加美观[12]。
放疗的治疗效果和复发风险与手术相当,但副反应更为明显,常用于手术无法保证切缘阴性或不能完整切除肿瘤的情况。手术联合放疗相较于单一手段,无法降低AF 的复发风险,目前不推荐两种手段联合治疗[13]。激素治疗主要包括他莫昔芬或托瑞米芬,常与非甾体类抗炎药联合使用,因其副反应低,常作为一线药物治疗[14]。化疗方案包括甲氨蝶呤加长春新碱、长春瑞滨及蒽环类药物,可用于激素治疗失败或肿瘤生长速度快甚至危及生命的患者,但毒性反应大,常用作AF 的二线或三线药物治疗[14]。靶向治疗主要为酪氨酸激酶抑制剂(TKIs)包括伊马替尼、索拉非尼、帕唑帕尼[15]。近期发现口服索拉非尼400 mg qd治疗,能够显著延长无进展生存期,毒副反应相对较小且确切,可及时对症处理,是治疗AF的另一潜在选择[16]。
总结:本例患者为育龄期女性,无剖宫产史及其他手术史,住院期间行肠镜检查发现一孤立宽基底息肉,已行内镜下切除,由于该患者为腹壁型AF,肿瘤生长于腹内斜肌并向腹腔内膨出,质地韧实,故决定手术方式选择腹腔镜下AF 切除联合补片一期腹壁重建,术中对于肿瘤的抓取有一定的难度,对术者要求较高,但相较于传统开放切口,能够扩大肿瘤的切除范围的同时,切口范围更小,保留了腹外斜肌,对腹壁损伤更小,术后恢复快且美容效果好。由于本例接诊时对该疾病认识尚浅,术中未送切缘行快速冰冻病理,后续将在治疗后随访并间隔3~6 个月行CT 或MRI 监测进展及复发情况。

