低温胁迫下甘蓝型冬油菜BnYUCCA8基因差异表达及内源生长素含量变化
呼芳娣,刘丽君,马 骊,牛早霞,孙柏林,徐 佳,杨雯昕,刘 博,蒲媛媛,武军艳,方 彦,李学才,沈金雄,孙万仓
(1.甘肃农业大学农学院,甘肃省油菜工程技术研究中心,省部共建干旱生境作物学国家重点实验室(甘肃农业大学),甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.华中农业大学作物遗传改良国家重点实验室/国家油菜工程技术研究中心,湖北 武汉 430070)
低温是影响植物生长发育的主要环境因子,对植物的生长发育及地理分布起决定性作用[1]。甘蓝型冬油菜是我国重要的油料作物,与白菜型冬油菜相比,具有产量好、品质优的特性,但由于其抗寒性较弱,严重影响了甘蓝型冬油菜在我国北方地区的种植[2]。
下胚轴是连接两个子叶和初生根(胚根)的幼茎[3]。植物下胚轴的伸长是植物对环境胁迫的重要适应机制[4],其伸长的程度主要受温度、光照等环境因子和内源激素的双重调控[5-6]。甘蓝型冬油菜下胚轴长度与其抗寒性强弱密切相关,下胚轴越短,其抗寒性越强。相关研究表明,抗寒性强的品种将有机物运输至地下部,给予越冬期植物抵御低温的能量保障,而抗寒性弱的品种将光合产物运输至地上部,易造成地上部的徒长,导致下胚轴伸长,降低其抗寒能力[7]。金姣姣[8]通过对不同抗寒性甘蓝型冬油菜品种的下胚轴长度观察发现,在甘蓝型冬油菜的幼苗时期,抗寒性不同品种的下胚轴伸长长度不同,强抗寒品种下胚轴伸长较短,弱抗寒品种伸长较长。
生长素是植物发育的主要调节因子,参与协调植物生长的几乎所有方面[9]。低温胁迫下,植物体内激素水平会发生变化进而调控生理代谢活动,激活抗寒基因表达[10],增强植物抗寒性[11]。色氨酸转氨酶(TAA)/YUCCA(YUC)途径是生长素生物合成的主要途径[12],YUCCA家族基因编码的含黄素单加氧酶是该生物合成途径的限速酶,能够催化以色氨酸为前体的IPA转化为IAA[13]。拟南芥蓝光受体ZTL正向调节地上部分生长素合成的IPA途径中YUCCA8基因的表达,从而促进下胚轴伸长。相对于野生型,拟南芥ztl突变体下胚轴较短,YUCCA8表达水平降低[14],表明YUCCA8基因在调控拟南芥下胚轴长短方面发挥重要作用。高温诱导下,拟南芥生长素生物合成基因YUCCA8被光信号途径关键转录因子PIF4激活从而调节高温引起的下胚轴伸长[15]。且yuc8突变可以在很大程度上抑制 PIF4 过表达植物的长下胚轴的表型,也可以减少高温诱导下下胚轴伸长[16]。虽然YUCCA8基因在生长素及下胚轴调控方面研究较多,但主要集中于高温诱导下, 且YUCCA8通过调控下胚轴伸长适应低温胁迫方面的研究鲜有报道。
蒲媛媛[2]将甘蓝型油菜‘16VHNTS158’种植于兰州上川(36°03′N、海拔2150 m),地膜覆盖以后发现其越冬率为10.6%,‘16VHNPZ269’为11.7%,‘天油 2288’为0%,其半致死温度和春化率见表1,由表1可知‘16VHNTS158’和‘天油 2288’抗寒性具有差异。本文从甘蓝型冬油菜中克隆获得BnYUCCA8基因,对其进行了生物信息学分析,并分析了其在不同组织及低温胁迫下表达量的变化。检测了低温胁迫下根和叶中内源 IAA 含量的变化。对表达量、内源 IAA 含量和下胚轴长度进行了相关性分析,以期为探究甘蓝型冬油菜抗寒性与下胚轴长度之间的分子机制提供理论依据。
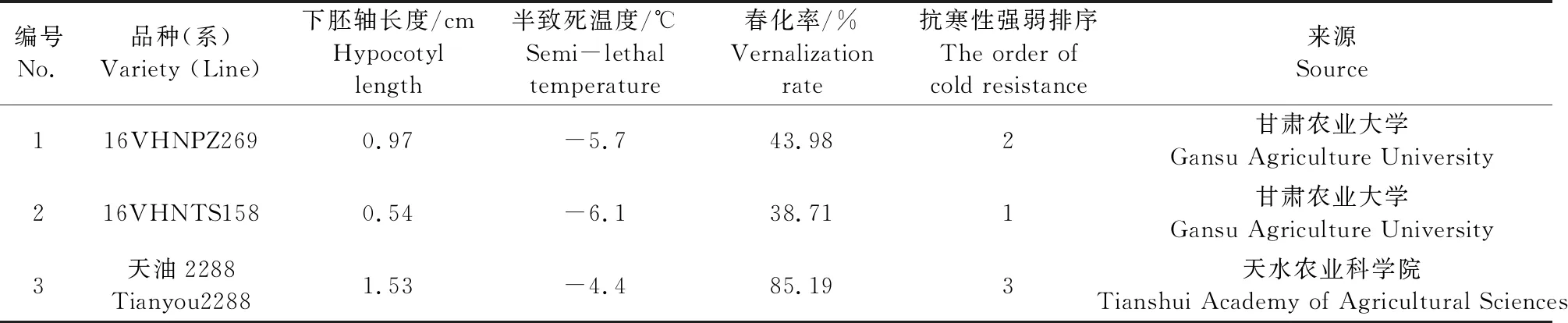
表1 试验材料抗寒特性及来源
1 材料和方法
1.1 材料
于2020年9月17日,将甘蓝型油菜品系‘16VHNTS158’、‘16VHNPZ269’和‘天油 2288’播种于甘肃农业大学百草园试验基地,待长至五叶期,即同年11月12日,选取各材料中完整性好的单株,取第5片真叶,3个生物学重复,于-80℃冰箱备用,用于基因克隆。待其越冬抽薹后,即2021年4月23日,取成熟根、茎、叶、下胚轴、花、花蕾、角果于-80℃冰箱备用,每个组织部位3个生物学重复,用于组织表达分析。2021年3月11日,将‘16VHNTS158’和‘天油2288’进行盆栽,待油菜长至5~6叶期时,各取3盆取其植株的根、茎、叶、下胚轴,液氮冷冻后放入-80℃冰箱备用,用于组织表达分析,将剩余盆栽材料全部置于22℃培养箱处理48 h后,分别放置于常温(22℃)、4℃、0℃、-4℃培养箱,每隔0、3、6、24 h取样,各处理条件下分别取叶和根的3个生物学重复,用于低温胁迫下荧光定量PCR及内源IAA含量的测定。
1.2 RNA提取及反转录
根据北京天根生物公司RNAprep Pure Plant Kit 植物总RNA提取试剂盒提取试验材料各组织总RNA,琼脂糖凝胶电泳检测RNA条带,按PrimeScript RTrea-gent Kit with gDNA Eraser 反转录试剂盒(大连TaKaRa公司)进行反转录,得到单链cDNA,置于-20℃冰箱保存备用。
1.3 YUCCA8基因的克隆
根据NCBI甘蓝型油菜数据库中所预测的YUCCA8(ID:106359824)基因序列,利用Primer Premier 5.0软件设计基因克隆引物,YUCCA8-F:5′-ATGGAGAGTATGTTTCGTTTGATG-3′,YUCCA8-R:5′-TTAGAATTGTTGGGAGATACATCTTCTAT-3′;以叶片cDNA为模板进行PCR扩增,扩增程序为:94℃预变性5 min;94℃变性30 s,53.6℃退火30 s,72℃延伸60 s,循环35次;72℃终延伸10 min;4℃保存。产物经1%琼脂糖凝胶电泳,采用北京天根的胶回收试剂盒进行纯化回收,回收产物与pMD19-T载体连接,转化大肠杆菌Trans1-T1感受态细胞,结合蓝白斑筛选和菌落PCR鉴定结果,挑选出阳性单菌落送上海生工生物工程公司测序。
1.4 YUCCA8基因的生物信息学分析
利用DNAMAN软件进行克隆基因的多重序列比对和氨基酸同源性分析;Expasy在线分析蛋白质的理化性质;SignalP-5.0 Server预测蛋白信号肽;SOPMA在线预测蛋白的二级结构;SWISS-MODEL在线预测蛋白三级结构;MEGA7.0软件分析系统进化;TMHMM Server v.2.0在线预测跨膜结构;Wolf-psort在线预测亚细胞定位;NCBI在线工具Conserved Domain Search Service进行保守结构域预测分析。
1.5 实时荧光定量PCR
实时荧光定量PCR(RT-qPCR)反应体系为20 μL:SYBR Premix Ex Taq TM Ⅱ 10 μL、正向引物/反向引物各0.8 μL、cDNA 2.0 μL、ddH2O 6.4 μL。内参基因为Actin[17]。采用2-ΔΔCT对基因的相对表达量进行计算,并用Duncan法进行差异显著性分析。
1.6 IAA提取及含量测定
使用美国Waters Arc型高效液相色谱仪进行测定。色谱条件为:色谱柱:Symmetry C18色谱柱(4.6×250 mm、5 μm);流动相:甲醇+0.1%磷酸(百分数为体积比);流速:1.0 mL·min-1;进样量:10 μL;检测波长:254 nm;柱温:30℃。
激素提取方法:参照赵杨静等[18]的方法,略有改良。取油菜根部0.1 g,放入研钵,液氮中研磨成粉末加入6 ml提取液A(正丙醇∶水∶HCl=2∶1∶0.002,体积比)。4℃摇床100 r·min-1震动30 min,加入3 mL提取液B(二氯甲烷),4℃摇床100 r·min-1震动30 min;取出后4℃ 13 000 r·min-1离心5 min,此时溶液分层,用巴氏滴管吸取有机层溶液,氮气吹干,加入50%甲醇水溶液1 ml;过0.22 μm有机针孔滤膜,装入样品瓶中置于4℃冰箱待测。
2 结果分析
2.1 BnYUCCA8基因的cDNA克隆
采用同源克隆技术,以甘蓝型冬油菜cDNA为模板,利用扩增特异性引物,对目的基因进行PCR扩增,得到与预期大小相符的条带(图1),将目的片段纯化回收,回收产物连接转化后测序,得到全长片段为1281bp的CDS序列,与预期结果相吻合。命名为BnYUCCA8。
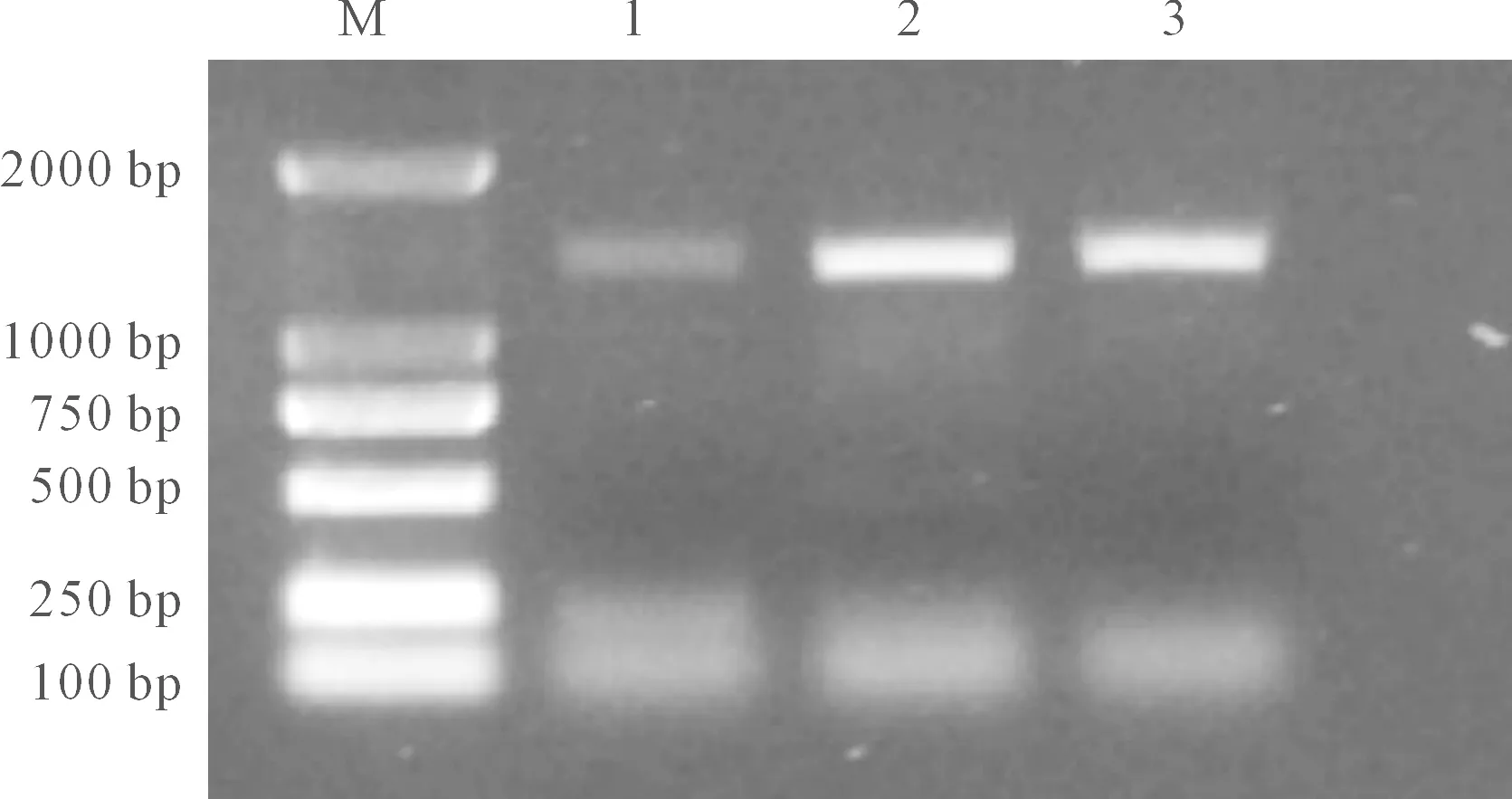
M: DNA marker;1: ‘16VHNTS158’;2: ‘16VHNPZ269’;3: ‘天油 2288’ ‘Tianyou 2288’
2.2 BnYUCCA8基因生物信息学分析
对从‘16VHNPZ269’中克隆得到的BnYUCCA8基因序列进行生物信息学分析表明,基因的起始密码子ATG,终止密码子TAA,编码含426aa的蛋白质(图2),相对分子质量约47.78 kD,理论等电点为9.02。基因由20种氨基酸组成,其中Val、Leu、Gly 3种氨基酸所占比例最高,分别为9.1%、8.7%、7.5%,负电荷残基总数(Asp+Glu)为47,正电荷残基总数(Arg+Lys)为57;分子式为C2134H3379N585O615S22,总亲水性平均系数为-0.237,蛋白质不稳定指数为49.54,是一个不稳定的疏水性蛋白(图3A),属于CzcO超家族(图3D)。跨膜结构预测结构表明BnYUCCA8蛋白存在一个跨膜结构(图3F),亚细胞定位预测主要位于细胞质和内质网上,不含信号肽,推测其为非分泌蛋白(图3E)。
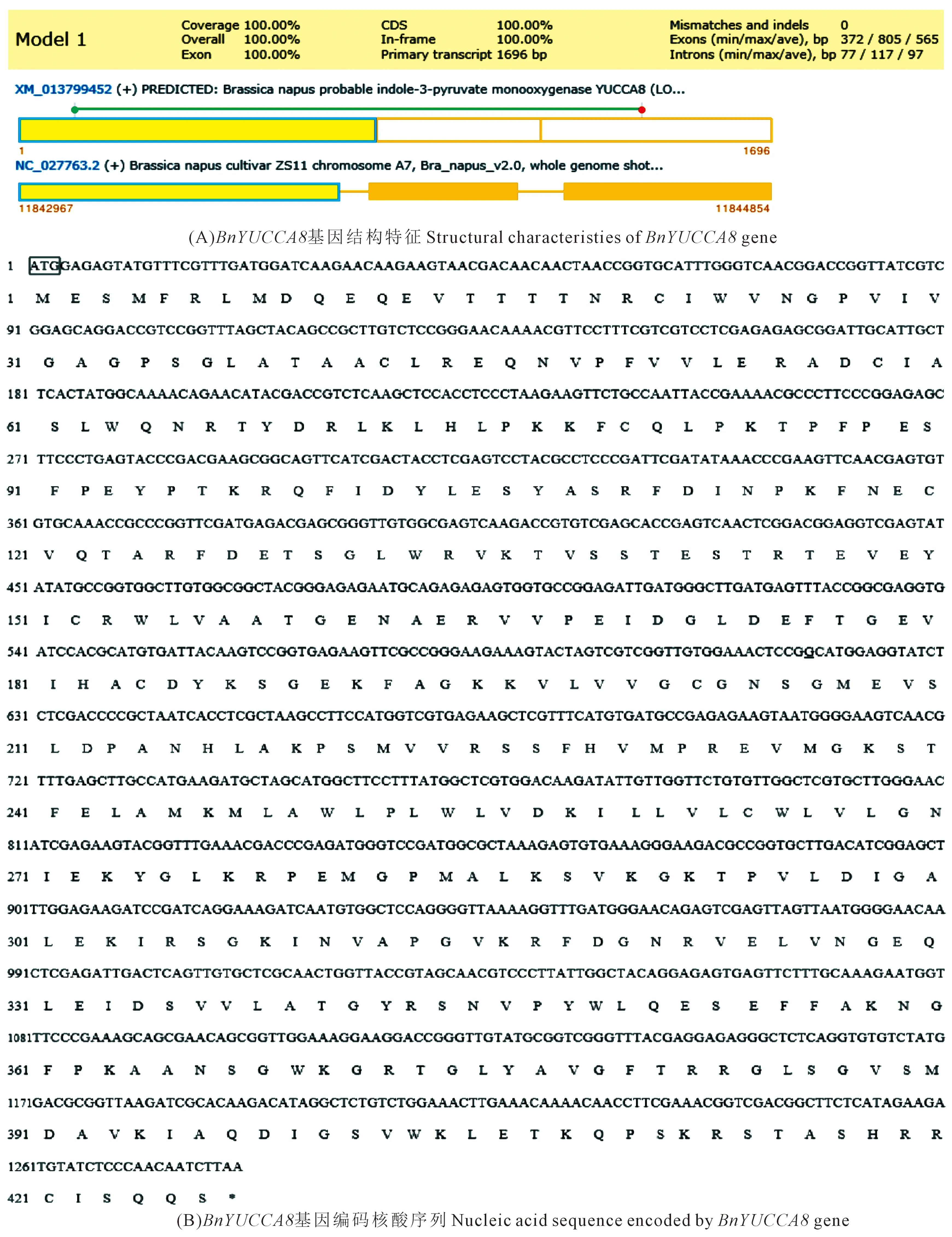
注:(A) 图中黄色方框为内含子区域。(B) 图中上游起始密码子ATG用方框表示;*为终止密码子TAA的位置。
YUCCA8蛋白质二级结构显示,无规则卷曲(Randomcoil)含量最丰富,为41.45%,其次是33.02%的α-螺旋(α-Helix),延伸链(Extended strand)和β-转角(β-turn)含量最少,分别为17.56%和7.96%(图3C)。以6sek.1为模板,对BnYUCCA8基因编码蛋白的三级结构进行模型构建,模型序列一致性达到23.28%(图3B)。
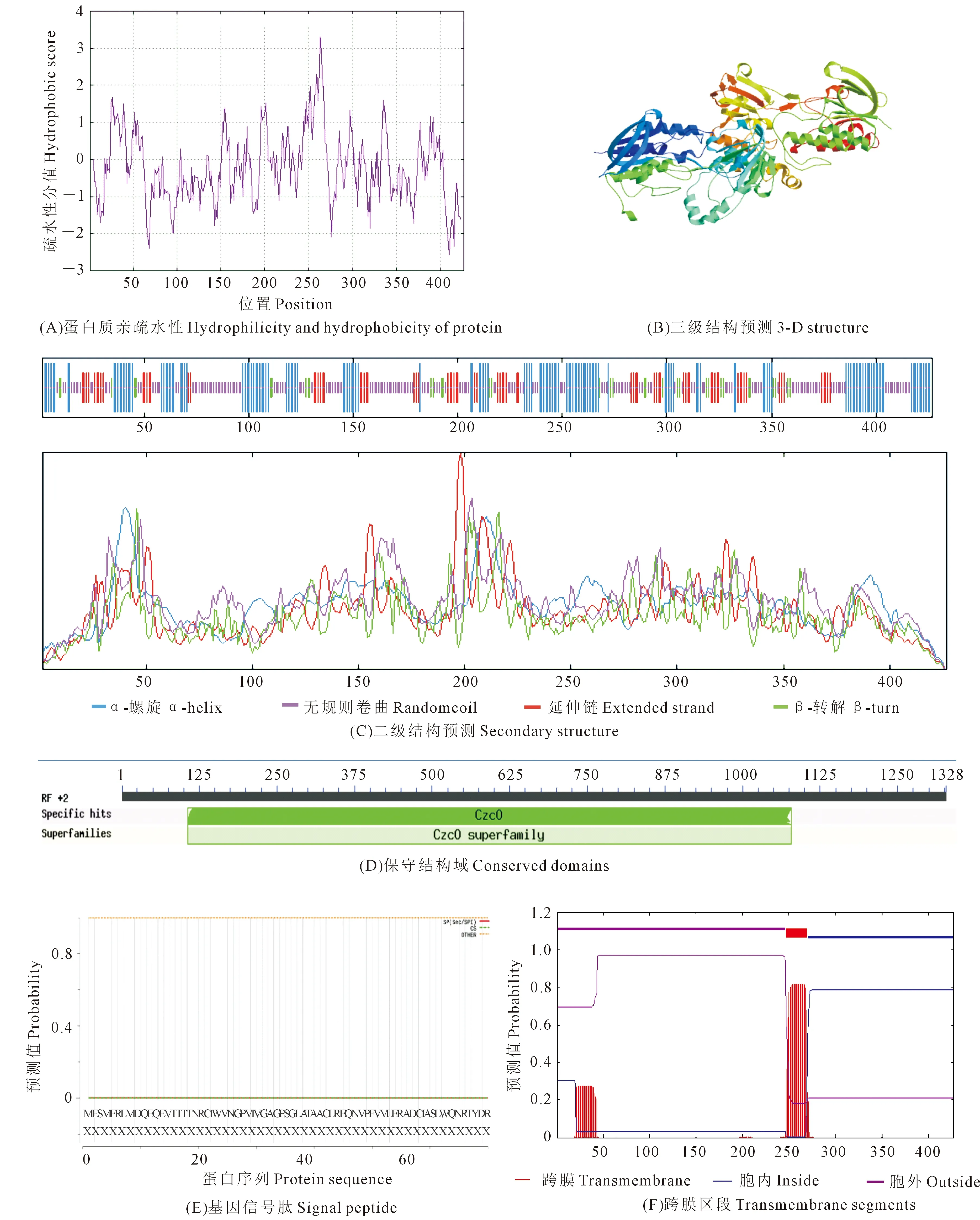
图3 甘蓝型冬油菜‘16VHNNPZ269’ BnYUCCA8蛋白质特性分析
甘蓝型冬油菜‘16VHNPZ269’中BnYUCCA8基因对应的氨基酸序列与甘蓝型油菜数据库中YUCCA8基因对应的氨基酸序列相似性为98.13%、与拟南芥AtYUCCA8基因对应的氨基酸序列相似度为88.11%、与‘16VHNTS158’和‘天油2288’对应序列相似性分别为98.59%和89.72%,‘16VHNTS158’与‘天油2288’对应序列相似性为89.72%(图4)。

图4 不同材料氨基酸序列多重比对
2.3 BnYUCCA8的序列进化分析
利用MEGA 7.0软件将克隆获得的甘蓝型油菜YUCCA8蛋白的氨基酸序列与从NCBI下载的11种植物的YUCCA8蛋白序列构建系统进化树(图5),结果表明,甘蓝型油菜该蛋白与荠菜同源性最高,其次为拟南芥,与白芥和荠蓝的亲缘关系最远。
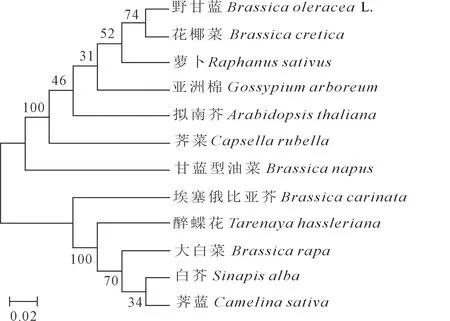
图5 不同植物YUCCA8蛋白的进化树分析
2.4 甘蓝型冬油菜BnYUCCA8基因的组织部位表达分析
组织表达分析结果显示(图6),BnYUCCA8基因在所有组织部位均有表达,且其表达量表现出组织部位差异和生长时期差异。BnYUCCA8基因在下胚轴伸长较短的‘16VHNTS158’的苗期阶段(图6A),叶和根中表达量最高,茎和下胚轴中表达量次之;花期阶段,根和叶中表达量最高,其次为茎、下胚轴、花蕾,花和角果中表达量相对较低。下胚轴伸长较长的‘天油 2288’与下胚轴伸长较短的‘16VHNTS158’具有相同的表达模式(图6B),即在苗期和花期两个时期都表现出根和叶中的表达量高,其次依次为茎、下胚轴、花蕾、花、角果。
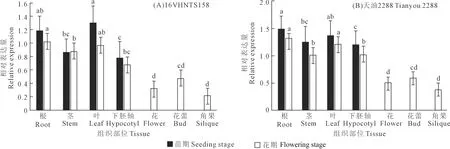
注:不同字母表示BnYUCCA8基因相对表达量分别在苗期和花期的不同组织部位间差异显著(P<0.05)
两个材料同一组织部位比较结果显示,除花期茎中‘16VHNTS158’基因表达量高于‘天油 2288’,其他组织部位基因表达量皆为下胚轴较长的‘天油 2288’高于下胚轴较短的‘16VHNTS158’。在油菜苗期和花期的生育进程中,BnYUCCA8基因表达量表现为苗期高于花期。
2.5 低温胁迫下BnYUCCA8基因在根和叶中的表达量变化
低温胁迫下BnYUCCA8基因表达量分析结果见图7,由图7A可得,在‘16VHNTS158’的根中,随着温度降低,BnYUCCA8基因表达量总体呈降低趋势,0℃较4℃时基因表达量略有升高,且随着低温胁迫处理时间的延长其基因表达量降低,低温胁迫处理24 h时基因表达量在不同温度梯度处理下的变化幅度较常温(22℃)更为明显,在4℃、0℃、-4℃的降幅分别为43%、17%、87%,且由图7C可得,‘天油2288’根中,4℃、0℃、-4℃的降幅分别为45%、20%、54%。相同处理温度及时间下,‘天油2288’的基因表达量高于‘16VHNTS158’。
对叶中BnYUCCA8基因表达量分析表明,在相同处理时间下,随温度降低其基因表达量变化模式与根中一致,处理时间越长,低温胁迫下表达量变化趋势越大,表达量越低。由图7B可得,处理24 h时,‘16VHNTS158’叶中,4℃、0℃、-4℃下的表达量较常温(22℃)分别降低了29%、28%、73%,由图7D可得,‘天油2288’分别降低了43%、28%、64%。相同处理温度及时间下,‘天油2288’较‘16VHNTS158’BnYUCCA8基因表达量高,由此表明BnYUCCA8基因可能通过调控下胚轴伸长进而参与甘蓝型冬油菜抗寒性的调控。
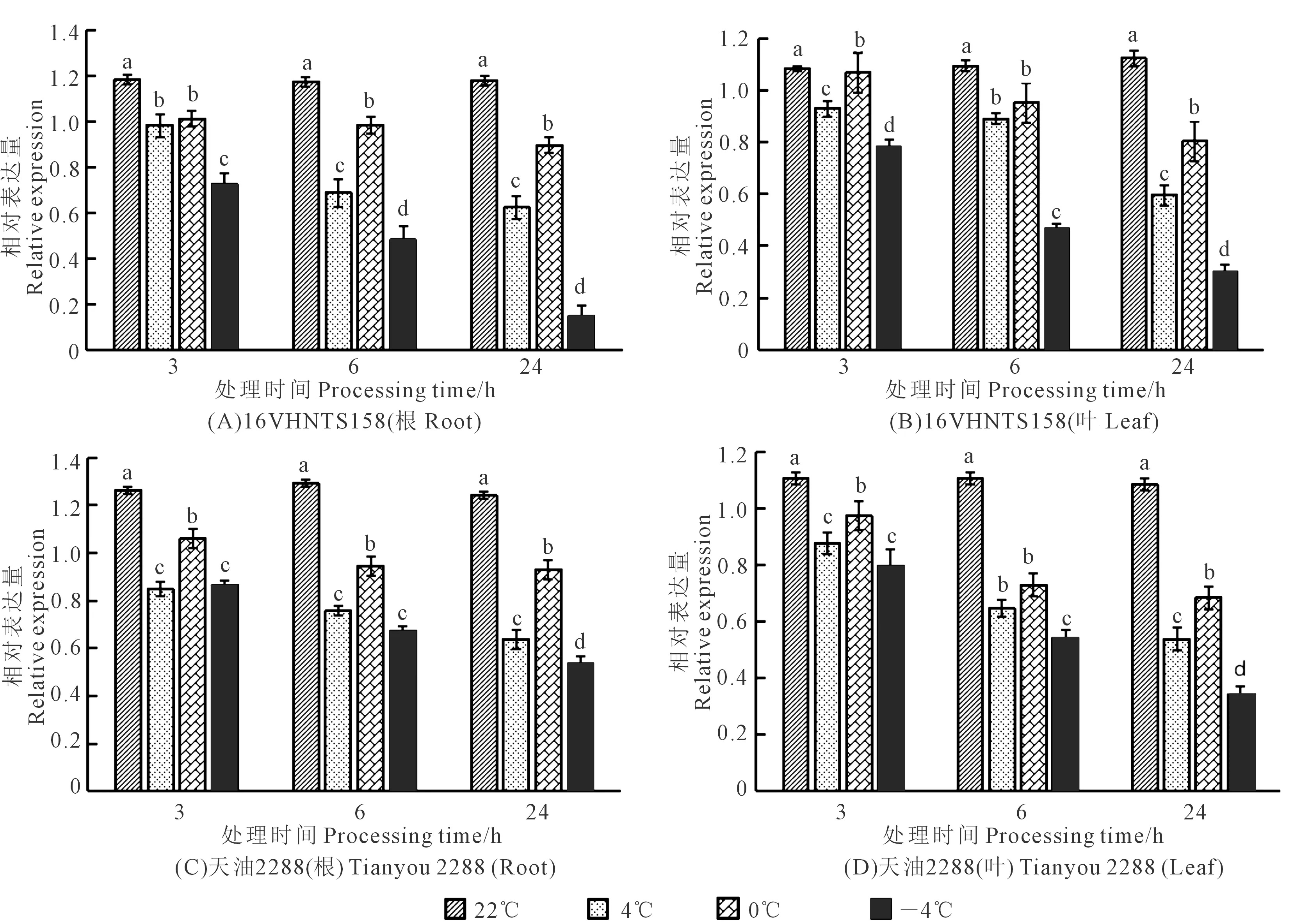
注:不同小写字母表示BnYUCCA8基因相对表达量在相同处理时间不同温度间差异显著(P<0.05)。
2.6 低温胁迫对甘蓝型冬油菜内源IAA含量的影响
内源IAA含量的测定结果表明(图8),随着温度降低,内源IAA含量降低。在处理24 h时,相比于对照(22℃),‘16VHNTS158’中IAA含量在4℃、0℃、-4℃时分别降低了68%、92%、97%(图8A)。‘天油2288’中分别降低了77%、89%、94%(图8B)。相同处理时间及温度下‘16VHNTS158’内源IAA含量较‘天油2288’低,其中在处理24 h时,‘16VHNTS158’较‘天油2288’IAA含量在常温(22℃)、4℃、0℃、-4℃分别低19%、14%、40%、39%。
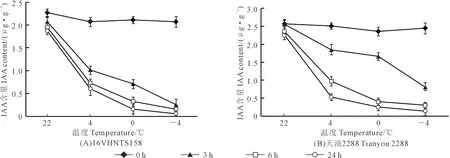
图8 甘蓝型冬油菜根中内源IAA含量对低温的响应
2.7 甘蓝型冬油菜BnYUCCA8基因表达量、生长素含量与下胚轴长度之间的相关关系
由表2可知,下胚轴伸长较短的强抗寒性品种‘16VHNTS158’中BnYUCCA8基因相对表达量和生长素含量之间存在显著正相关关系,相关系数为0.682,下胚轴长度与BnYUCCA8基因相对表达量、生长素含量之间存在正相关关系,相关系数分别为0.540和0.427;下胚轴伸长较长的弱抗寒性品种‘天油 2288’中BnYUCCA8基因相对表达量和生长素含量之间存在极显著正相关关系,相关系数为0.812,下胚轴长度与BnYUCCA8基因相对表达量、生长素含量之间存在正相关关系,相关系数分别为0.410和0.591。

表2 甘蓝型冬油菜BnYUCCA8基因表达量、生长素含量与下胚轴长度的Pearson相关
3 讨 论
YUCCA是植物IAA合成过程中的限速酶,其生物学功能在多种植物中得到了广泛挖掘[19-20],YUCCA8基因属于YUCCA家族成员,目前,在甘蓝型冬油菜中未见有YUCCA8基因相关研究报道。本文克隆的YUCCA8基因CDS序列为1 281 bp,编码426个氨基酸,利用生物信息学分析其是一个不稳定的疏水性蛋白,不同物种间具有高度保守性,袁美同等[21]通过对梨YUCCA基因家族鉴定得出PbYUCCA8蛋白编码423个氨基酸,不稳定指数为48.17,总亲水性平均系数为-0.167,也是一个不稳定的疏水性蛋白。
甘蓝型冬油菜BnYUCCA8基因时空表达特征分析结果表明,其在叶和根中表达量最高,茎和下胚轴中次之,花、花蕾和角果中表达量相对较低。拟南芥中YUCCA8转录水平在幼叶中最高,在成熟的叶、根和花芽中较低,茎中几乎检测不到[22],与本文在茎中的表达量不同可能与物种间差异有关。YUCCA8过表达的拟南芥下胚轴较长[23],而yuc8突变可以抑制光信号途径的关键转录因子 PIF4过表达,从而抑制其下胚轴伸长[16],本文研究发现,YUCCA8基因的表达量在‘天油2288’(下胚轴伸长较长)较‘16VHNTS158’(下胚轴伸长较短)中低,表明YUCCA8基因在调控下胚轴长短的过程中发挥重要作用。
目前,YUCCA8基因响应温度的研究主要集中于高温诱导下YUCCA8调控下胚轴长短[15],而对低温条件下YUCCA8与生长素及下胚轴的相关关系研究甚少,因此,本文通过对甘蓝型冬油菜进行低温胁迫处理,测定BnYUCCA8基因的表达量变化,结果表明随着温度降低,BnYUCCA8基因表达量整体呈降低趋势,在0℃较4℃时表达量略有升高,与内源IAA对低温胁迫的适应趋势基本一致。表明BnYUCCA8基因可能通过生长素的调控机制参与了对油菜低温胁迫的响应。
低温胁迫通常会引起植物体内激素水平发生变化,从而对植物生理代谢活动作出调节反应[10]。本文通过对低温胁迫下内源IAA含量测定发现,随着温度降低,2个抗寒性不同的甘蓝型冬油菜内源IAA含量不断降低,且下胚轴伸长较长的弱抗寒品种‘天油2288’较下胚轴伸长较短的强抗寒品种‘16VHNTS158’内源IAA含量高,表明内源IAA含量与甘蓝型冬油菜的抗寒性呈负相关关系。韦霞霞等[24]通过对葡萄抗寒性与生长素积累相关性分析发现,生长素(IAA)在抗寒性越强的品种中含量越低。许耀照等[25]研究表明,不同抗寒性白菜型冬油菜品种叶片IAA含量随着生育进程中气温的降低均呈先升高后降低的趋势,进入越冬阶段之后,弱抗寒品种叶片和根中IAA含量均高于强抗寒品种。刘世红等[26]采用ELISA技术测定自然降温过程中油棕叶片内源激素含量变化,研究发现,从26℃降到18℃,IAA含量基本不变,低于18℃后,IAA含量显著增加,抗寒性强的品种IAA含量高,表明IAA含量的增加利于提高抗寒力,这可能与10℃以上低温处理过程有关。
通过对甘蓝型冬油菜BnYUCCA8基因表达量、内源IAA含量和下胚轴长度进行相关性分析,结果表明2个抗寒性不同材料的甘蓝型冬油菜3个指标间的相关性表现一致,BnYUCCA8的基因表达量和内源IAA含量呈显著正相关关系,下胚轴长度与BnYUCCA8基因表达量和IAA含量呈正相关关系,证实BnYUCCA8是生长素调控关键基因,且其在下胚轴伸长程度方面发挥正向调节作用。但是关于该基因在甘蓝型冬油菜低温处理过程中的作用机制及相关功能还有待进一步研究。
4 结 论
本研究从甘蓝型冬油菜中克隆到YUCCA8基因,命名为BnYUCCA8,CDS序列为1 281 bp,编码426个氨基酸,是一个不稳定的疏水性蛋白,不同物种间具有高度保守性。时空表达分析表明,其在根和叶中表达量最高,花和角果中相对较低。低温胁迫下BnYUCCA8表达量整体呈降低趋势,内源IAA含量与其表达量变化趋势基本一致,且‘天油2288’(下胚轴伸长较长且抗寒性较弱)较‘16VHNTS158’(下胚轴伸长较短且抗寒性较强)的BnYUCCA8表达量低,内源IAA含量也低。BnYUCCA8表达量与内源IAA含量呈显著正相关关系,下胚轴长度与BnYUCCA8表达量和内源IAA含量呈正相关关系,表明甘蓝型冬油菜BnYUCCA8基因可能在调控下胚轴长度和内源IAA含量中发挥重要调节作用。

