miR-205-5p通过抑制UHRF1表达促进大鼠周围神经再生的研究进展
张 娜,左晓霜,王文慧
1.空军军医大学西京医院骨科,西安 710032;2.空军军医大学西京医院肿瘤科,西安 710032
神经损伤可导致严重残疾,对患者的活动及生活质量产生影响。与中枢神经系统不同,周围神经具有再生能力,这取决于病变的性质和严重程度。外周神经损伤后,损伤部位的神经纤维碎片和中断的轴突可能阻碍神经的再生,导致神经元死亡[1]。多项研究表明,显微手术器械的发展和新的缝合技术可修复患者的周围神经损伤[2- 3],但目前仍没有任何药物能够克服神经损伤后轴突再生功能的局限性[4]。因此,迫切需要一种新的治疗外周神经损伤的策略。
MicroRNAs (miRNAs)是一种内源性编码的小RNA,研究显示其是一类重要的新型分子开关,通过作用于靶基因的3’端,促进蛋白质编码基因(mRNA)降解和(或)抑制蛋白翻译,作为基因转录后的重要调节因子,在转录后基因调控中发挥作用[5]。miRNAs的产生是通过发育和再生的生物信号来调控的,这些信号与经典的转录调节因子结合,协同放大广泛的生物和细胞行为的改变,包括神经发育、细胞存活和突触重排。而且,神经系统疾病与miRNA改变之间也存在相关性[6]。尽管针对miRNA进行了大量研究, 但相对于mRNA,目前人们对miRNA的功能认识还十分有限,尤其在神经再生过程中的作用还鲜有报道。大量研究表明,miR-205-5p在乳腺癌、胃癌和子宫内膜癌中具有抑制细胞增殖和侵袭的作用[7-9],然而,miR-205-5p与周围神经损伤后再生的关系尚不清楚。
UHRF1是一种分子量为90kd的多结构域蛋白,在调控表观遗传、机体生长、发育及肿瘤发生等方面发挥重要调控作用。研究报道,UHRF1在调节结肠T细胞和造血干细胞的增殖、存活和分化中具有重要作用[10-11],敲除小鼠胚胎中的UHRF1会表现出极端的生长迟缓。此外,UHRF1可以促进大脑皮层神经干细胞发育[12- 13],并且在周围神经损伤后表达量明显增高,能促进轴突再生[14]。然而,在周围神经损伤情况下,miR-205-5p是否通过UHRF1发挥促进神经轴突再生的作用,目前鲜有报道。因此,该研究旨在确定miR-205-5p促进大鼠坐骨神经损伤修复的作用,希望为周围神经损伤提供了一种新的基于miRNA疗法。
材料与方法
1 主要材料
1.1实验动物 选取0~2d龄SD大鼠10只,质量5~6g,平均5.7g,用于提取嗅鞘细胞和背根神经节;选取雄性SD大鼠30只用于体内实验,6~8周龄,质量200~240g,平均214.6g。大鼠均购置于空军军医大学实验动物中心,本实验经空军军医大学动物实验伦理委员会批准(KY20172005-1)。
1.2实验主要试剂 胞嘧啶(Sigma Aldrich公司,美国);B27(Gibco公司,美国);人神经生长因子(hNGF,R&D Systems公司,美国);L-谷氨酰胺(Gibco公司,美国);胰蛋白酶(北京Solarbio公司,中国);胎牛血清(Gibco公司,美国);DF12(DMEM和Ham’s F12的1∶1混合物)培养基(HyClone公司,美国);多聚左旋赖氨酸(poly-L-lysine,PLL)(Sigma公司,美国);青霉素-链霉素(北京Solarbio公司,中国);磷酸盐缓冲盐水(HyClone公司,美国);TRIzol(Invitrogen公司,美国);实时荧光定量PCR试剂盒GoTaq@qPCR Master(Promega公司,美国);双荧光素酶报告检测试剂盒(Promega公司,美国);双荧光素酶报告分析系统(Promega公司,美国);miRNA-205-5p抑制物,miRNA-205-5p-mimics和NC-mimics(上海吉凯基因公司,中国);UHRF1-siRNA和NC-siRNA(上海吉凯基因公司,中国);Lipofect AMINE 3000(上海锐赛生物公司,中国);Lipo6000TM(上海Beyotime公司,中国);miRNeasy Mini试剂盒和miRNeasy FFPE试剂盒 (Qiagen公司,德国);TaqMan MicroRNA逆转录试剂盒(Applied Biosystems公司,德国);RAPI裂解缓冲液(上海Beyotime公司,中国);蛋白定量试剂盒(上海Beyotime公司,中国);UHRF1兔单克隆抗体(Abcam公司,美国);β-actin鼠单克隆抗体(Abcam公司,美国);β-tubulin-Ⅲ兔单克隆抗体(CST公司,美国);鼠抗NF160单克隆抗体(Abcam公司,美国);山羊抗兔绿色荧光二抗、山羊抗鼠红色荧光二抗 (江苏康为世纪公司,中国);山羊抗鼠二抗、山羊抗兔二抗(江苏康为世纪公司,中国)。
1.3实验主要仪器 台式离心机(湖南湘仪公司,中国);培养瓶(广州杰特生物,中国);电泳仪(BioRad公司,美国);转膜仪(BioRad公司,美国);荧光显微镜(Olympus公司,日本);荧光定量PCR仪(BioRad公司,美国);全自动定量绘图酶标仪(BioTek公司,美国)。
2 实验方法
2.1新生SD大鼠背根神经节(DRG)的提取和纯化 将出生0~2d的SD大鼠置入冰冻的75%乙醇缸内消毒处死,随后转移至超净台中,利用体视显微镜摘取背根神经节,去除神经周围组织后用剪刀将神经剪碎至1mm3小块,然后用0.25%胰蛋白酶和0.2%Ⅳ型胶原酶消化60min,然后在含有2%的B27、50ng/mL的人神经生长因子(hNGF)、2mM的L-谷氨酰胺和1%的青链霉素混合液的神经培养基中培养。差速贴壁纯化后,用10μmol/L的胞嘧啶处理48 h去除其中的成纤维细胞。然后培养基被不含胞嘧啶的神经基培养基替代,用于后续实验。
2.2成年SD大鼠坐骨神经损伤模型的构建 选用SD大鼠30只,分为损伤组(15只)和对照组(15只),腹腔内注射3%戊巴比妥钠溶液麻醉,切开左后肢的皮肤和钝性分裂下面的组织,小心地暴露出左侧坐骨神经。在坐骨神经上靠近背根神经节一端距离坐骨神经分叉处1cm的位置用止血钳挤压10s,然后将肌肉和表皮进行缝合,损伤和对照组的SD大鼠同时暴露坐骨神经,但对照组不对坐骨神经进行挤压,为3d后提取神经元做准备。
2.3成年SD大鼠的DRG神经元的提取和神经长度分析 实验方法2.2中预处理损伤及对照组的SD大鼠中分离出L4的背根神经节,分别从对照组和损伤组取部分DRG组织用于检测miR-205-5p的表达情况。将取出的其他DRG组织剪碎后,置于含10mmol/L羟乙基哌嗪乙硫磺酸(HBSS-H)的Hanks平衡盐溶液中,37℃下连续应用含有木瓜蛋白酶(15U/mL)和胶原酶(1.5mg/mL)的HBSS-H溶液处理背根神经节,用100 μm的细胞滤网过滤细胞。然后重悬于含有2%的B27(Gibco)、50ng/mL的hNGF、2mM的L-谷氨酰胺和1%的青链霉素混合液的神经培养基中,并在含有聚d-赖氨酸/层黏连蛋白涂层的培养皿上培养。成年DRG神经元培养20h,用β-III-tubulin(1∶200)染色。观察DRG轴突生长情况,测量其最长神经轴突长度,并计算轴突的总长度。
2.4实时荧光定量PCR检测miR-205-5p的表达水平 细胞中总RNA提取使用miRNeasy Mini试剂盒,组织中总RNA提取使用miRNeasy FFPE试剂盒。使用TaqMan MicroRNA逆转录试剂盒进行逆转录。根据制造商的说明,使用TaqMan MicroRNA检测系统(应用生物系统)测量miR-205-5p的表达情况。RNU6B(MicroRNA内参)被用作内部对照,使用比较阈值(Ct)法计算相对表达。
2.5实时荧光定量PCR检测UHRF1的表达水平 取适量背根神经节细胞,加入1mL TRIzol进行匀浆,加入200μL氯仿萃取并离心取上清液,再加入等体积异丙醇,-20 ℃静置过夜沉淀RNA;离心除去上清液,用75%乙醇溶液洗涤沉淀后,将RNA溶解于无酶的去离子水中。
利用酶标仪检测提取的RNA的浓度和纯度,利用GoScript反转录系统获得cDNA,之后使用Promega GoTaq@qPCR Master Mix行实时Q-PCR分析,以2-ΔΔCt值表示目的基因的相对表达量,引物序列见表1。
2.6miR-205-5p对DRG神经元的影响 将提取的新生SD大鼠DRG神经元分为4组,一组用PBS处理,其余三组使用脂质体法(Lipofect AMINE 3000)分别转染50nM的miR-205-5p-mimic、抑制物和miRNA-NC。转染流程参阅试剂盒提供的操作说明, 每组细胞设置4个复孔。转染后细胞在37℃培养箱继续孵育24h,用β-III-tubulin(1∶200)染色。观察DRG神经元轴突生长情况,测量其最长神经轴突长度。
2.7荧光素酶报告实验检测 miR-205-5p与UHRF1基因的相关性 通过Starbase网站(starbase.sysu.edu.cn/)分析miR-205-5p的相关靶基因,发现UHRF1基因可能是miR-205-5p的靶基因。
荧光素酶报告检测按照制造商的方案进行。293T细胞(工具细胞,具有易转染特点)被接种于24孔板中,使用Lipo6000TM将荧光素酶报告基因UHRF1-3’-UTR-WT或UHRF1-3’-UTR-MUT其中一种和miR-205-5p-mimics(50nm)或NC-mimics其中一种共转染。根据制造商的协议,使用双荧光素酶检测试剂盒测定荧光素酶活性。每项实验重复3次。
2.8miR-205-5p过表达对大鼠DRG神经元的影响 将提取的成年雄性SD大鼠DRG神经元分为NC-mimics+未损伤、NC-mimics+损伤、miR-205-5p-mimics+未损伤和miR-205-5p-mimics+损伤4组,按照分组使用脂质体法分别向其转入对应的质粒。每组细胞设置4个复孔。转染后细胞在37℃培养箱继续孵育24 h,用蛋白免疫印迹法(WB)检测UHRF1的表达情况。
2.9检测UHRF1的干扰RNA(UHRF1-siRNA)对坐骨神经损伤大鼠DRG神经元UHRF1表达的影响 为了敲除UHRF1,将提取的坐骨神经损伤的成年雄性SD大鼠DRG神经元分为损伤+NC、损伤+ UHRF1-siRNA1、损伤+ UHRF1-siRNA2和损伤+ UHRF1-siRNA3共4组,分别转染25 nM的NC-siRNA、UHRF1-siRNA1、UHRF1-siRNA2和UHRF1-siRNA3。使用脂质体法分别将上述质粒转入细胞。转染流程参阅试剂盒提供的操作说明, 每组细胞设置4个复孔。转染后细胞在37℃培养箱继续孵育24h,并用Q-PCR和蛋白质印迹法(WB)检测转染效率。
2.10检测miR-205-5p通过调节UHRF1表达进而调控DRG神经元轴突再生 将提取的新生SD大鼠DRG神经元分为miR-NC、miR-205-5p抑制物、miR-205-5p抑制物+si-NC和miR-205-5p inhibitor+UHRF1-si-UHRF1共4组,按照分组使用脂质体法分别向其转入对应的质粒。每组细胞设置4个复孔。转染后细胞在37℃培养箱继续孵育24h,用β-III-tubulin(1∶200)染色。观察DRG神经元轴突生长情况,测量其最长神经轴突长度。
2.11蛋白质印迹法检测UHRF1蛋白表达水平 收集上述各组涉及到WB实验的细胞,用RIPA裂解液处理细胞,提取细胞总蛋白,通过使用蛋白定量试剂盒检测蛋白浓度。取等量蛋白进行SDS-PAGE分离,并用湿转法将蛋白转至PVDF膜上。用含5%脱脂奶粉封闭处理PVDF膜2h,按照1∶1000的稀释比例配制一抗(UHRF1、β-actin),4 ℃孵育过夜。用PBST清洗3次,每次5min。按照1∶3000的稀释比例加入二抗,室温孵1h,用PBST清洗3次,每次5min。最后使用化学发光试剂盒显影,分析各蛋白条带的灰度值。以UHRF1蛋白与β-actin蛋白条带灰度值之比表示其相对表达水平。
3 统计学分析
结 果
1 实验动物情况
坐骨神经损伤和对照组大鼠各15只,均存活,全部进入后续实验数据分析。
2 坐骨神经损伤后,神经再生能力增强,并且miR-205-5p表达降低
通过β-Ⅲ-tubulin染色发现,与对照组对比,坐骨神经损伤组DRG神经元最长神经轴突长度显著增加(P<0.01,图1a、b)。采用Q-PCR检测了损伤和未损伤SD大鼠的DRG组织和细胞中miR-205-5p的表达水平。结果显示,损伤组SD大鼠的DRG组织和细胞中miR-205-5p的表达水平明显低于对照组(P<0.01,图1c)。以上结果表明,机体发生坐骨神经损伤后,miR-205-5p表达水平明显下降。

图1 大鼠坐骨神经损伤引起轴突再生,并抑制miRNA-205-5p表达。a、b.从对照组和损伤组大鼠身上分离的成年DRG神经元,培养20h,用神经元特异性标记物β-tubulinⅢ染色;c.Q-PCR检测坐骨神经损伤后miRNA-205-5p在坐骨神经损伤中的表达。标尺:50μm。与对照组比较:**P<0.01
3 抑制miR-205-5p表达促进背根神经节细胞轴突生长
以新生SD大鼠提取的DRG细胞为模型,Q-PCR法检测结果(图2a)显示,与PBS组和NC-mimics组相比,miR-205-5p-mimics组DRG中miR-205-5p的表达水平明显上调,miR-205-5p inhibitor组DRG中miR-205-5p的表达水平显著下降,提示成功构建了miR-205-5p过表达及低表达的背根神经节细胞。
与PBS对照组和NC-mimics组对比,miR-205-5p抑制物组背根神经节细胞的最长神经轴突长度显著增加(P< 0.001,图2b、c)。以上数据表明,抑制miR-205-5p表达能在体外环境中促进背根神经节细胞轴突生长。
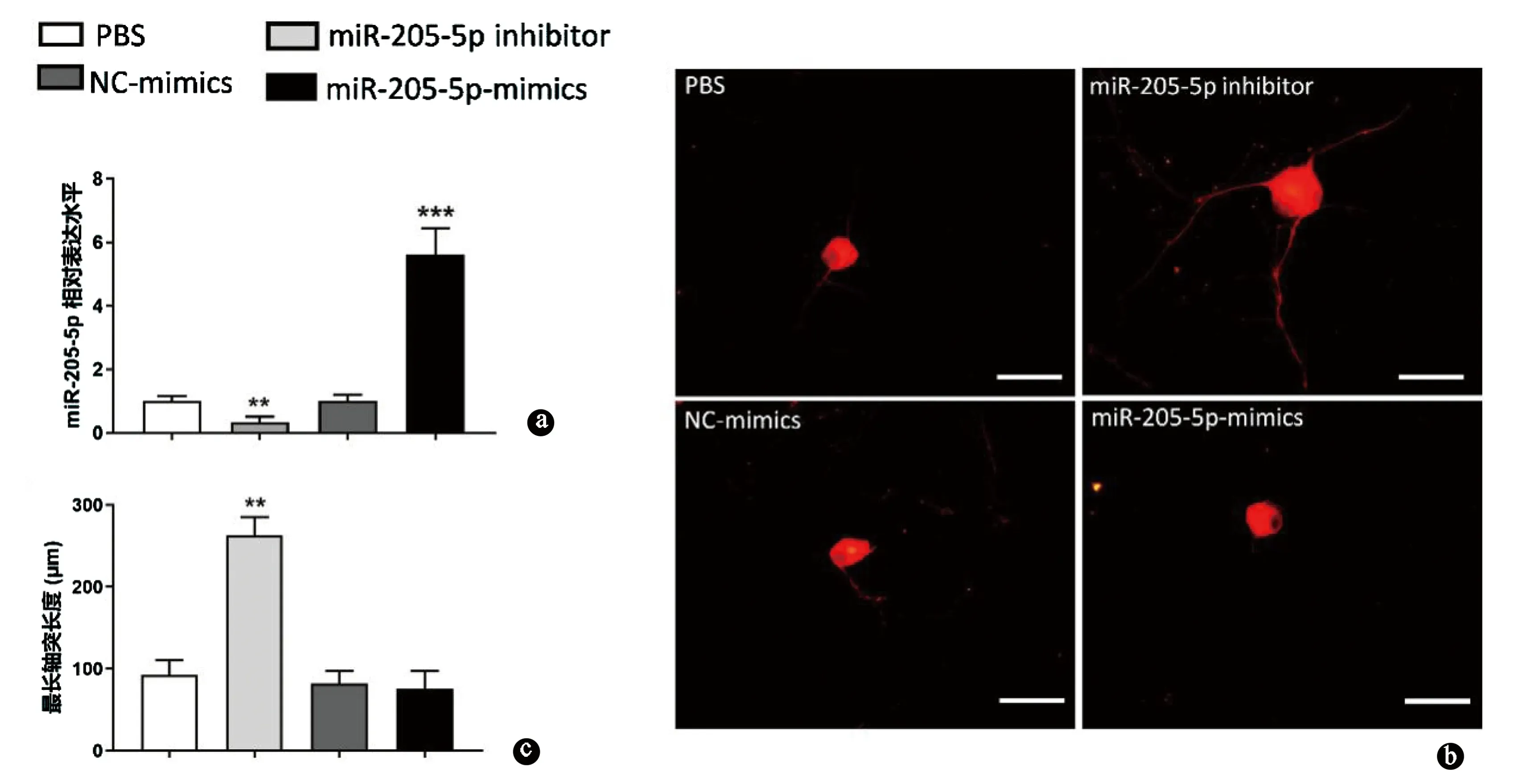
图2 抑制miR-205-5p促进DRG细胞轴突生长。a.miR-205-5p-mimic和miR-205-5p inhibitor转染后,DRGs内miR-205-5p的表达水平;b.用miR-205-5p-mimic和miR-205-5p inhibitor转染DRGs后,用神经元特异性标记物β-tubulinⅢ染色;c.在转染后96h后,观察并定量各组最长神经突长度。标尺:50 μm。与NC-mimics比较:**P<0.01,***P<0.001
4 miR-205-5p与UHRF1相互作用
通过Starbase网站进行生物信息学分析后发现,UHRF1基因可能是miR-205-5p的直接靶点(图 3a),两者具有一定的相关性。
进一步采用荧光素酶报告基因实验来验证miR-205-5p是否直接靶向结合UHRF1。笔者发现,与NC-mimics+野生型UHRF1-3’-UTR重组质粒组、NC-mimics+突变型UHRF1-3’-UTR重组质粒组和miR-205-5p-mimics+突变型UHRF1-3’-UTR重组质粒组相比,仅有miR-205-5p-mimics+野生型UHRF1-3’-UTR重组质粒组的荧光素酶活性明显被降低(P<0.01,图3b)。结合Starbase网站预测结果分析推测miR-205-5p可直接靶向UHRF1基。
5 过表达miR-205-5p抑制UHRF1的表达
采用Q-PCR法和WB检测UHRF1 mRNA 和蛋白的表达水平。Q-PCR法检测结果显示,与NC-mimics+未损伤组的背根神经节细胞相比,NC-mimics+损伤组中UHRF1 mRNA的表达水平显著升高(P<0.01),但是在转入miR-205-5p-mimics(miR-205-5p-mimics+损伤组)后,损伤引起的UHRF1 mRNA升高被显著抑制(图3c).采用WB检测UHRF1蛋白的表达水平,发现NC-mimics+损伤组DRG中UHRF1蛋白水平显著升高(P<0.01),但是这种情况在转入miR-205-5p-mimics后(miR-205-5p-mimics+损伤组)明显被抑制(P<0.01,图3d、e)。上述结果说明,miR-205-5p能够抑制周围神经损伤引起的UHRF1高表达。
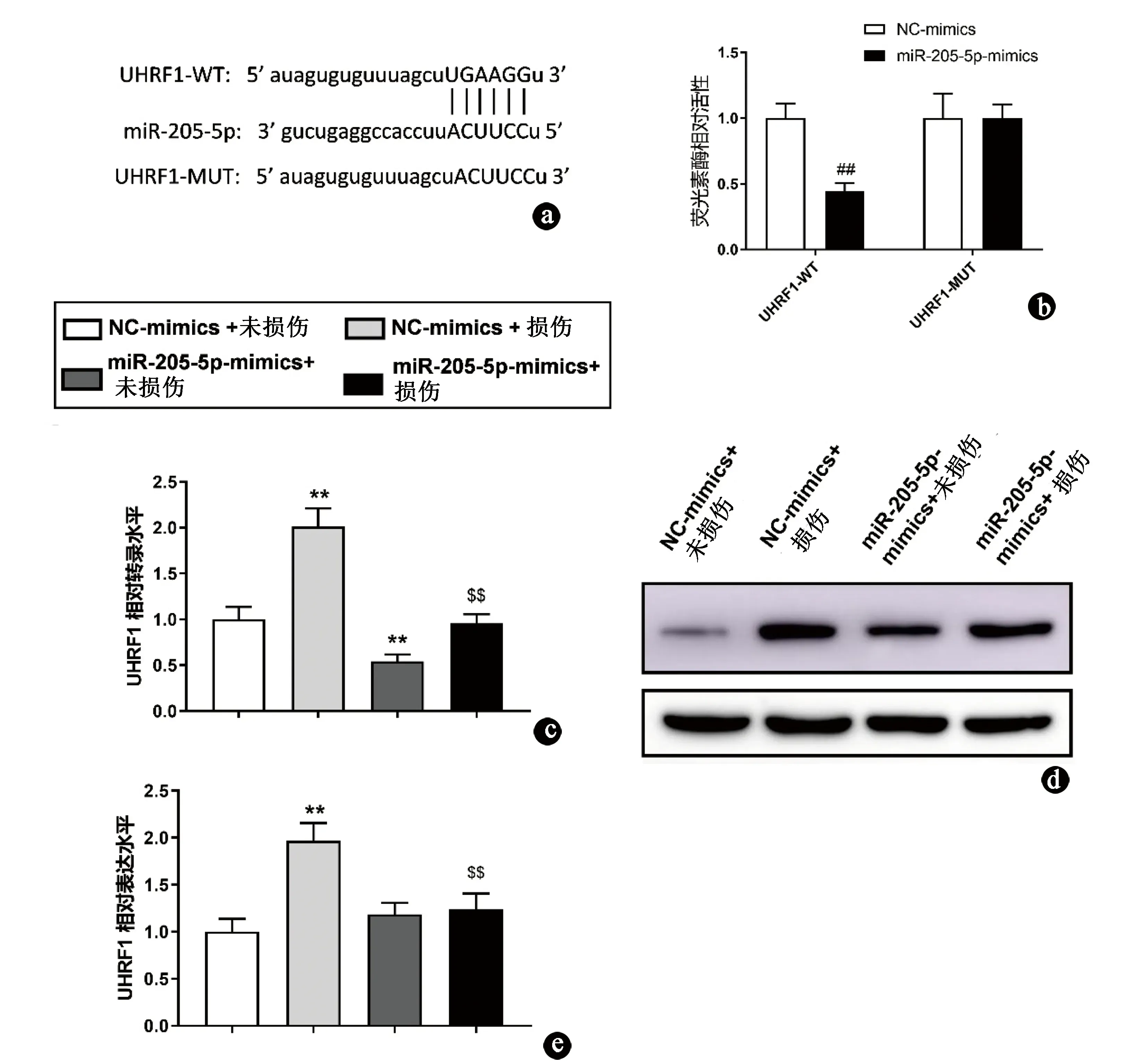
图3 miR-205-5p调控UHRF1的表达。a.预测UHRF1和miR-205-5p的结合位点;b.双荧光素酶报告基因转染48h后,进行荧光素酶测定;c.通过qRT-PCR确认各组差异表达的miRNA;d、e.比较各组UHRF1表达差异。与NC-mimics组对比:##P<0.01;与NC-mimics+未损伤组对比:**P<0.01;与NC-mimics+损伤组对比:$$P<0.01
6 miR-205-5p通过调控UHRF1影响神经再生
通过Q-PCR和WB发现UHRF1 siRNA-3对UHRF1表达下调作用最为显著,所以UHRF1 siRNA-3被用作下一步实验(P<0.05,图4a、b)。笔者将UHRF1 siRNA-3(si-UHRF1)和阴性对照载体(si-NC)分别瞬时转染DRG神经元,发现miR-205-5p inhibitor可上调DRG中UHRF1蛋白的表达水平,而si-UHRF1(miR-205-5p inhibitor+UHRF1-si-UHRF1组)恢复了DRG中UHRF1蛋白的表达(图4c)。miR-205-5p抑制物对神经突生长的促进作用被si-UHRF1抑制(图4d~i)。这些结果共同表明,miR-205-5p通过调控UHRF1影响神经再生。

图4 miR-205-5p通过调控UHRF1影响神经再生。a.用靶向UHRF1的3种不同siRNA和NC转染后,qRT-PCR检测DRG神经元中UHRF1 转录水平;b.用3种不同的靶向UHRF1的siRNA和NC转染后,检测DRG神经元中UHRF1的表达;c.miR-205-5p inhibitor上调DRGs中UHRF1蛋白的表达,而转染si-UHRF1质粒可抑制DRGs中UHRF1蛋白的表达;d、e.si-UHRF1再次导入DRG神经元可部分抑制miR-23b-3p inhibitor对神经突生长的增强作用。标尺:50μm。与损伤+NC组对比:*P<0.05,**P<0.01;与miR-NC组对比:##P<0.01
讨 论
miRNA在神经组织中表达具有组织特异性,如miR-9及miR-124仅在中枢神经系统表达[15-16]。目前,已发现miR-9、miR-219及miR-13等多个分子在中枢神经系统发育中发挥关键作用[17-19]。尽管既往针对 miRNA 开展了大量研究,但miRNA在周围神经再生中的作用研究尚处于初步阶段。Zhou等[20]发现神经损伤后大量miRNA分子表达改变,提示miRNA 在神经损伤中可能发挥作用。Wu等[21]条件性敲除miRNA合成的关键分子Dicer后,大鼠坐骨神经离断后的功能恢复及形态重建等明显受限,说明miRNA在神经损伤修复过程中发挥了重要作用。目前,关于miR-205-5p的研究主要集中在肿瘤、血管及动脉粥样硬化等方面。王海波等[22]发现,过表达miR-205-5p可显著抑制胶质瘤细胞增殖及诱导细胞凋亡。有研究报道miR-205-5p高表达通过抑制血管内皮生长因子表达,从而调控血管内皮细胞的存活。并且,miR-205-5p通过下调PRKCA mRNA及蛋白表达,减少p38蛋白的磷酸化,进而抑制血管平滑肌细胞增殖与迁移,达到其抗动脉粥样硬化的作用[23]。但关于miR-205-5p对坐骨神经再生的作用鲜有报道,因此本研究中重点探讨了其在周围神经损伤中的作用。
在某种程度上,周围神经系统的成熟神经元在轴突损伤后可以切换到再生状态。事实上,外周而非中枢轴突损伤会引起再生反应背后涉及到复杂的转录和表观遗传变化[24]。进来研究的主要焦点是揭示再生相关基因(RAGs)促进轴突再生和调控这些基因的分子[25-26]。然而,受伤后基因被抑制的作用和相关机制仍需深入研究。
Bronner等[27]发现UHRF1在肿瘤细胞中高表达,并参与抑制肿瘤抑制基因。考虑到肿瘤抑制因子在限制轴突再生方面的重要作用,Young等[14]通过在轴突上验证发现,在损伤的周围神经中,UHRF1通过抑制PTEN和p21 (CDKN1A)基因的表达促进轴突再生。进一步研究发现,UHRF1通过与二甲基化和三甲基化H3K9相互作用并招募DNMT1和DNMT3a促进PTEN和p21 (CDKN1A)的DNA甲基化来抑制其基因表达。同时,UHRF1也在高度增殖的神经干/前体细胞中表达[28],这提示在损伤的神经元中上调UHRF1的表达可能会使其处于再生状态。
本研究结果表明,与正常组织或细胞相比,周围神经损伤后神经再生能力明显增强,此外,笔者发现周围神经损伤的组织或细胞中 miR-205-5p表达降低。并且抑制miR-205-5p表达会增加DRG神经元轴突再生的能力。而miR-205-5p过表达会抑制DRG神经元轴突再生。此外, miR-205-5p可直接靶向UHRF1基因,miR-205-5p过表达可明显抑制UHRF1 mRNA 和蛋白的表达水平,同时抑制miR-205-5p和UHRF1表达下调抑制miR-205-5p引起的DRG神经元轴突再生能力。表明miR-205-5p通过对UHRF1蛋白表达水平的调控改变了DRG神经元轴突再生能力。
综上所述,本研究表明抑制miR-205-5p通过促进UHRF1表达促进了DRG神经元轴突再生,为周围神经损伤提供了一种新的无细胞疗法。
作者贡献声明:张娜:实验实施、收集数据、文章撰写;左晓霜:分析数据;王文慧:课题设计