老年营养风险指数对2型糖尿病骨质疏松症的预测价值
戴慧芳 李海 苏小游 戴志娟 朱烈烈
骨质疏松症在老年人群中普遍存在,其产生的疼痛及脆性骨折等会导致患者生活质量降低甚至残疾或死亡[1-2]。一般来说,2型糖尿病(type 2 diabetes mellitus,T2DM)患者发生骨质疏松症的风险更高[3-6]。既往研究表明,低体重和低蛋白血症均与T2DM患者的腰椎骨质疏松相关[7-8]。基于血清白蛋白和实际体重与理想体重比值的老年营养风险指数(geriatric nutritional risk index,GNRI)近年来已被视作一种简单有效的评估工具,在多种临床环境中(比如评估患者营养状态,预测肿瘤、血液透析、心力衰竭等患者的预后)发挥作用[9-12],但GNRI较少应用于T2DM患者的评估。因此,本研究探讨GNRI对T2DM患者骨质疏松症的预测价值,现将结果报道如下。
1 对象和方法
1.1 对象 选择2019年6月至2021年6月在温州医科大学附属第二医院内分泌科收治的T2DM患者737例,男 343 例,女 394 例,年龄 50~93(68.7±8.8)岁。参照WHO推荐的骨质疏松症的诊断标准[13],将其分为骨质疏松症组225例和对照组512例。同时,按性别分为男性组343例和女性组394例。纳入标准:(1)T2DM参照《中国2型糖尿病防治指南(2017年版)》的诊断标准[14];(2)年龄≥50岁。排除标准:(1)恶性肿瘤和严重的心、肝、肾疾病;(2)垂体、甲状腺、甲状旁腺、肾上腺和性腺疾病;(3)女性未绝经;(4)长期卧床;(5)同时服用影响骨代谢药物,如钙、维生素D和双磷酸盐。本研究经医院医学伦理委员会批准(批准文号:LCKY2019-287)。两组患者均签署知情同意书。
1.2 方法
1.2.1 一般资料及骨代谢指标的收集 收集两组患者性别、年龄、糖尿病病程、吸烟史、饮酒史等一般资料。测量两组患者身高和体重,计算BMI。采集两组患者过夜空腹10 h以上静脉血,采用美国强生Vitros生化免疫分析仪5600检测代谢指标,包括:FBG、糖化血红蛋白(HbA1C)、TC、TG、HDL-C、LDL-C、白蛋白、血肌酐、血尿酸和血清总钙。将血清总钙结果以如下公式校正为白蛋白校正钙:白蛋白校正钙=血清总钙-0.02×(白蛋白-40)。采用瑞士罗氏电化学发光分析仪Cobas e602检测骨代谢指标,包括:甲状旁腺素(parathyroid hormone,PTH)、Ⅰ型前胶原 N-末端前肽(procollagen of typeI N-propeptide,P1NP)、β 异构 C 末端肽(β-isomerized C-terminal telopeptides,β-CTX)和 25-羟基维生素 D(25-hydroxy-vitamin,25-OH-D)。
1.2.2 GNRI的计算及骨密度测量[15]GNRI=1.489×血清白蛋白+41.7×(体重/理想体重)。男性理想体重=0.75×身高-62.5,女性理想体重=0.6×身高-40。如果体重≥理想体重,体重/理想体重按1计算。应用美国Bedford双能X线骨密度测量仪Hologic-Discovery A测量两组患者在腰椎、股骨颈和髋关节3个位置的骨密度,取3个位置的骨密度值的平均数作为每例患者的平均骨密度值。
1.2.3 GNRI分级比较 根据GNRI分值按营养风险将两组患者分为以下4个等级:高营养风险(Q1):GNRI<82;中营养风险(Q2):GNRI 82~<92;低营养风险(Q3):GNRI 92~98;无营养风险(Q4):GNRI>98。比较骨质疏松症组不同GNRI等级病例的分布情况及男性组和女性组不同GNRI等级病例骨质疏松症患病率。
1.3 统计学处理 采用SPSS 25.0统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验,计数资料比较采用χ2检验。指标之间的相关性分析采用Spearman秩相关。将经过单因素分析筛选出来的有意义的变量以及既往研究表明可能有意义的变量纳入多因素logistic回归分析,依次建立未校正模型1,校正年龄和BMI的模型2,校正年龄、BMI、PTH和P1NP的模型3,分别计算相应模型中GNRI对骨质疏松症发生的OR值。ROC曲线评估变量对结局的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料、骨代谢指标、GNRI及平均骨密度比较 骨质疏松症组女性比例、BMI、PTH均高于对照组,白蛋白、白蛋白校正钙、P1NP、GNRI、平均骨密度均低于对照组,差异均有统计学意义(均P<0.05),见表 1。

表1 两组患者一般资料、骨代谢指标、GNRI及平均骨密度比较
2.2 骨质疏松症组不同GNRI等级病例的分布情况Q1为 113例(50.2%),Q2为 78例(34.7%),Q3为16例(7.1%)和Q4为18例(8.0%)。不同等级病例分布的构成比进行两两比较,除Q3和Q4间差异无统计学意义(P>0.05)外,其余等级间的差异均有统计学意义(均 P<0.05)。
2.3 男性组和女性组不同GNRI等级骨质疏松症病例患病率比较 男性组不同GNRI等级病例骨质疏松症患病 率 分 别 为 :Q1 为 79.6%(39/49),Q2 为29.3%(34/116),Q3 为 7.1%(6/85)和 Q4 为 9.7%(9/93)。女性组分别为:Q1为 89.2%(74/83),Q2为 34.4%(44/128),Q3 为 11.0%(10/91)和 Q4为 9.8%(9/92)。男性组、女性组不同GNRI等级病例骨质疏松症患病率进行两两比较,除Q3和Q4间差异无统计学意义(P>0.05)外,其余等级间的差异均有统计学意义(均 P<0.05)。
2.4 GNRI与代谢指标的相关性分析 校正年龄和BMI后,Spearman秩相关分析显示总人群的GNRI仍与HDL-C、白蛋白校正钙和平均骨密度呈正相关,与PTH和β-CTX呈负相关(均P<0.05)。男性组与女性组均存在上述指标间类似于总人群的相关关系(均P<0.05),其中男性组血尿酸、血肝酐与GNRI亦存在相关性,见表2。

表2 GNRI与代谢指标的相关分析
2.5 GNRI与骨质疏松症发生风险的关系 多因素logistic回归分析显示,在总人群中,模型1中GNRI与骨质疏松症的发生呈负相关,模型2与模型3中GNRI与骨质疏松症的发生仍呈负相关(均P<0.01),说明GNRI为影响骨质疏松症发生的独立保护因素。此外,GNRI与骨质疏松症发生的负相关关系,在男性组与女性组也均存在(均P<0.01)。见表3。男性组和女性组分别以GNRI等级分层进行logistic回归分析,结果发现,模型1中,以营养风险等级最低的Q4为参照,男性组发生骨质疏松症风险的OR值在Q3低于Q4(P>0.05),Q2 OR 值高于 Q4,Q1 OR值最大(均P<0.01)。女性组发生骨质疏松症风险的OR值为Q3大于 Q4(P>0.05),Q2高于 Q4,Q1OR 值最大(均 P<0.01)。男性组与女性组的这种变化在总体上的趋势性检验均显示存在统计学意义(均P<0.01)。模型2和模型3中,男性与女性均仍存在类似趋势(均P<0.01)。见表4。
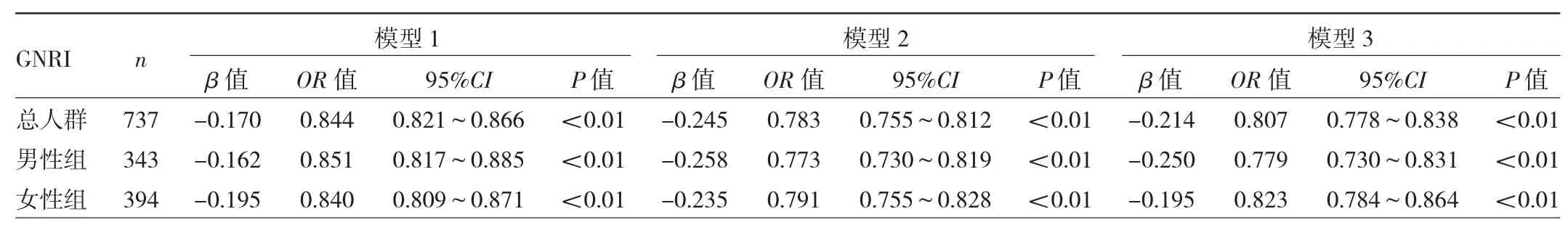
表3 GNRI与骨质疏松症发生风险关系的logistics回归

表4 男性组与女性组以GNRI等级分层的logistic回归
2.6 BMI、白蛋白、白蛋白校正钙和GNRI对骨质疏松症预测效能的比较 通过ROC曲线分析发现,与BMI、白蛋白和白蛋白校正钙比较,男性组和女性组中GNRI的 AUC均为最大(均P<0.01)。各指标预测骨质疏松症的效能见表5。

表5 各指标预测骨质疏松症的效能
3 讨论
GNRI最初用于评估老年人群营养不良引起的相关并发症的风险[15-16]。与其他营养指标不同,GNRI通过白蛋白、身高和体重计算获得,操作简便,受主观因素影响较小,具有良好的评估者间一致性[17],比较适合多种疾病如肿瘤、血液透析、肾病等的营养状态评估和长期监测[17-19],有助于及早发现患者潜在的营养风险。后来进一步发现GNRI能够准确地预测临床结局,在死亡、心血管事件、神经功能障碍等的预测方面具有较优的价值[16,20-21]。
本研究比较了T2DM合并骨质疏松症组和对照组的一般资料,校正影响因素之后发现GNRI与HDLC、白蛋白校正钙和平均骨密度呈正相关,与PTH和β-CTX呈负相关。而其中与GNRI相关性较大的白蛋白校正钙和骨密度提供了更多的危险因素线索:低GNRI水平与骨密度和血清总钙水平低有关。这在一定程度上提示,在GNRI水平较低的患者中,营养不良对骨量水平低贡献了某种作用。此现象与同类研究结果一致[22]。本研究还进一步对GNRI进行营养风险由高到低分级,发现越高的营养风险等级对应着越高的骨质疏松症患病率,这进一步加大了营养与骨质疏松症之间负性关系的论证强度。基于之前的研究[16],本研究选取了可能的影响因素进行logistic回归分析,经过校正协变量后结果明确显示了两者的直接联系:GNRI水平与T2DM患者骨质疏松症的发生呈负相关,是骨质疏松症发生的独立保护因素(OR=0.807,P<0.05)。该结果为当前T2DM患者骨质疏松症的评估及预测提供了依据。
此外,与单一白蛋白或BMI相比,整合了白蛋白和BMI的GNRI对骨质疏松症的预测效能更强(GNRI的AUC最大,P<0.05)。而GNRI值仅根据血清白蛋白、体重和身高这几个入院常规评估指标就能计算获得,更加体现了其在评估营养或疾病病情方面的简便快捷[17],因此GNRI水平可作为评估T2DM患者营养和预测骨质疏松症的简便高效的方法。
因为本组资料性别比例在骨质疏松症组和对照组之间不均衡,故本研究进一步以性别分组进行了回归分析和预测,结果显示,GNRI水平对男性和女性骨质疏松症的OR值分别为0.779和0.823,表明基于GNRI水平的升高,对骨质疏松症发生风险的保护效应,男性要比女性更占优势。本研究还发现随着营养风险等级的变化,男性和女性发生骨质疏松症风险变化的总体趋势是一致的:即男性和女性随着GNRI营养风险等级由低到高,发生骨质疏松症风险的OR值也更大(均P<0.01)。但明显的区别在于,在校正协变量(年龄、BMI、PTH和P1NP)之后的模型3中,以营养风险等级最低的Q4为参照,男性营养风险等级最高的Q1,其发生骨质疏松症的风险OR值达到了458.62,而同样的条件下,女性仅为107.60,且值得注意的是,这种巨大的差异出现于增加校正PTH和P1NP之后,因为在仅仅校正年龄和BMI的模型2中,男性和女性相应的OR值分别为432.89和351.99。另外,男性和女性的差异,还体现在以GNRI预测骨质疏松症的效能方面:男性区分度稍低于女性,男女灵敏度相当而男性特异度低于女性。这些明显的性别差异也常见于多种代谢性疾病[4-5],可能与男女性激素水平变化的差异反映到骨代谢指标上有关。
几个可能的机制可以解释GNRI与骨质疏松症有关的原因。首先,有研究表明,肠道对钙的吸收会因蛋白质的高摄入量而上调[23]。与此相一致的是,本研究中GNRI与钙之间的正向关系在男性和女性中都有体现(男性r=0.493,女性r=0.448)。补充钙在治疗骨质疏松症中的作用已被证实[24]。其次,在饮食中补充蛋白质可以有效地增加肌力和身体协调性[25]。而增强的肌肉可以保护骨骼和关节,康复领域公认可以减少骨质疏松症的发生[26-27]。第三,与骨代谢相关标志物之间存在的关联可能提示了GNRI与骨质疏松症之间负相关机制的部分线索。本研究发现GNRI水平与骨代谢相关标志物如PTH、P1NP以及β-CTX存在相关性。而此类骨转换标志物,相互之间的比例失衡是导致骨质疏松症形成的重要原因[28]。男性组还发现血尿酸、血肌酐与GNRI存在相关性,而尿酸与肌酐可以通过肾功能来影响骨代谢[29]。还有研究发现血清尿酸可能通过下调 β-CTX水平抑制骨吸收,从而起到改善骨密度的作用[30]。但本研究中未发现两者之间存在直接关系。也有研究认为PTH升高是骨量丢失的危险因素[31],本研究中骨质疏松症组PTH显著高于对照组与之一致。
本研究也存在一些与已有研究结果不一致的地方。比如与本研究发现的GNRI与骨密度的正相关不同,有研究表明,类风湿性关节炎患者的GNRI和骨密度之间存在显著的负相关性[32]。这从另一方面也进一步显示出骨质疏松症发生机制的复杂性及其在不同疾病背景下的多样性。本研究还存在一些局限性。首先,本研究系横断面研究,GNRI和骨密度之间的因果关系难以评估。另外回顾性研究的特性导致一些可能影响结果的参数无法进一步分析,如性激素水平、饮食、体力活动等。其次,研究中所有的血清样本只采集1次,每个位置的骨密度也只采集1次,导致了数据分析时的偏倚。
综上所述,在T2DM患者中,GNRI水平与骨密度显著相关,是骨质疏松症发生的独立保护因素。GNRI对骨质疏松症的预测能力优于BMI和血清白蛋白,可以作为临床上评估T2DM患者发生骨质疏松症的简便而高效的指标。

