大鼠膈神经移位修复前肢神经丛下干后股△
黎 立,艾尔肯·热合木吐拉,司 裕,周泓宇
(新疆维吾尔自治区中医医院骨三科,新疆乌鲁木齐 830001)
臂丛神经损伤是严重的、致残率极高的神经损伤,手的各项功能均丧失,目前治疗方案有神经移位术,神经移位术后患者肩、肘功能恢复良好,手指屈曲活动也可部分恢复,但伸指活动恢复欠佳,分析原因可能是以往神经移位将动力神经移位至桡神经主干,导致多数动力神经错配到感觉神经或桡神经伸肘伸腕肌支,作者考虑伸指功能来源与桡神经深支-桡神经-下干后股-C8T1节段脊髓,既往有研究尝试将动力神经移位至下干后股来恢复伸指功能,文献报道该方法恢复伸指功能的结果不确定,即膈神经移位下干后股不只恢复伸指功能也恢复伸肘功能,且伸肘功能恢复较理想[1]。其次既往膈神经作为动力神经修复臂丛神经广泛运用[2~5],但也有研究表明膈神经移位可导致膈肌麻痹并降低吸气肌力,尤其是在老年人[6],目前膈神经功能越来越引起重视,在高位截瘫导致的膈肌麻痹后使用臂丛神经、迷走神经、副神经移位修复膈神经也得到良好呼吸功能[7],甚至也有膈神经移位修复臂丛神经后再通过肋间神经修复膈神经的相关研究[8]。对于有限的供体神经来说端侧移位无疑是最佳选择,在一项猕猴的动物实验中,修复高位损伤尺神经同时用桡浅神经端侧移位修复腕部尺神经,有效防止猕猴手内在肌萎缩[9]。所以本研究设计动物试验将膈神经作为动力神经通过端端及端侧两种方法选择性移位至下干后股以验证定向修复伸指功能,同时端侧吻合避免膈神经动力丧失,并且通过神经示踪技术观察相应脊髓节段阳性细胞数量,进一步明确移位有效性及断端、端侧修复优劣性,同时对其安全性进行评估。
1 材料与方法
1.1 实验动物与试剂材料
实验动物:SD大鼠24只(体重200~220 g),实验动物麻醉剂:1%戊巴比妥钠溶液(0.5 ml/100 g),碘酊消毒液,75%酒精,逆向示踪剂:荧光金,Prolene缝合线12-0,普通缝合丝线。
1.2 动物分组与处理
取 SD大鼠 24只(体重 200~220 g),分为四组,每组6只:分别为端侧吻组、端端吻合组、原位吻合组及未修复组(图1)。
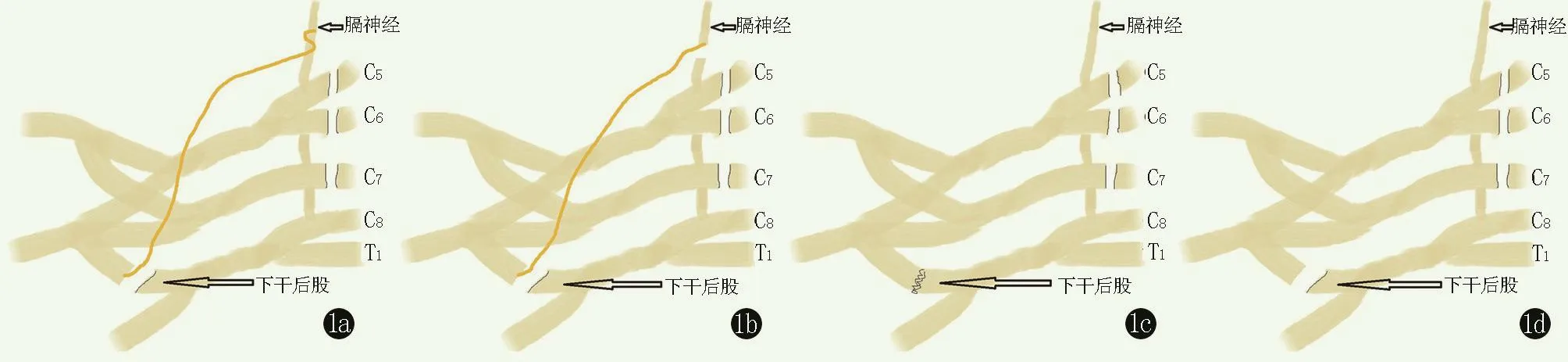
图1 四组动物手术处理示意图 1a:端侧吻合组 1b:端端吻合组 1c:原位吻合组 1d:未修复组
用1%戊巴比妥钠溶液(0.5 ml/100 g)腹腔麻醉。仰卧位固定,碘酊消毒右颈部、胸部2次,酒精脱碘。取颈至胸部L形切口长约4 cm,锁骨上探查找到膈神经并标记备用。再在锁骨下探查找到下干后股备用。取下肢内侧长约4 cm纵向切口,根据移植需要切取3 cm隐神经备用。
端侧吻合组:锁骨上根部切断C7/8、T1神经根,将近断端埋入斜角肌内,在锁骨下切口切断的下干后股近端埋入附近肌肉内,锁骨上膈神经与隐神经移植物端侧缝合,隐神移植物经环绕膈神经2圈再用12-0 Prolene线缝合固定,远端与下干后股端端缝合。
端端吻合组:将锁骨上膈神经与隐神经移植物端端缝合,远端与下干后股端端缝合。
原位吻合组:在锁骨下切口切断下干后股,直接端端缝合修复。
未修复组:在锁骨下切口切断下干后股,不予以修复,断端埋入肌肉组织内。
冲洗后对皮缝合伤口,术后伤口涂苦味酸,防止互相舔伤口或撕咬。所有大鼠术前、术后均饲养在动物实验室,术后第7周予以荧光示踪及电生理检查,第8周灌注取材。
1.3 评价指标
1.3.1 大体功能观察
观察各组大鼠存活情况,行走步态,前肢活动情况,呼吸运动变化情况,肢体感觉异常导致的溃疡等。同时动态观察修复后肢体功能恢复情况以及恢复时间。
1.3.2 神经电生理检测
在取材前1周行电生理检查,大鼠腹腔注射戊巴比妥钠(1%,0.5 ml/100 g)麻醉,仰卧位固定至鼠板上。用Medtronic肌电诱发电位仪检测趾总伸肌、膈肌的复合肌肉动作电位(compound muscle action potential,CMAP)的潜伏期和最大波幅。检测中充分暴露大鼠双侧的膈神经、臂丛下干、趾总伸肌、膈肌。将膈神经(端侧吻合组、端端吻合组)和臂丛下干(原位吻合组、未修复组)与周围组织游离,用刺激电极挑起,再将接收电极分别插入趾总伸肌和膈肌(双侧的刺激电极和接收电极放置的部位相同),分别记录趾总伸肌和膈肌CMAP的潜伏期和最大波幅。
1.3.3 神经示踪检查
完成神经电生理检测后,显露大鼠端侧吻合组、端端吻合组右侧肘部桡神经深支、左侧锁骨下下干后股,原位吻合组、未修复组双侧桡神经深支,在此适当游离后切断备用。在微量器皿中加入2%荧光金混悬液,将已切断的神经近端浸泡于微量器皿中的荧光金混悬液30 min后生理盐水冲洗,对皮并4-0缝线缝合关闭伤口。术区涂苦味酸防止相互舔伤口或撕咬。
1周后再次行腹腔麻醉后用4℃4%多聚甲醛溶液继续灌注固定。切取C3~T1脊髓节段。标本放入4%的多聚甲醛溶液中后固定2 h后,依次转入4℃10%、20%、30%蔗糖溶液中过夜梯度脱水,包埋,在冰冻切片机内(-24℃)以20 μm厚度连续切片,在0.01 M磷酸缓冲液中漂片贴片,吸取周围多余液体,转荧光显微镜下观察、抓图后封片。
将连续切片置于Leica荧光显微镜(激发波长330~380 nm)下在放大40倍视野下观察切片,脊髓前角外侧核内荧光金逆向染色的神经元,荧光金呈黄色或黄白色,神经元胞浆内发光。使用配套的Leica QWin软件进行图像采集分析。根据每张切片内神经元数量及切片量计数脊髓节段神经元数量,予以定量,脊髓前角运动神经元直径约40 μm,故每隔2张切片计数一张,最终合计为神经元数量。
1.4 统计学方法
采用SPSS 19.0统计软件对数据进行统计分析。计量数据以±s表示,资料呈正态分布时,两组间比较单因素方差分析,两两比较采用LSD法;资料呈非正态分布时,采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 大体功能观察
端端吻合组大鼠术后均出现呼吸急促,端侧吻合组术后出现轻度呼吸急促,术后第3 d开始恢复正常呼吸。至灌注取材时直视下观察膈肌的运动情况,见端侧吻合组膈肌运动良好,端端吻合组右侧膈肌瘫痪,膈肌明显抬高。
所有大鼠均存活并完成各项指标的观察,在术后均出现相应的功能障碍,各组大鼠伸趾功能丧失,端侧吻合组、端端吻合组合并屈趾活动丧失,伸腕活动部分受限;原位吻合组、未修复组仅有伸趾活动受限,各组大鼠均出现手术侧的跛行,观察期间大鼠肢体未出现溃疡。
伸趾活动出现时间,原位吻合组为23~29 d,平均(25.33±2.25) d,端端吻合组为 29~35 d,平均(32.00±2.76) d,端侧吻合组为 31~39 d,平均(34.33±3.56)d,未修复组在最终随访结束前未出现伸趾活动。
2.2 神经电生理检测
电生理结果见表1,术后第7周,端侧吻合组、端端吻合组刺激膈神经在均可在伸趾总肌记录到CMAP,两组间CMAP的波幅、潜伏期差异均无统计学意义(P>0.05);原位吻合组刺激下干后股可在伸趾总肌记录到CMAP,其CMAP的波幅、潜伏期均显著优于端侧吻合组和端端吻合组(P<0.05)。端侧吻合组、原位吻合组、未修复组刺激膈肌均可在膈肌记录到CMAP,各组间比较波幅与潜伏期差异无统计学意义(P>0.05)。
表1 术后第7周四组大鼠CMAP检测结果(±s)与比较
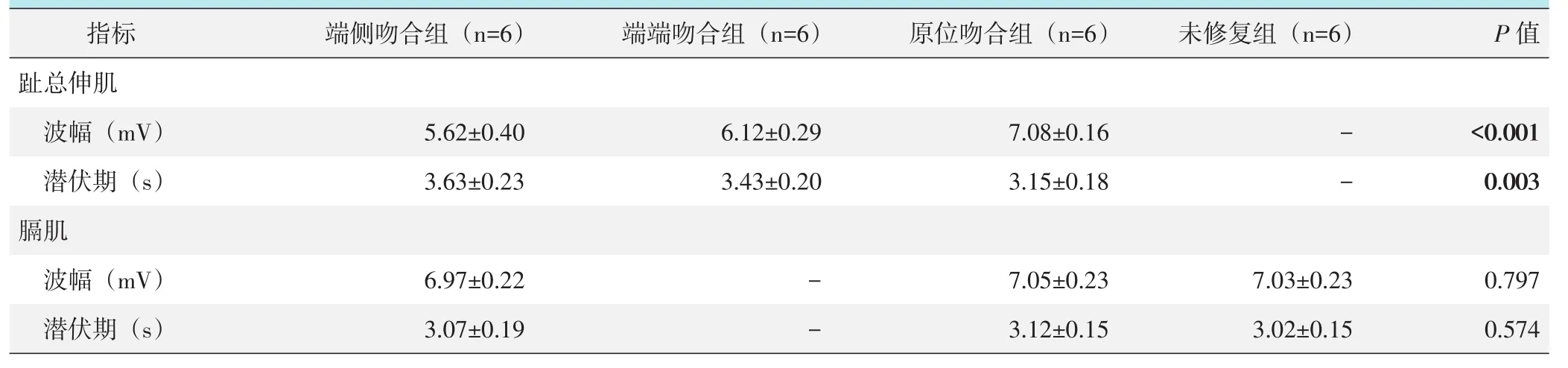
表1 术后第7周四组大鼠CMAP检测结果(±s)与比较
images/BZ_65_207_2797_551_2864.pngimages/BZ_65_551_2797_910_2864.pngimages/BZ_65_910_2797_1309_2864.pngimages/BZ_65_1309_2797_1695_2864.pngimages/BZ_65_1695_2797_2022_2864.pngimages/BZ_65_2022_2797_2274_2864.pngimages/BZ_65_207_2930_551_2996.pngimages/BZ_65_551_2930_910_2996.png3.63±0.23images/BZ_65_910_2930_1309_2996.png3.43±0.20images/BZ_65_1309_2930_1695_2996.png3.15±0.18images/BZ_65_1695_2930_2022_2996.png -images/BZ_65_2022_2930_2274_2996.png0.003images/BZ_65_207_3062_551_3128.pngimages/BZ_65_551_3062_910_3128.pngimages/BZ_65_910_3062_1309_3128.pngimages/BZ_65_1309_3062_1695_3128.pngimages/BZ_65_1695_3062_2022_3128.pngimages/BZ_65_2022_3062_2274_3128.pngimages/BZ_65_207_3194_551_3260.png趾总伸肌潜伏期(s)波幅(mV)images/BZ_65_551_3194_910_3260.png6.97±0.22images/BZ_65_910_3194_1309_3260.png- images/BZ_65_1309_3194_1695_3260.png7.05±0.23images/BZ_65_1695_3194_2022_3260.png7.03±0.23images/BZ_65_2022_3194_2274_3260.png0.797
2.3 神经示踪检查
神经示踪检测结果见表2、图2。端侧吻合组、端端吻合组手术侧桡神经深支示踪后均可在C3/4脊髓节段前角发现阳性细胞,端端吻合组阳性细胞数量显著多于端侧吻合组(P<0.05)。原位吻合组损伤侧桡神经深支示踪至C8T1脊髓节段前角阳性细胞数量显著多于端侧吻合组、端端吻合组示踪至损伤侧C3/4脊髓节段的数量(P<0.05)。端侧吻合组、端端吻合组未损伤侧下干后股示踪至C8T1脊髓节段前角的阳性细胞数量显著多于原位吻合组、未修复组(P<0.05)。
表2 四组大鼠神经示踪染色阳性细胞计数结果(±s)与比较

表2 四组大鼠神经示踪染色阳性细胞计数结果(±s)与比较
images/BZ_66_207_738_551_804.pngimages/BZ_66_551_738_910_804.pngimages/BZ_66_910_738_1309_804.pngimages/BZ_66_1309_738_1695_804.pngimages/BZ_66_1695_738_2022_804.pngimages/BZ_66_2022_738_2274_804.pngimages/BZ_66_207_870_551_937.png损伤侧C3/4前角未损伤侧C8T1前角images/BZ_66_551_870_910_937.png118.17±17.51 433.33±39.83images/BZ_66_910_870_1309_937.png144.33±17.50 434.50±42.36images/BZ_66_1309_870_1695_937.png-223.82±39.48images/BZ_66_1695_870_2022_937.png- images/BZ_66_2022_870_2274_937.png221.17±37.77 0.027<0.001

图2 四组动物双侧脊髓前角神经荧光示踪阳性神经元观察(×40) 2a:端侧吻合组C3/4前角示踪阳性细胞:损伤侧可见阳性神经元 2b:端端吻合组C3/4前角示踪阳性细胞:损伤侧可见阳性神经元 2c:原位吻合组C8T1前角示踪阳性细胞:损伤侧、未损伤侧均可见阳性神经元 2d:未修复组C8T1前角示踪阳性细胞:未损伤侧可见阳性神经元
3 讨论
臂丛神经损伤是最严重的周围神经损伤[10],也是周围神经研究领域中的重点和难点。随着显微外科技术的发展,多种神经移位术运用到臂丛神经的修复,目前全臂丛根性撕脱伤患者的肩肘功能和屈腕指功能能够得到部分的恢复[11~14],但伸指功能的治疗疗效仍然很差,使得患者手部功能恢复仍然遥遥无期。笔者认为手的抓握功能的前提是伸指,有很多神经移位手术修复臂丛、桡神经未能获得较好的伸指功能的恢复[15,16],考虑原因有神经纤维错配以及神经纤维数量不够,针对神经纤维错配,顾玉东等[17]先期通过显微解剖学研究,明确了桡神经前臂束组(即桡神经支配伸腕指功能的纤维束组)在桡神经主干中的定位。并且结合膈神经端端移位的研究成果,在动物实验和部分临床病例中已经证实此方法可以选择性地恢复患者的伸腕指功能[17~19]。然而虽在尸体解剖实验来看可将桡神经深、浅支分离开来,但是在临床上分离难度大,易损伤神经纤维,而且长段神经游离可能导致神经缺血及瘢痕粘连。本研究旨在不分离桡神经深浅支,在臂丛根、干、股、束部位精确定位伸指纤维的来源,从而定向恢复伸指功能,避免错配。而对于供体神经数量不足的情况,早在100年前,就出现了神经端侧缝合的概念[20],即保留供体神经原有功能的基础上,产生额外的神经纤维生长入受体神经。
作者同样认为膈神经是最优选择,而端侧缝合逐渐成为神经修复研究热点[21~23],修复可保留供体神经的前提下修复受体神经[24]。同时进行膈神经端端及端侧缝合观察其伸趾功能恢复情况,两组大鼠均有伸趾功能恢复,但端侧缝合恢复时间较端端缝合晚,在荧光示踪实验中相应脊髓节段前角阳性神经元来看,端端缝合组阳性神经元数量较端侧缝合组多,而原位吻合组可在实验侧C8T1脊髓节段可观察到阳性神经元,且神经元数量高于端侧吻合组及端端吻合组,这说明下干后股直接修复优于神经移植+移位。本研究同时发现正常侧桡神经深支示踪至C8T1脊髓节段阳性神经移数量较正常侧下干后股示踪至C8T1节段阳性神经元数量少,这可能是下干后股除包含桡神经深支以外还包含伸腕及伸肘分支的可能,这与杨剑云等[25]在动物实验中发现膈神经断端移位下干后股可恢复部分伸趾功能,但同时也可恢复部分伸腕及伸肘功能的结果一致,同时该研究也用逆向示踪技术发现下干后股示踪一侧脊髓前角阳性神经元数量明显多于桡神经深支一侧。
电生理检查发现观察结束时间点端端吻合组膈神经完全支配下干后股至桡神经深支,而端侧吻合组膈神经仅部分支配下干后股至桡神经深支,即端端缝合功能出现早且波幅较端侧缝合高,这与既往研究结果相符合[15,24,25],将观察随访时间适当延长可能端侧吻合组端侧缝合组也可得到较好的CMAP波幅。端侧吻合组除了伸趾总肌外在膈肌也可记录到CMAP,且端侧吻组、原位吻合组、未修复组间膈肌CMAP潜伏期与波幅比较无明显差异,这从解剖上证实膈肌运动功能保留良好,如果能通过大鼠呼吸功能检查结果来说明供体膈神经功能被保留将更有说服力。
综上所述,膈神经通过神经移植端端、端侧修复下干后股均可恢复伸趾功能,端侧修复可保留膈神经原有的功能,但有部分动力神经去向伸腕、伸肘功能,如何精确修复伸趾功能还有待进一步研究。

