循环Metrnl 与糖尿病心肌病的关系及相关分子机制
张 敏,丁瑞麟,江 凤,彭 清,王小洁
(西南医科大学附属医院1.心血管内科,2.GCP,3.内分泌科,四川 泸州 646000)
随着社会经济的发展,2 型糖尿病已逐渐成为全球性、流行性疾病。据估计,到2030 年,全球糖尿病患者总人数预计将从2000 年的1.71 亿上升至3.66 亿,随着糖尿病患者人数的增加,相关并发症也将随之增加[1]。心血管疾病是2 型糖尿病的主要并发症及死因之一,糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的一种独特的心脏病,其标志之一是心肌糖脂代谢受损[2]。但发病机制尚不明确,有研究报道心肌能量代谢紊乱与核受体转录因子超家族(PPARs)、葡萄糖共转运体4(GLUT4)通路有关[3]。
Metrnl 是新近发现的脂肪因子,多项研究证明,Metrnl 可调节血糖、改善胰岛素敏感性及脂质代谢[4-6]。目 前 尚 缺 乏 关 于Metrnl 与DCM 相 关 的 研究,为此,本文基于Metrnl 在代谢性疾病中的重要作用,探讨其与DCM、PPARs 和GLUT4 的关系。
1 材料与方法
1.1 材料
健 康 雄 性C57BJ/6L 小 鼠,SPF 级4 周 龄,15只,约16 g/只,购自北京华阜康生物公司[SYXK(川)2018-119];所有操作遵循西南医科大学动物实验操作规范,实验期间小鼠可自由取食和饮水。小鼠普通饲料购自成都达硕公司;60%高脂饲料购自深圳市拓普生物公司(D12492);链脲佐菌素购自深圳百泰克公司(BS185-100 mg);小鼠Metrnl ELISA试剂盒购自广州康凯信生物(AD2238Mo);重组Metrnl 购自AtaGenix 公司(AP73998);DHE 染色试剂盒购自凯基生物;PPAR-δ 抗体由Abcam 公司提供;PPAR-α、GLUT4 抗体、BCA 蛋白浓度测定试剂盒购自ASPEN 公司;cDNA 合成试剂盒、PCR 反应试剂盒购自ELK Biotechnology。
1.2 方法
1.2.1 DCM 模型建立及血清Metrnl 浓度测定 15只健康雄性(C57BJ/6L)小鼠随机分为实验组(DCM+Metrnl,n=5)、模型组(DCM,n=5)和对照 组(Control,n=5)。 将 小 鼠 置 于(22±2)°C、(55±10)%湿度、12 h 明暗循环条件下适应1 周,实验组和模型组用高脂饮食联合链脲佐菌素(STZ)法建立DCM 模型,STZ 给药后1 周,连续2 次检测空腹血糖(FBG)大于11.1 mmol/L 视为糖尿病造模成功[4]。造模成功后继续喂养16 周。取小鼠尾静脉测定血清Metrnl 浓度,该过程严格按照Metrnl 商业试剂盒说明进行。
1.2.2 重组Metrnl 处理及血脂浓度测定 实验组予以重组Metrnl(5 μg/只)干预,模型组及对照组给予等体积溶剂,连续干预7d。取小鼠内眦静脉血,严格按照生化试剂盒说明检测各组小鼠血脂浓度。
1.2.3 H & E、Masson、DHE 染色观察心肌组织病理变化及活性氧产生情况 称取小鼠体质量并将其处死,迅速取出心脏,反复清洗,称取心脏重量,取心室组织行常规固定并制作冰冻切片,H & E、Masson 染色,普通光学显微镜下观察。按照DHE试剂盒说明进行细胞内活性氧检测,最后于荧光显微镜下观察细胞内活性氧产生情况。
1.2.4 Westrn-blot 检 测PPAR- α、PPAR- β/δ 及GLUT4 表达情况 取适量心肌组织,经研磨后加入细胞裂解液提取蛋白,利用BCA 法测定总蛋白浓度。制胶、上样,SDS-PAGE 电泳后,转模至PVDF膜,4 ℃条 件 下,加 入 一 抗(PPAR-α、PPAR-β/δ、GLUT4 抗体)过夜,次日加入二抗于室温孵育30 min;孵育后洗膜、曝光、显影。使用AlphaEaseFC软件对目的条带灰度值进行分析。
1.2.5 PCR 检测CD36、SOD基因表达 从心肌组织分离总RNA,并合成cDNA(EQ002)。PCR 反应程序如下:在95 ℃预变性1 min 激活酶后,进行40次PCR 循环(95 ℃条件下变性15 s,58 ℃条件下退火20 s,72 ℃条件下延伸45 s),最后在60 ℃条件下延长,每20 秒升温1 ℃,直至温度上升至95 ℃。引物参数详见表1。
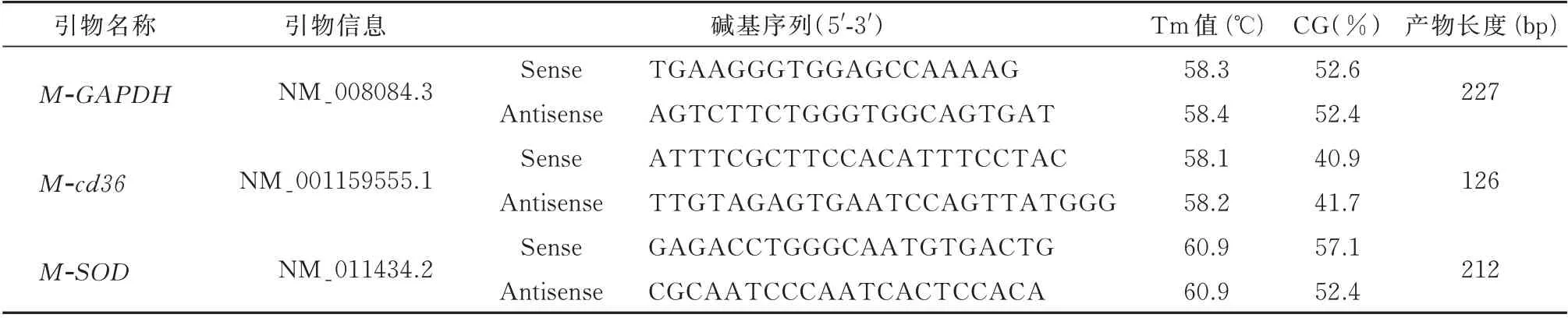
表1 引物序列Tab 1 Primer sequence
1.3 统计学处理
采用SPSS 26.0 统计软件对数据进行分析。经检验,所有计量资料符合正态分布,用±s 表示,多组间比较用单因素方差分析比较,两组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠摄食量、体重、血糖及心脏/体重比值变化
高脂饮食喂养8 周后,实验组和模型组体质量较对照组显著增加(tDCM+Metrnl=4.04,P<0.05;tDCM=3.828,P<0.05)。造 模 成 功 后,DCM+Metrnl 和DCM 组小鼠出现多饮、多食、多尿,活动量明显减少。与对照组相比,DCM+Metrnl 和DCM 组血糖显著升高(tDCM+Metrnl=10.862,P<0.05;tDCM=7.698,P<0.05)。DCM 组、DCM+Metrnl 组和对 照组的心体质量比无显著差异(F=3.743,P=0.078)(表2),DCM+Metrnl 组给予重组Metrnl 后血糖降低,但和给药前比较,差异无统计学意义(t=1.002,P>0.05)。
表2 各组小鼠体重、血糖及心脏/体重比值变化(±s)Tab 2 Changes of body weight,blood glucose and heart/body weight ratio in each group(±s)
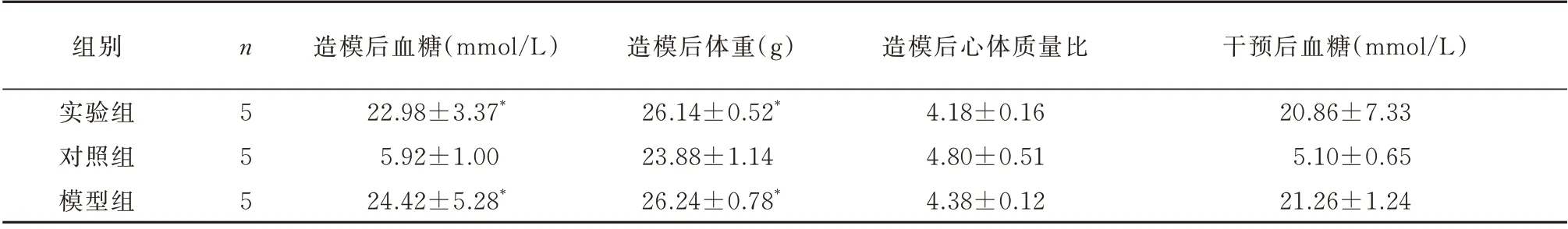
表2 各组小鼠体重、血糖及心脏/体重比值变化(±s)Tab 2 Changes of body weight,blood glucose and heart/body weight ratio in each group(±s)
注:与对照组比较,*P<0.05。心体质量比Metrnl+DCM 中n=4,Control 和DCM 组n=3,心脏取材时损毁;余如表所示。
组别造模后心体质量比干预后血糖(mmol/L)20.86±7.33 5.10±0.65 21.26±1.24实验组对照组模型组n5 5 5造模后血糖(mmol/L)22.98±3.37*5.92±1.00 24.42±5.28*造模后体重(g)26.14±0.52*23.88±1.14 26.24±0.78*4.18±0.16 4.80±0.51 4.38±0.12
2.2 各组小鼠血清Metrnl 浓度变化
重组Metrnl 干预前,与对照组相比,模型组小鼠血液中Metrnl 浓度降低,实验组小鼠血液中Metrnl 浓度升高,实验组小鼠血液中Metrnl 浓度较模型组升高,但差异均无统计学意义(P>0.05)(图1)。
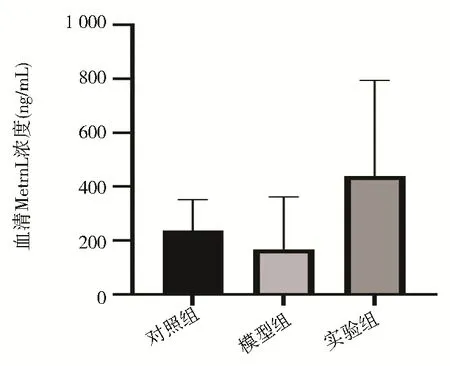
图1 各组干预后血清Metrnl 浓度比较Fig 1 Comparison of serum concentration of Metrnl in the three groups
2.3 各组小鼠血脂变化
与对照组相比,模型组血清总胆固醇(t=5.378,P=0.006)、甘油三酯(t=9.376,P<0.001)、低密度脂蛋白胆固醇(t=13.738,P<0.001)显著升高,高密度脂蛋白胆固醇(t=4.786,P=0.009)显著降低。与模型组比较,实验组血清总胆固醇(t=-3.67,P=0.014)、甘油三酯(t=-6.827,P<0.001)和低密度脂蛋白胆固醇(t=-7.969,P<0.001)浓度降低,高密度脂蛋白胆固醇(t=3.565,P=0.016)浓度升高,差异均有统计学意义。与对照组相比,实验组的高密度脂蛋白胆固醇降低(t=-2.229,P=0.076),甘油三酯(t=2.028,P=0.098)、低密度脂蛋白胆固醇(t=2.446,P=0.058)和总胆固醇(t=2.577,P=0.05)均升高,但差异无统计学意义(表3)。
表3 各组小鼠血脂变化(mmol/L,±s)Tab 3 Blood lipid changes in each group(mmol/L,±s)
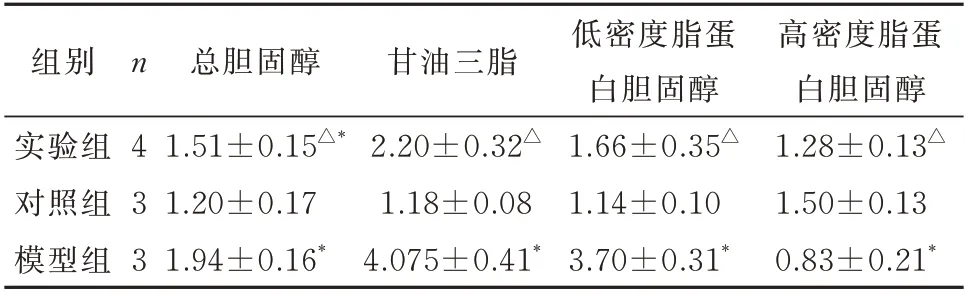
表3 各组小鼠血脂变化(mmol/L,±s)Tab 3 Blood lipid changes in each group(mmol/L,±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
组别实验组对照组模型组高密度脂蛋白胆固醇1.28±0.13△1.50±0.13 0.83±0.21*n4 3 3总胆固醇1.51±0.15△*1.20±0.17 1.94±0.16*甘油三脂2.20±0.32△1.18±0.08 4.075±0.41*低密度脂蛋白胆固醇1.66±0.35△1.14±0.10 3.70±0.31*
2.4 各组小鼠心肌组织病理改变及活性氧(ROS)产生情况
对照组心肌纤维排列整齐,细胞结构清晰,细胞核均一;模型组心肌纤维排列紊乱、稀疏,心肌细胞肥大变性,细胞核大小不一,心肌间蓝染的胶原纤维增加;实验组心肌细胞肥大及胶原排列紊乱得到改善,心肌间蓝染的胶原纤维较少。红色荧光为细胞内活性氧产生量。与对照组相比,实验组与模型组心肌细胞内活性氧产生量增加;与模型组相比,实验组心肌细胞内活性氧产生量较少(图2)。

图2 各组小鼠心肌组织病理改变及活性氧产生情况(×400)Fig 2 Pathological changes of myocardial tissue and production of reactive oxygen species in each group(×400)
2.5 各组小鼠PPAR-α、PPAR-β/δ、GLUT4 蛋白表达情况
与对照组相比,模型组PPAR-α(t=5.255,P=0.006)、PPAR-β/δ(t=3.915,P=0.017)、GLUT4(t=-9.374,P<0.001)蛋白表达显著降低,差异有统计学意义。实验组PPAR-α(t=2.858,P=0.046)、PPAR- β/δ(t=2.796,P=0.049)和GLUT4(t=3.148,P=0.035)蛋白表达量均高于模型组(P<0.05)(表4)。与对照组相比,实验组PPAR-α(t=3.424,P=0.027)、PPAR-β/δ(t=1.72,P=0.161)、GLUT4(t=3.681,P<0.021)蛋白表达降低。
表4 各组小鼠PPAR-α、PPAR-β/δ、GLUT4 蛋白表达相对量(±s)Tab 4 Relative expression levels of PPAR-α,PPAR-β/δ and GLUT4 in each group(±s)
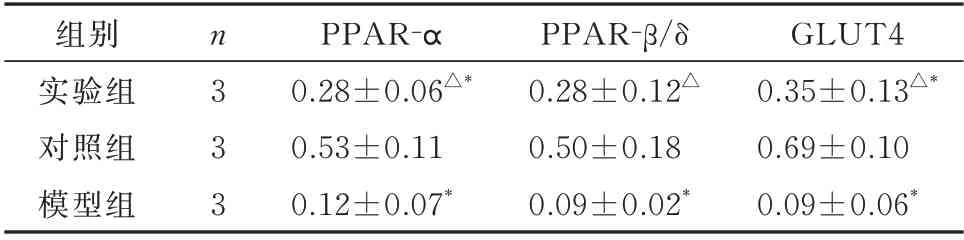
表4 各组小鼠PPAR-α、PPAR-β/δ、GLUT4 蛋白表达相对量(±s)Tab 4 Relative expression levels of PPAR-α,PPAR-β/δ and GLUT4 in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
组别实验组对照组模型组GLUT4 0.35±0.13△*0.69±0.10 0.09±0.06*n3 3 3 PPAR-α 0.28±0.06△*0.53±0.11 0.12±0.07*PPAR-β/δ 0.28±0.12△0.50±0.18 0.09±0.02*
2.6 各组小鼠CD36、SOD 基因表达情况
与对照组相比,模型组心肌细胞中CD36表达升高(t=20.496,P<0.001),差异有统计学意义;CD36表达在实验组降低,但差异无统计学意义(t=0.357,P=0.739);与模型组相比,实验组心肌细胞中CD36表达降低(t=17.808,P<0.001)。与对照组相比,模型组心肌细胞中SOD表达降低(t=16.48,P<0.001),在实验组升高(t=-16.076,P<0.001);实验组心肌细胞中SOD表达高于模型组,差异有统计学意义(t=21.42,P<0.001)(表5)。
表5 各组小鼠CD36、SOD 基因表达(±s)Tab 5 Expression of CD36 and SOD gene in each group(±s)
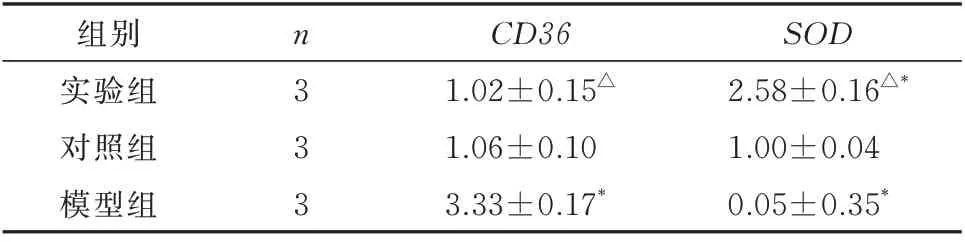
表5 各组小鼠CD36、SOD 基因表达(±s)Tab 5 Expression of CD36 and SOD gene in each group(±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
组别实验组对照组模型组SOD 2.58±0.16△*1.00±0.04 0.05±0.35*n3 3 3 CD36 1.02±0.15△1.06±0.10 3.33±0.17*
3 讨论
DCM 已成为全球性流行性疾病,目前尚缺乏特定治疗方法。越来越多的研究关注新型靶向抗氧化途径,以期为DCM 治疗找到新的方法。
Metrnl 是新近发现的脂肪因子,在人和啮齿动物多器官组织中表达(包括皮下脂肪组织、骨骼肌、心肌、胃肠道等),具有促进白色脂肪组织褐变、增加机体能量消耗、胰岛素增敏、拮抗炎症等作用[5-8]。外界给药(静脉注射或口服)可降低肥胖小鼠的体重、血糖水平改善胰岛素抵抗[5];在非肥胖小鼠中,Metrnl 可 延 缓 糖 尿 病 的 发 生[9];组 织 特 异 性 敲 除Metrnl 后,将加重由高脂饮食诱导的胰岛素抵抗,补充Metrnl 则可完全改善胰岛素抵抗[10]。因此,Metrnl 在代谢性疾病的治疗中具有广阔前景。目前,Metrnl 在血清中的浓度变化尚存在争议。
本研究发现,糖尿病心肌病小鼠与正常小鼠血清中Metrnl 浓度无显著差异。这与近期发表的荟萃分析[11]结果一致。重组Metrnl 给药后,实验组血清低密度脂蛋白胆固醇、总胆固醇、甘油三脂浓度较模型组降低,血清HDL-C 浓度较DCM 组升高,提示Metrnl 能改善小鼠血脂代谢。此外,给药重组Metrnl 后,实验组组小鼠心肌细胞紊乱、稀疏和细胞肥大得到明显改善,心肌间胶原纤维明显减少。Metrnl 对DCM 具有有益作用。
健康的心脏由70%脂肪酸和30%葡萄糖提供能量[12]。高糖等条件下,心肌能量底物几乎由葡萄糖及脂肪酸转变为脂肪酸,心肌细胞内产生更多活性氧,最终导致心肌细胞凋亡及脂质积累[12-14]。PPARs 为核受体转录因子超家族,包括3 个亚型,分别为PPAR-α、PPAR-β/δ、PPAR-γ,在脂质代谢中发挥重要调节作用[15]。PPARs、GLUT4 是心肌摄取及利用脂质及葡萄糖的重要信号通路。Metrnl可通过调节PPAR-γ、GLUT4 等改善脂肪细胞功能及骨骼肌摄取葡萄糖的能力,从而改善机体胰岛素敏感性[10,16,17]。此外,Metrnl 还可调节PPAR-δ 改善骨骼肌炎症,提高骨骼肌葡萄糖耐量[18]。本研究证明Metrnl 可上调GLUT4、PPAR-β/δ,同时下调脂肪酸转运因子CD36基因表达,对心肌糖脂代谢进行调控。且给药后的心肌细胞排列紊乱、稀疏及细胞肥大得到改善,心肌细胞间胶原纤维减少。因此,Metrnl 可能对心肌能量代谢有积极作用。
研究报道,PPAR-α 高表达的心肌表型与糖尿病心肌病极为相似,且PPAR-α 在糖尿病心肌病心肌中表达上调[19]。PPAR-α 是心肌摄取利用脂肪酸的关键调节因子,可能参与抑制心肌GLUT4 的表达,而GLUT4 是葡萄糖进入心肌细胞的主要运输工具[19]。本研究中,DCM 组心肌细胞中PPAR-α 表达降低,给药重组Metrnl 后,实验组PPAR-α 表达水平较模型组升高,而其表达水平低于对照组。由于PPAR-α 在心肌中的表达是一把“双刃剑”,其高表达或低表达对心肌均有不利影响。由此可见,Metrnl 在一定程度上可维持PPAR-α 的表达平衡。Ruperez 等[20]指 出,Metrnl 受PPAR-α 调 控(可 上 调Metrnl 表达),且在其调控下,Metrnl 可诱导脂肪酸氧化、选择性激活M2 巨噬细胞的基因程序,逆转心肌肥厚。与DCM 组相比,DCM+Metrnl 组心肌细胞PPAR-α 表达增加,但较对照组降低,表明Metrnl与PPAR-α 之间可能存在某种反馈调节机制,有待进一步研究验证。
能量底物的改变,可导致心肌细胞中活性氧(ROS)增多,导致更多的细胞凋亡。有研究证明,在心肌中,PPAR-β/δ 对糖及脂质代谢的调节作用与PPAR-α 相反,可能成为改善心肌能量代谢的靶点[3]。 Metrnl 可 调 节 心 肌 能 量 底 物 调 控 蛋 白(PPAR-β/δ、GLUT4)及相关基因(CD36)的表达,同时上调抗氧化蛋白SOD(包括SOD2,主要位于线粒体内膜,具有高效去除活性氧的能力)、CAT 抗氧化酶,抑制活性氧产生[7]。本研究进一步佐证了该结论,给药重组Metrnl 后,心肌中GLUT4、PPAR-δ 表 达 上 调,细 胞 内ROS 明 显 减 少,SOD 蛋白基因表达增加。因此,Metrnl 可减轻心肌氧化应激损伤,对心肌具有双重保护作用。
由于DCM 模型的特殊性以及受实验条件等限制,本实验样本量相对较少,且尚未对小鼠心功能参数进行测定,未进一步评估Metrnl 对DCM 小鼠心功能的影响;此外未进行体外研究证实Metrnl 对PPAR-α、GLUT4、PPAR-β/δ 具有 靶向调控 作用,这需在今后的研究中进行探讨。
总之,Metrnl 可以改善糖尿病心肌病小鼠的心肌病理改变及脂质代谢。通过PPAR-β/δ、GLUT4通路降低心肌氧化应激损伤。Metrnl 与PPAR-α 之间是否存在反馈调节机制,需在今后的研究中加以验证。
作者贡献度说明:
张敏:参与课题设计、实验动物饲养、相关指标检测及论文写作;丁瑞麟:参与课题设计指导,文章修改;江凤:参与课题设计,文章审校;彭清:参与课题设计及文章审校;王小洁:参与文章修改。

