基于核心素养下的高中化学反应动力学与热力学问题探究
——化学反应速率与平衡问题拆分、探究
浙江 孙鹏辉
在浙江化学选考试题中,经常会出现化学反应图像变化原因分析的题,这是令学生比较头疼的问题,那么究竟应该如何应对,本文着重于探究这类题型,笔者经过分析、比对,发现大部分题目实际上都在探讨两个问题:动力学、热力学问题。
一、什么是化学动力学、化学热力学
化学动力学是研究化学过程进行的速率和反应机理的物理化学分支学科,是从一种动态的角度观察化学反应,研究反应系统转变所需要的时间,以及这之中涉及的微观过程。
化学热力学是物理化学和热力学的一个分支学科,它主要研究物质系统在各种条件下的物理和化学变化中所伴随着的能量变化,从而对化学反应的方向和进行的程度作出准确的判断。
说通俗一点,化学动力学探究的是化学反应速率问题,而化学热力学探究的是化学反应限度即化学平衡问题。
二、化学反应速率与平衡问题拆分、探究
1.化学动力学下的问题探究
【例1】(2017·浙江11月选考·30节选)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:


ΔH1>ΔH2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系如图1所示。

图1
x1显著低于x2的原因是____________。
【答案】反应2的活化能比反应1小,相同温度下反应2更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故x1显著低于x2
【解析】首先观察图像,图像的横坐标是时间,纵坐标是产率,x1与x2的高低代表的是相同时间内产生C10H12和C10H8的物质的量的多少,很显然这是一个速率问题,而速率与反应的活化能大小有关,所以可以考虑反应2的活化能比反应1小,相同温度下反应2更快,相同时间内,反应1生成的四氢萘大部分都转化为反应2的萘,故x1显著低于x2。
这道题是从对图像的解读入手,基于客观事实,由反应的活化能大小推出化学反应速率快慢,但并没有外界条件的改变,未涉及影响化学反应速率快慢的因素,这类探讨在2020年浙江1月份的选考中有所体现。
【例2】(2020·浙江1月选考·22)在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图2所示。下列说法正确的是( )

图2
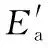
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
【答案】D
本题探讨的是温度改变对正、逆反应瞬时速率的影响大小问题(如图3),吸热反应的速率受温度影响更大,如果从反应活化能的角度进行阐述,可以认为活化能更大的反应,其速率受温度变化影响更大。学生如果把这个问题理解到位,那么2021年浙江1月选考这道区分度较大的题就能迎刃而解了。
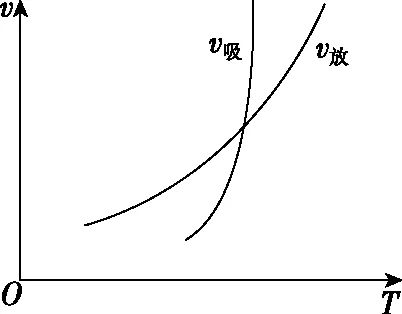
图3
【例3】(2021·浙江1月选考·29节选)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是________。
A.适当提高反应温度
B.改变催化剂
C.适当降低反应温度
D.改变反应物浓度
【答案】AB
【解析】本题讨论的是影响产物选择性的因素问题。
A项、C项,温度影响产物选择性问题可以是速率问题,也可以是平衡问题。由于题目中出现了关键词“30 min”且两产物浓度之比与反应时间无关,故考虑是速率问题。再由题目信息可知,转化为邻二氯苯的反应活化能更大,结合“活化能更大的反应,其速率受温度变化影响更大”这个结论,得出A符合题意;B项,可以使用对生成邻二氯苯有更高选择性的催化剂,以提高产物中邻二氯苯的比例,催化剂影响选择性的问题只能是速率问题,B符合题意;D项,改变反应物浓度可以改变化学反应速率,从而改变反应达到化学平衡状态的时间,但是产物浓度之比与反应时间无关,因此,改变反应物浓度不能提高产物中邻二氯苯的比例,D不符合题意。
化学动力学问题即为化学反应速率问题,而影响化学反应速率的因素有很多,包括浓度、温度、压强、催化剂等,教师要依据证据推理和分析,建立与结论的逻辑关系,依据结果,寻找关键词(一定时间),注重归纳总结,得出更深层次的解题模型。
2.化学热力学下的问题探究
【例4】(2019·江苏卷·20节选)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:


在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图4所示。
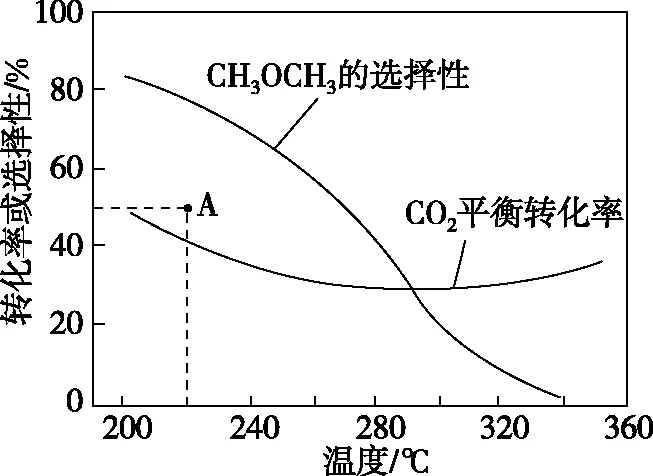
图4

温度高于300℃,CO2平衡转化率随温度升高而上升的原因是_____________。
【答案及解析】图像纵坐标是平衡转化率或选择性,横坐标是温度,探讨的是平衡量随温度的变化影响,所以此题是平衡问题。当温度高于300℃时,CO2的平衡转化率增大,而CH3OCH3的选择性降低,即此温度下主要发生的是反应Ⅰ,因反应Ⅰ是吸热反应,当温度升高CO2转化为CO的平衡转化率上升;而反应Ⅱ是放热反应,当温度升高CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。
【例5】二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。CO2和H2在铁系催化剂作用下发生化学反应:


在密闭容器中通入1 mol CO2和3 mol H2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图5所示。
在图5中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因____________。
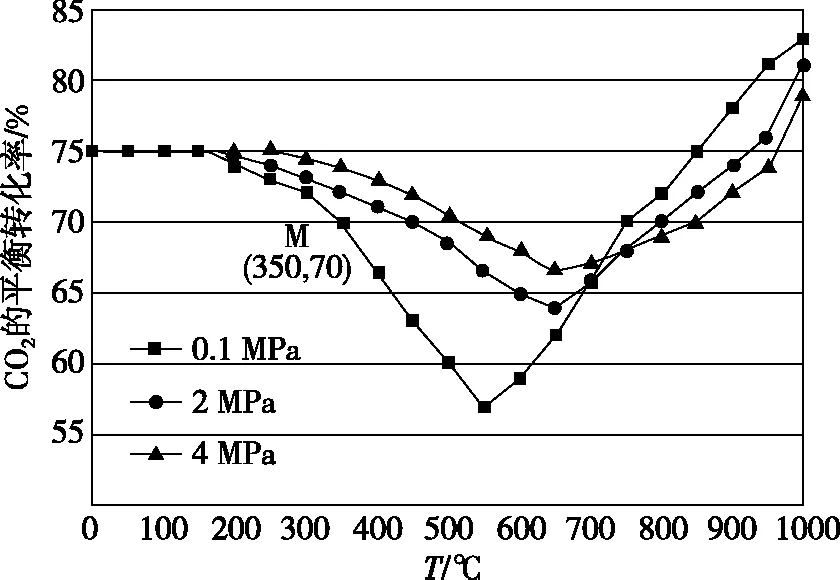
图5
【答案】温度高于800℃时,以反应Ⅱ为主,压强增大,平衡不移动。但压强增大,使反应Ⅰ平衡正移,水蒸气浓度增大,CO2和H2浓度减小,从而导致反应Ⅱ平衡逆移,所以CO2的平衡转化率减小。
【解析】本题有两个变量(温度、压强),纵坐标为CO2的平衡转化率,所以应该从平衡角度分析,先取其中一条曲线的图像变化趋势得出前半段以反应Ⅰ为主,后半段以反应Ⅱ为主,再讨论压强对反应的影响。
化学热力学问题,即平衡移动问题,旨在考查学生“变化观念与平衡思想”的学科核心素养,使学生能多角度、动态地分析化学变化,运用化学反应原理解决实际问题。
3.化学动力学、热力学综合问题探究

A.相同条件下,催化剂2比催化剂1的效率高
B.在A点时,反应一定未达到平衡
C.C点时,两种催化剂下反应速率相同,用水蒸气表示速率为v(H2O)=0.02 mol·L-1·min-1
D.增大压强对该反应的速率无影响
【答案】B
本题旨在考查A、B、C三点是不是平衡点的问题。图像横坐标为温度,纵坐标为转化率,题目中出现了关键字眼“10 min”,但A、C并不是平衡点,因为催化剂不会影响平衡移动,否则不可能在T3温度CO转化率达到B点,A到C变化的原因为催化剂活性下降,这属于动力学问题;B点可能为平衡点,也可能不是平衡点,因为B点之后的变化依然可能是由于催化剂活性下降或者T3温度高了,反应速率加快,在相同的时间内反应已经平衡,之后升高温度,平衡逆移,CO转化率下降,所以这可能是动力学问题,也可能是热力学问题。
【例7】(2020·浙江1月选考·29节选)研究NOx之间的转化具有重要意义。

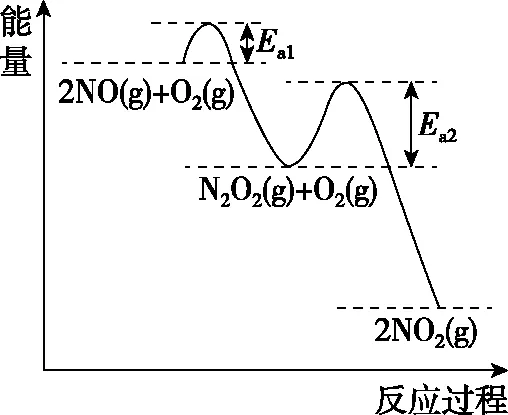
图7

在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图8所示。转化相同量的NO,在温度________(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图7)分析其原因:
。
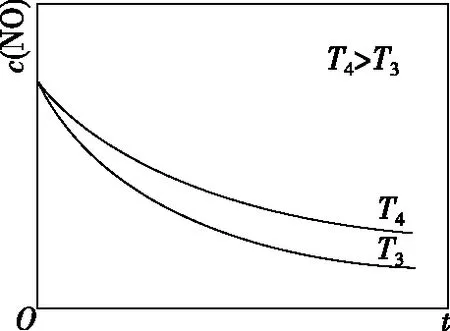
图8
【答案】T4ΔH1<0,温度升高,反应Ⅰ平衡逆移,c(N2O2)减小;浓度降低的影响大于温度对反应Ⅱ速率的影响
本题旨在讨论为什么温度越高反应速率越慢。看似动力学问题,实质包含了热力学问题。反应分两步进行,决速步为反应Ⅱ,影响反应Ⅱ的速率有两个因素:①温度越高,反应速率越快;②温度越高,反应Ⅰ平衡逆移导致c(N2O2)减小,反应速率减慢。根据图像可知②的影响更大。
三、总结
综上所述,反应图像变化的原因可能是动力学问题、热力学问题,或者两者的综合影响问题。化学动力学问题即速率问题,考查方式可以是微观解释速率变化的原因或通过证据推理推出速率变化的趋势,这里可能涉及催化剂、温度、压强、浓度等因素。但其中有些因素也会影响平衡移动。那么学生如何判断是不是化学动力学问题,关键在于观察图像变化趋势(有没有转折点)或题干信息中有没有关键词“一定时间内”“相同时间内”……当然,这也不绝对,有时即使有这些关键词,也有可能前半段是动力学问题,后半段是化学热力学问题,即化学平衡问题(如例6),这就要求学生能通过图像的变化寻找矛盾点、变化点,勇于想象,敢于分析,寻找图像更深层次的意义。

