基于核心素养下的“氯气等有毒气体的制备与性质探究”实验设计
黑龙江 栾厚福
高中化学教学中常涉及Cl2、SO2等有毒气体的制备与性质探究,考虑到实验的安全隐患、学校实验条件和实验耗费时间长等因素,在实际教学中真正做实验演示的教师并不多,能进行分组实验的学校更少。很多学校都是通过让学生观看实验视频或教师讲授实验,以完成相关知识教学。这部分知识是教学的重点,从学生练习和考试结果反馈来看,只讲解实验部分的相关知识而不让学生动手去做,最终效果不是很好。为了达到良好的教学效果,教师须结合现有条件和在保证实验安全的前提下,让学生真正去做实验,只有让学生身临其境,才能让学生学会合作探究,体验实验成功的乐趣,才能渗透科学探究与创新意识的学科核心素养。
为了增强实验教学效果,笔者查阅了教师用书等相关资料,设计了如图1所示实验装置,有毒气体无法逸出,实验安全性高,同时可以指导学生完成氯气等有毒气体的制备与性质探究的分组实验。
一、实验方案的设计思路
【实验装置】笔者设计如图1所示实验装置(夹持仪器已省略),用于Cl2的制备、收集与性质探究和尾气处理等,同时该装置具有“一装置多用”的功能。
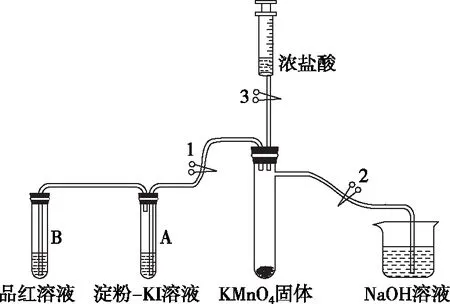
图1
【实验器材】(1)仪器:具支试管(1支)、试管(10 mL,2支)、双孔塞(2个)、单孔塞(1个)、注射器(20 mL,2支)、烧杯(100 mL,1个)、止水夹(3个)、橡胶管等;
(2)药品:KMnO4固体、浓盐酸、淀粉-KI溶液、品红溶液、NaOH溶液。
【设计思路】实验时关闭止水夹2,打开止水夹1、3,向KMnO4中滴加少量浓盐酸制备Cl2,待试管A中出现蓝色、试管B中红色褪去后,关闭止水夹1,用注射器收集Cl2备用以探究其性质,关闭止水夹3,并连接另一支注射器,打开止水夹2、3,抽动注射器活塞,使NaOH溶液进入具支试管中,并轻轻摇动具支试管,进行尾气处理。


Cl2使品红溶液褪色:Cl2与H2O生成的HClO具有漂白性

二、氯气的制备与性质探究
1.实验前准备工作
按图1所示装置,连接实验仪器,并检验装置的气密性。如关闭止水夹2,打开止水夹3、1,推拉注射器活塞,看试管B导管末端是否有气泡产生或试管中是否出现一段水柱;同理,关闭止水夹1,打开止水夹3、2,推拉注射器活塞观察导管末端的气泡或水柱。
在确认气密性良好的前提下,用纸槽向具支试管中加入少许KMnO4固体,试管A和B中分别加入淀粉-KI溶液和品红溶液各3~5 mL,烧杯中加入约50 mL NaOH溶液,注射器中吸入5~8 mL浓盐酸。
2.制备Cl2并探究其性质
关闭止水夹2,打开止水夹1,将注射器中的少量浓盐酸逐滴全部加入到具支试管中,与KMnO4固体反应生成Cl2,看到具支试管(如图2所示)中的气体呈黄绿色时,开始探究Cl2的性质。
图2
具支试管中充满Cl2后,Cl2分别进入试管A和B中。

②试管B中的品红溶液逐渐褪色(或颜色变浅)时,关闭止水夹1。其反应原理是Cl2与H2O生成的HClO具有漂白性,使品红溶液褪色或颜色变浅。
3.氯气的收集
注射器中浓盐酸全部加入到具支试管中之后,向外拉注射器的活塞,收集大约15 mL的Cl2备用(如图3所示)。并关闭止水夹3,移下装有Cl2的注射器,并连接另一支空注射器。

图3
4.尾气处理
打开止水夹2和3,向外拉注射器活塞,烧杯中的NaOH溶液被倒吸入具支试管中,轻轻摇动具支试管,推动注射器活塞,使其中的Cl2进入具支试管中,让其全部被NaOH溶液吸收,如图4所示。

图4
实验结束,拆除实验装置。
三、拓展其他有毒气体的制备与性质探究
1.SO2的制备与性质实验
实验时将具支试管中的KMnO4换成Na2SO3固体,注射器中加入1∶1的硫酸(或质量分数为70%的硫酸),并将试管A中淀粉-KI溶液换成酸性KMnO4溶液,试管B和烧杯中的试剂均不变,如图5所示。

图5
关闭止水夹2,打开止水夹3、1,将硫酸滴入具支试管中,随着反应不断发生,可看到试管A中溶液紫色褪去或颜色变浅,可证明SO2具有还原性;试管B中溶液褪色或颜色变浅,可证明SO2具有漂白性。待试管A、B中充分反应后,可关闭止水夹1,打开止水夹2,通过推拉注射器活塞,进行尾气处理。
2.NO2的制备与性质
向具支试管中加入铜屑,注射器中加入浓硝酸,试管A、B和烧杯中盛放的液体均不变,增加装有少量H2O的试管C,试管C左侧连有气球,如图6所示。

图6

四、实验创新点与效果评价
【创新点】Cl2是常见的有毒气体,教材中利用MnO2与浓盐酸制备Cl2的反应需加热,条件较为复杂,为增强教学的直观性和缩短实验时间,笔者设计图1所示实验装置进行分组实验,可完成Cl2的制备与性质探究和收集等。整个实验均是在密闭体系下完成的,且安全、环保无害化,实验易于操作且现象明显,利用一套实验装置,能同时验证气体的几个性质,实现“一装置多用”,还可用于制备、收集和探究其他有毒气体(如SO2、NO2)的性质等。
【效果评价】1.装置内残留气体能完全被NaOH溶液吸收,防止其污染环境。
2.利用注射器针筒示数,可实现气体的定量实验和一定体积气体的收集。
3.通过止水夹控制气体的相关性质实验的进行,以及气体的收集和尾气处理等。
4.利用推拉注射器控制压强,使较少气体通过多个串联装置,完成多个性质实验。
5.适当调整该实验装置或更换药品可完成Cl2、SO2、NO2等多种有毒气体的制备、收集、性质探究等,实现“一装置多用”。
【例1】图7是实验室制取气体的一套装置,用于发生、干燥、收集和吸收有毒气体,下列各组物质能利用这套装置进行实验的是( )
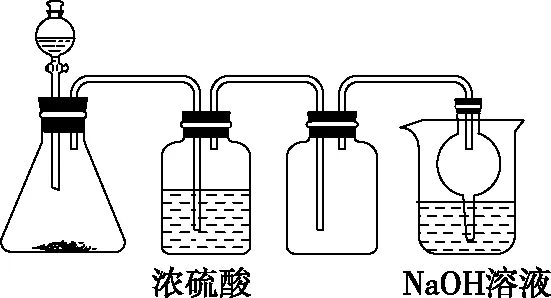
图7
A.MnO2和浓盐酸
B.Na2SO3(s)和70%硫酸
C.Cu片和稀硝酸
D.浓氨水和生石灰
【答案】B
【分析与解答】MnO2和浓盐酸制备Cl2,需酒精灯加热,A项错误;Na2SO3固体和浓度为70%的过量硫酸反应生成SO2,经浓硫酸干燥后利用向上排空气法收集SO2,导管长进短出,利用NaOH溶液吸收尾气,B项正确;Cu片和稀硝酸反应生成NO,NO不能用排空气法收集,也不能用NaOH溶液吸收,C项错误;利用浓氨水和生石灰可制备NH3,NH3不能用浓硫酸干燥,且收集时导管应短进长出,D项错误。
这类选择题综合性较强,在高考和大型联考中出现频率较高,考查“一装置多用”,以及实验的设计能否达到实验目的等,学生要结合整套装置,从气体制备、干燥剂的选用、气体收集方法、尾气吸收等角度进行综合分析,渗透科学探究与创新意识的学科核心素养。
【例2】某实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

图8
①A为氯气发生装置。
②装置B中盛放的试剂是________,其作用是______________________________。
③C中通入Cl2做氧化剂,反应后得到紫色固体和溶液,化学方程式是____________________;此外C中Cl2发生的反应还有____________________(写离子方程式)。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验可知气体中含有Cl2。为证明Cl2是由K2FeO4氧化Cl-而产生的,设计如表所示方案:
①方案Ⅰ中溶液变红的反应离子方程式是________________,该金属离子________(填“一定是”“一定不是”或“无法确定是”)由K2FeO4将Cl-氧化所得。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是。
【答案】(1)②饱和食盐水 除去HCl


②排除ClO-的干扰

本题在高考试题中物质制备和性质探究的综合实验题出现的频率较高,以Cl2为原料的制备实验试题较为常见,试题渗透了科学探究与创新意识、变化观念与平衡思想等学科核心素养。解答这类试题需要学生正确领会“资料”信息的含义,要正确体会每个实验装置的用途,如本题中A为Cl2的制备装置、B用于除杂、C中发生制备K2FeO4的反应、D用于尾气吸收等。弄清每个实验装置的作用,结合具体问题即可分析作答。
众所周知,化学是一门以实验为主的学科,在实际教学中,教师要根据实际情况尽量多创造条件,让学生走进实验室并真正做实验,在教师的指导下,让学生学会描述或分析实验现象,培养学生观察和分析实验问题的思维能力;通过探究实验,让学生了解实验探究的过程和方法,掌握化学实验操作的基本技能,认识到化学实验是认识和研究化学物质的重要途径;使学生从中不断获取新知,并体会实验的乐趣,若学生对化学学科产生了兴趣,也就不再觉得化学知识枯燥无味,在选科时也会倾向于选择化学。

