菠菜雌雄同株异花性别相关联的KASP 分子标记的开发
马亚影,万苏艳,姚远,赵子欢,董斐,明瑞光,张文萍*
(1.福建农林大学 农学院,福建福州 350002;2.福建农林大学海峡联合研究院基因组与生物技术中心,福建 福州 350002;3.福建农林大学 生命科学学院,福建 福州 350002;4.伊利诺伊大学 厄巴纳香槟分校植物生物学系,美国伊利诺伊州厄巴纳 61801)
菠菜(Spinacia oleraceaL.,2n=2x=12)属于藜科,为一年生或二年生植物,广泛种植于世界各地,是一种重要且营养丰富的绿叶蔬菜,富含类胡萝卜素、叶酸、维生素C、钙和铁,通常被用作新鲜或烹调过的肉类和蔬菜的配料[1]。菠菜为雌雄异株植株,其性别决定方式为XY 型,XX为雌株,XY为雄株[2-3]。但研究发现菠菜的开花系统具有多态性,某些品种、品系杂交后可以产生既有雄花又有雌花的单个植物(即雌雄同株异花)[4],根据其植株上花的类型将菠菜分为以下4 类:雌株、雄株、雌雄同株异花、雌雄两性花同株和雄性两性花同株[3]。研究人员认为雌雄同株异花性别受另一个与X及Y等位的单基因座M控制[4-6]。遗传分析表明,Y和M分别对M和X是上位的:XXmm为雌性,XYMM、XYMm 和XYmm为雄性,XXMM 和XXMm 产生雌雄同株异花表型[5-7]。但Onodera 等发现控制雌雄同株异花的M基因距离微卫星标记SO4的距离为4.3 cM,而微卫星标记SO4距离X/Y位点1.6 cM,这表明雌雄同株异花基因与X/Y染色体上性别决定区域上的基因对不是等位的,是紧密相连的但不是共分离位点[5]。Yamamoto等[7]开发了其中4个SCAR 标记,这些标记与M基因和Y基因都相关联,并且雌雄同株异花基因位于SP_0008和SP_0022标记之间,距离为7.1 cM。Takahata 等[2]构建了菠菜性染色体46 条蛋白质编码序列的连锁图谱,M 基因位于clc⁃e(SP_0008)和clsy3(SP_0140)位点之间的区间,雌雄同株异花的基因座位于一个染色体片段,对应于甜菜9号染色体上大约1.7 Mb 的区间,遗传距离为7.5 cM。
菠菜的基因组较小(~989 Mb),但所组装的基因组包含618 Mb(74.4%)的重复序列,高于目前报道的大多数真核生物基因组[1]。随着二代测序技术的发展以及测序成本的降低,全基因组重测序已成为分子标记筛选的重要手段。通过与参考基因组序列比对,可以找到全基因组内大量的单核苷酸多态性(single nucleotide polymorphism,SNP)变异位点。同其它分子标记方法相比,SNP标记遗传稳定性高、位点分布广泛且富有代表性,基于SNP 位点可开发出与表型关联的分子标记,因此已广泛被应用于分子实验以及育种研究。主要的技术手段有:酶切SNP 分型(Cleaved Amplified Polymorphic Sequences,CAPs 和 Derived CAPS,dCAPs)[8]、等位基因特异性PCR(allelespecific PCR,AS-PCR)[9]、竞争性等位基因特异性 PCR (Kompetitive Allele Specific PCR,KASP)[10]等。KASP 基因分型检测是一种基于荧光的检测,用于识别双等位基因SNP,是新一代的SNP 分型标记,已应用于多种物种研究[11-14]。
集群分离分析法[15](又称混合分组分析法,Bulked Segregant Analysis,BSA),主要是选择双亲群体分离后代中具有极端表型的个体进行混样,通过比较不同极端混池之间的多态性标记的差异,从而筛选出与性状相关的分子标记,实现目标基因的定位。近年来随着测序技术的高速发展与价格的不断降低,科研人员将BSA 方法和高通量测序相结合,通过比较不同混池间SNP 的频率差异或者比较混池间纯合SNP 的密度的差异,实现基因的定位[16-17]。
本研究构建了雌株与雌雄同株异花性别分离的260 份菠菜F2代分离群体,对该试验中菠菜父母本以及F2代群体中极端表型的子代池进行30×重测序,经BSA-Seq 分析对控制菠菜雌雄同株异花的基因Monoecious进行定位,开发了与雌雄同株异花基因连锁的KASP 分子标记,为分子辅助育种及菠菜性别调控机制提供理论依据。
1 材料与方法
1.1 试验材料与性状调查
采用中国国家农作物种质资源平台(https://www. cgris. net/default. asp)收集保存的菠菜Ⅱ9A0073种质资源材料,以及源于美国农业部(U.S. DEPARTMENT OF AGRICULTURE,USDA)的菠菜PI604782(SPI 12/79)种质资源材料。试验材料种植于福建农林大学海峡联合研究院基因组与生物技术中心五楼511B 人工气候室(16 h光照,8 h 黑暗)。2018年选取Ⅱ9A0073种质中的雌株作为母本,PI604782种质中的雌雄同株异花作为父本,二者杂交获得F1代植株(约50 株),种植F1代植株并观察其性别表型,选取其中2 株自交并获得F2代分离群体。观察统计F2代群体的性别表型,并挑选出48 株纯合雌株和49 株雌雄同株异花用于混池测序。
1.2 混池测序
利用CTAB 法提取菠菜2个亲本以及挑选出的97个F2代单株的顶端部位幼嫩叶片基因组DNA,分别对每个样本进行DNA 浓度测定并进行DNA 等量混池,构建纯合雌株叶片DNA 子代池和极端雌雄同株异花叶片DNA 子代池。将上述2个亲本和2个F2子代混合池送贝瑞和康(北京)公司构建DNA 文库并使用Illumina HiSeq 2500 测序平台进行PE150 双末端测序(Paired-end),测序深度为30×。
1.3 数据分析与候选区间的确定
对所得的数据进行质控(Quality Control,QC),并将过滤得到的clean reads 比对到菠菜Sp75 参考基因组(参考文献)(http://spinachbase.org/ftp/genome/Sp75/),使 用samtools 工 具[18]和GATK 软 件 检 测SNP[19]。将 检 测 得 到 的SNP 首先利用GATK 进行粗过滤和筛选,并手动进一步细过滤:(1)过滤掉在亲本中缺失的位点;(2)过滤低深度的SNP 位点;(3)过滤掉在亲本中杂合的位点;(4)过滤亲本间基因型一致的位点;(5)过滤子代混池间基因型一致的位点。以BRM(Block Regression Mapping)方法中的AFD 期望值(等位基因频率差异的期望值,Expected value of allele frequency differency(AF1-AF2))确定控制雌雄同株异花性状的候选区间[20]。参考菠菜亲本雌株的基因型,计算雌株子代池与雌雄同株异花子代池的AFD-Expected,最后确定最高峰处为候选区域。
1.4 KASP 分子标记的开发与遗传连锁图谱构建
将1.3 中得到的候选区间内的SNP 位点转化为KASP 标记,首先在亲本中筛选具有基因分型的KASP 标记(2个等位基因特异性正向引物和1个共同的反向引物以及序列见表2 列出6个分子标记的KASP 引物),之后在F2分离群体中进行基因型验证。
KASP 反应体系根据KASP Master Mix 试剂盒(KBS-1016-002)(genecompany.com)进行配置(表1),使用Bio-Rad CFX96 touch 实时荧光定量PCR 系统进行荧光检测(表2)。

表1 KASP 反应体系Table 1 KASP reaction system

表2 KASP 反应条件Table 2 KASP reaction conditions
反应结束后,根据检测的2种荧光信号来判断样本分型情况,不同的荧光信号获得不同的基因型。统计F2分离群体中个体性别表型和基因型,使用Joinmap4.1 软件(https://www. kyazma. nl/index. php/JoinMap/)构建遗传连锁图,作图算法选回归算法(regression mapping),作图函数选Kosambi 函 数,使 用R 包LinkageMapView 绘 制 遗传连锁图谱。
2 结果与分析
2.1 菠菜性别表型统计分析
菠菜Ⅱ9A0073 雌株与PI604782 雌雄同株异花杂交F1代均为雌雄同株异花性状,F2代雌株与雌雄同株异花性状分离(图1)。F2群体共274个单株,其 中 雌 雄 同 株 异 花205 株,雌 株69 株,χ23∶1=0.004 9<3.84(P<0.05),卡 方 概 率P值 等 于0.94。统计结果说明F2群体分离比符合3∶1,呈显著的质量性状分布特点(表3),雌雄同株异花基因为显性基因。

图1 菠菜亲本表型以及F2代分离群体构建Fig.1 The phenotype of spinach parents and F2 generation segregating population
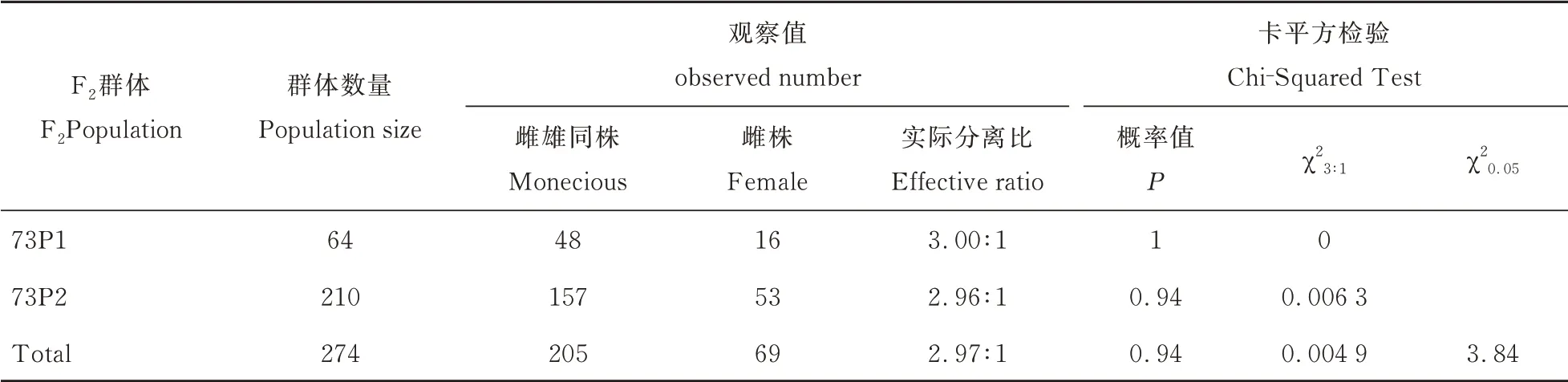
表3 雌株Ⅱ9A0073 与雌雄同株异花PI604782 杂交F2群体性别分离比例Table 3 Sex segregation ratio of F2 population between female Ⅱ9A0073 and monoecious PI604782
2.2 菠菜雌雄同株异花基因的BSA 定位
利用BSA-Seq 定位菠菜中雌雄同株异花候选基因,对2个亲本以及两个F2代纯合雌株和雌雄同株异花子代混池进行重测序。以2017年发表的Sp75 基因组为参考基因组,分析重测序数据得到全基因组的单核苷酸多态性(SNP)标记。以每个标记的等位频率差值(AFD-Expected)为指标,检测基因组中与雌雄同株异花性状关联的位置。结果显示,在4号染色体94.71~103.09 Mb 区间出现高峰,高峰位置为96.53 Mb,将该位置作为雌雄同株异花基因的主要候选区间(图2)。

图2 F2群体的雌雄同株异花性状BSA-Seq 分析Fig.2 BSA-Seq analysis of Monoecism in F2 population
2.3 KASP 分子标记分析和遗传连锁图谱构建
我们在雌雄同株异花基因(XMXM)所在候选区段选取SNP 位点设计KASP 分子标记(表4),并在亲本中进行基因型鉴定,共获得6个在亲本中共分离 的KASP 分 子 标 记(SP111,SP151,SP484,SP551,SP566,SP654)。用这6个KASP 分子标记扫描F2代分离群体,并统计基因型,雌株标记基因型记为b(HEX),雌雄同株异花标记基因型记为a(FAM),杂合基因型记为h(图3)。遗传连锁分析表明,雌雄同株异花性别基因被定位在标记SP111和SP151 之间(图4),与两个标记的遗传距离分别为6.4 cM 和5.4 cM,在Sp75 参考基因组上的物理距离为0.14 Mb(96.29~96.43 Mb),该结果说明SP111 和SP151 与雌雄同株异花性别基因连锁。

图3 KASP 标记在雌株和雌雄同株异花菠菜亲本及菠菜F2群体中的基因分型结果Fig.3 Genotyping results of KASP markers in female and monoecious parents and F2 populations of Spinach
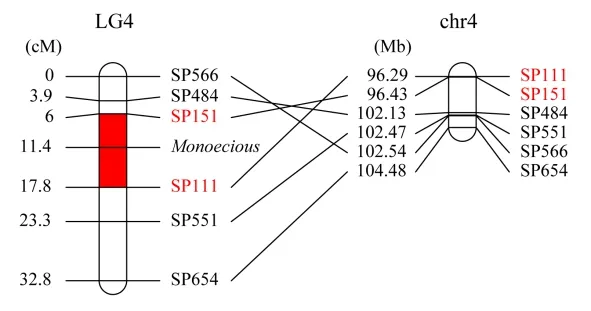
图4 Monoecious 定位区域遗传连锁图和物理图Fig.4 Genetic linkage and physical map of Monoecious location region

表4 KASP 标记引物信息Table 4 The sequence of KASP markers
2.4 候选区间的基因功能注释
结合Sp75 参考基因组的功能注释文件,提取4号染色体96.29~96.43 Mb 区间内11个候选基因的功能注释结果(表5),除去2个未知功能基因(Spo06505和Spo06508),剩余9个基因分别编码不同类型的蛋白。其中Spo06524和Spo06509分别属于bHLH 和MYB 转录因子基因家族成员,Spo06519属 于F-box 家 族 成 员,Spo06506属 于Rer1 家 族 蛋 白,Spo06520和Spo06521均 属 于 异 黄酮还原酶,Spo06523属于果胶酯酶,Spo06507编码腺嘌呤核苷酸α 水解酶样超家族蛋白,这些基因可能与雌雄同株异花性状相关,Spo06505和Spo06508未匹配到同源蛋白,可能为菠菜中的特异基因。

表5 候选区间内的候选基因功能预测Table 5 Function prediction of candidate genes in the candidate region
3 讨论
菠菜通常被认为是雌雄异株物种,早期研究将雄性决定位点Y 定位到最大的染色体上[2-3],并且利用染色体易位的方法证明了性别决定基因位于染色体的短臂上。刘丹丹等采用SRAP-BSA法筛选到3个与性别紧密连锁的SRAP 标记,其中2个标记(S5.7、S9.5)与X/Y 共分离,另1个标记与X/Y 基因遗传距离为0.3 cM[21]。Qian 等[22]构建了菠菜的高密度遗传图谱,将性别决定基因X/Y 定位于连锁群LG4 的位置(66.98~69.72 cM 和75.48~92.96 cM),推测这可能是性别决定基因的理想区域。Cai 等[23]在4号染色体(92~103 Mb)上鉴定了1个基因组区域,显示出菠菜性别类型显著关联。前期研究人员已经构建了多个菠菜性别相关的遗传群体,并且开发了菠菜X/Y 位点连锁的分子标记T11A、Spox 用于鉴别菠菜雌雄植株[3,24]。但这些分子标记只能对菠菜雄株进行准确鉴定,不能鉴定雌雄同株异花表型的植株。也有研究者开发与Monoecious连锁的标记[2,5,7],但该标记并不能精确筛选出雌雄同株异花表型的植株。
本研究重新构建了菠菜雌雄同株异花基因的F2代分离群体,F2代植株的雌雄同株异花与雌株分离比例约为3∶1(205∶69),进一步说明菠菜雌雄同株异花性状由1 对显性基因或主效基因控制,与前人研究结果相符[4-5]。本研究将Takahata 等[2]构建的菠菜性染色体46 条蛋白质编码序列的连锁图谱与菠菜物理图比对,将Monoecious大致锁定在95.9~98.9 Mb 区间内。通过BSA 和重测序技术相结合,以F2分离群体为试验材料,挖掘全基因组的SNP 位点,搜索与雌雄同株异花性状关联的SNP 位点。初步将Monoecious定位在4号染色体94.71~103.09 Mb 区间。
通过KASP 标记对F2代分离群体进行基因分型验证,筛选基因分型与表型一致的分子标记。由连锁分析得知,Monoecious与标记SP111 和SP151 连锁,并且这两个标记基本可以区分性染色体为XX 背景下的雌株与雌雄同株异花,这加快了对菠菜性别的鉴定速度。标记SP111 和SP151 分别位于菠菜4号染色体上的96.29 Mb 和96.43 Mb 位置,该区域长0.14 Mb 含有11个基因。其中Spo06519编码F-box 家族蛋白,F⁃box基因能够参与调节植物的生长发育[25],拟南芥中的F⁃box基因AtUFO(Unusual floral orangs),可以调节花分生组织和花器官发育[26]。Spo06509属于Myb 转录因子,拟南芥中的MYB 转录因子AtMYB125可以参与雄性生殖细胞的分化[27],AtMYB21,AtMYB24和AtMYB57调 控花药发育[28]。Spo06522 蛋白是Sas10 与U3 组成的复合体,参 与18S rRNA 的产生和小核糖体亚基的组装,且Sas10 作为染色质沉默调节剂,即其C 端结构域可能对其在染色质构型中的功能很重要。拟南芥中的SAS10/C1D 家族蛋白在核糖体RNA 基因表达和加工中的双重作用对于拟南芥的生殖至关重要[29-30]。
4 结论
综上所述,本研究开发出可鉴定菠菜雌株与雌 雄 同 株 的KASP 标 记,SP111 和SP151 两个 标 记为进一步精细定位菠菜雌雄同株异花基因奠定了重要基础,并且也证明了KASP 分子标记有利于开展菠菜基因精细定位以及图位克隆等工作。

