叔丁基硫醇配体构筑的硫属银簇研究进展
薛春慧,周 坤
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
金属原子簇是一种纳米级超细颗粒,具有与宏观金属完全不同的性质[1]。这类化合物的范围极其广泛,根据其结构特征,可将金属簇化合物分为简单配合物、多核配合物、螯合物、羰基配合物、夹心配合物和大环配体配合物等多种类型。金属簇化合物因其独特的原子堆积方式和潜在的应用价值在材料领域引起了广泛的关注[2]。在元素周期表中,第I B族元素(Cu、Ag和Au)通常又被称为币金属元素,由于它们能够克服金属阳离子中心的相互排斥从而增强亲金属作用,因此在构筑高核簇化合物的过程中表现出独特的优势[3-7]。
银簇化合物因其有趣的电子结构和多样的几何构型以及在发光、生物成像和催化等多学科领域的应用而受到极大的重视。根据Lewis酸碱理论和配位化学理论,银离子作为提供空轨道的酸性中心,常与作为碱性中心的携带孤对电子的有机配体结合形成稳定的配位化合物。例如,炔基、硫醇、有机膦配体已被广泛用于与银离子配位,从而形成各种结构的银簇化合物[8-15]。
近年来,随着实验方法和测试手段的发展,A.Desireddy等研究者们成功地合成了一系列硫属银簇化合物[16-20],它们的银核数量从几、几十甚至到几百个不等[21-24]。其中,大部分银簇化合物具有很好的稳定性和良好的发光性能,这主要是因为银离子很容易与硫结合形成稳定的配位键,硫既能以无机硫的形式直接参与配位,还能以有机硫的形式与金属形成稳定的配位键[25-26]。因此,在含硫金属纳米簇化合物中硫和金属的成键方式非常复杂多样,使银簇化合物的结构更加丰富多彩。
具有特定核数和几何形状的银簇化合物的合成很难控制[27-28],因此通过使用阴离子模板法构筑具有核-壳结构的功能性银簇化合物是一种有效的策略[29-34]。若要实现银簇化合物的结构转化,需要满足两个前提条件,即柔性银壳和可变阴离子模板[35]。卤素离子、CO2-3、CrO2-4、SO2-4和具有较大尺寸、较多电荷数的多金属氧酸盐阴离子等均被证明是诱导形成核-壳结构的银簇化合物的优良模板[36-39]。研究人员先后利用磷酸、钨多酸、钼多酸、钒多酸等大阴离子作为模板剂,成功地构筑了一系列银簇化合物[40-44]。此外,Q.M.Wang等[45]总结了阴离子模板法在形成多核簇合物方面的优势,证实了利用阴离子模板策略不仅可以形成稳定的纳米尺寸的银簇化合物,还可以控制簇合物的大小和形状。阴离子还可以为这类簇状化合物引入有趣的物理性质。例如,Mo6O8-22赋予[Ag60(Mo6O22)2(C≡CtBu)38](CF3SO3)6[46]和[Ag40(C≡CtBu)20(CF3COO)12(Mo6O22)]2CH3OH[47]电子跃迁行为。室温下阴离子模板法构筑的银簇化合物具有发光和电化学特性等[48]。近几十年来,已经报道了包括平面、链状、层状、轮烷类、大环化合物、螺旋状、网状物和笼状物在内的各种不同结构的硫属银簇,它们大都具有温度敏感的发光性质[49-52]。
本文重点介绍本课题组近年来采用叔丁基硫醇配体构筑的一系列多核银簇化合物,包括其合成方法、结构及性质等方面的最新进展。
1 简单硫属银簇
1.1 蟹形{Ag28S23}硫属银簇的合成、结构及性质
由AgStBu、CF3COOAg、Et3N和KBr/KI在 甲醇中自组装获得了一例全硫醇稳定的化合物[Ag28(StBu)23](CF3COO)5·8CH3OH(化 合 物1)。在 化 合 物1的结构中虽然没有观察到溴/碘离子,但是在没有溴离子或碘离子的条件下是无法获得目标产物的,溴/碘离子对化合物1的制备是必需的,它可以在化合物1的形成过程中充当底物调节反应溶液的p H。X射线单晶衍射分析表明,该化合物在P21/m空间群中结晶,其形状为“蟹状”,如图1所示。图中,绿色代表银,黄色代表硫,亮绿色代表氟,淡紫色代表氯,灰色代表碳。由图1可知,簇中心的两个Ag4单元分别连接到三个桥接StBu-配体上,可视为“蟹”的“甲壳”,与“甲壳”相连的StBu-可视为是“螃蟹”的一对“触角”,剩余的StBu-配体可视为“螃蟹”的“腿”。

图1 化合物1的结构
研究了该化合物的固态紫外可见吸收光谱和发光光谱,结果如图2所示。由图2可知,化合物1是一种潜在的发光材料。此外,化合物1是为数不多的全硫醇保护的多核银簇,这为继续探索具有完美结构的纳米簇化合物提供了宝贵的经验[53]。

图2 化合物1的荧光发射光谱
1.2 多壳层{Ag42S30}硫属银簇的合成、结构及性质
将AgStBu、CF3COOAg和nBu4NBr溶解在甲醇、二氯甲烷和N,N-二甲基甲酰胺(DMF)组成的混合溶液中,获得了一例零维化合物[Ag42S5(StBu)25(CF3COO)4](CF3COO)3·DMF(化合物2)。X射线单晶衍射分析表明,化合物2在C2/c空间群中结晶,整个化合物具有纳米级尺寸,并显示出多壳层构型,其中{Ag42S30}阳离子簇可视为从内向外逐层排列的五角星结构,结构如图3所示。图3中,紫罗兰色、粉色、海绿色和蓝绿色分别代表位于由内层到外层的银,褐色、橘色和黄色分别代表位于由内层到外层的硫,灰色代表碳,红色代表氧,亮绿色代表氟。对化合物2的发光和电化学性能进行了研究,结果如图4所示[54]。图4(a)的插图是在温度为298 K的条件下被手持式紫外灯(365 nm)激发时拍摄的化合物2的发光照片;图4(b)的插图是在温度为77 K的条件下被手持式紫外灯(478 nm)激发时拍摄的化合物2的发光照片。由图4可以看出,化合物2在298 K下被手持式紫外灯(365 nm)激发时发射微弱的蓝紫光;在77 K下被手持式紫外灯(478 nm)激发时发射橘红色的光;化合物2中存在Ag0/Ag+对的氧化还原过程。

图3 化合物2中[Ag42S5(S t Bu)25(CF 3COO)4]3+阳离子簇的标准球棒模型
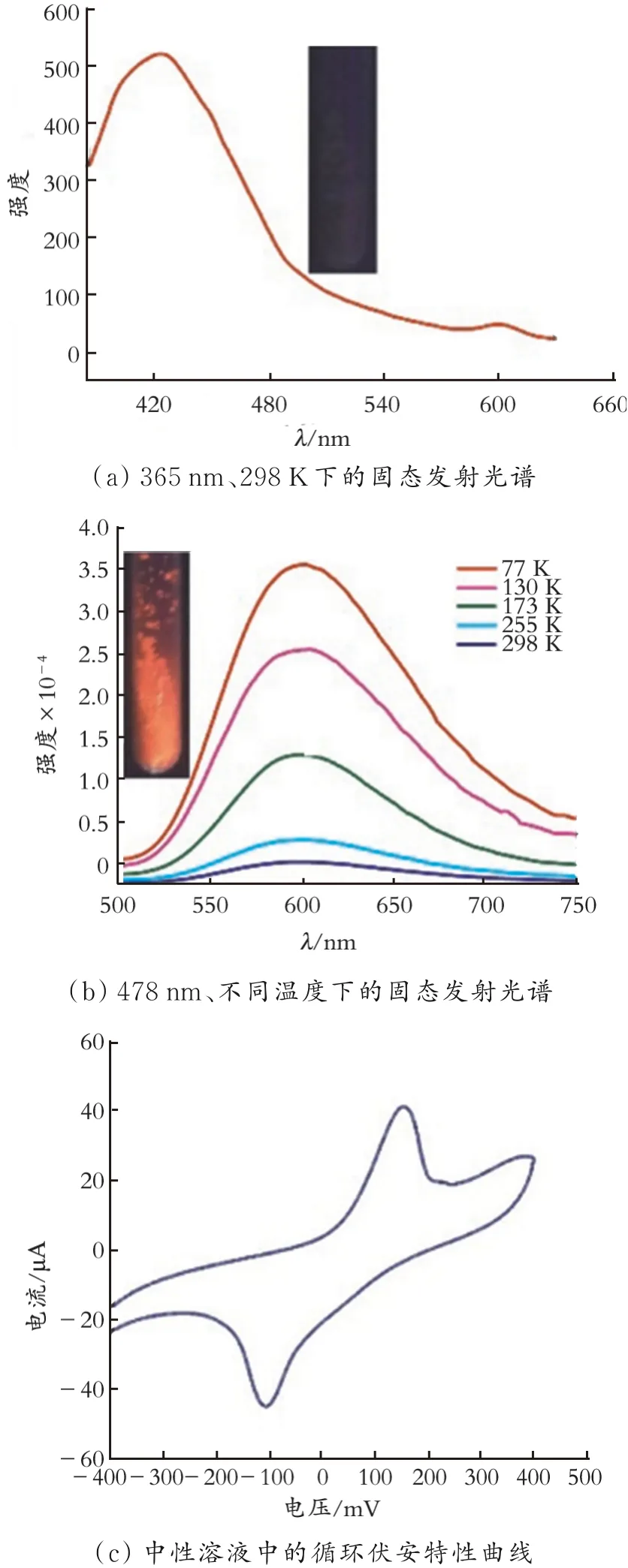
图4 化合物2的发光和电化学性能
1.3 龟状{Ag31S20-DMF}硫属银簇的合成、结构及性质
将AgStBu和CF3COOAg溶解于甲醇、DMF和二氯甲烷组成的混合溶剂中,在室温下通过一锅法合成了一例“乌龟状”中性化合物[Ag31S3(StBu)17(CF3COO)7(CO3)0.5(CF3COOH)0.5(DMF)4](化合物3),其结构如图5所示。图5中,蓝绿色代表银,黄色代表硫,灰色代表碳,红色代表氧,蓝色代表氮,亮绿色代表氟。

图5 化合物3的球棒模型图
由于DMF具有温和的还原能力,可以使银簇化合物缓慢生长,因此选用DMF作为初始合成的溶剂。实验结果表明,在化合物3的合成过程中,DMF不仅可以充当溶剂,而且还可以作为配体参与骨架配位。测试了化合物3的固态紫外可见吸收光谱和漫反射光谱,并估算出化合物3的禁带宽度约等于3.0 eV,说明化合物3是一种潜在的半导体材料[55]。在不同温度下研究了化合物3的固态发射光谱,结果如图6(a)所示。化合物3的最大发射峰强度与温度的关系如图6(b)所示。由图6可以看出,最大发射峰强度随着温度的降低而逐渐增加。研究过程中发现,化合物3在液氮中发出强烈的橙红色光,这些低温下的电子跃迁可以归因于Ag…Ag相互作用的干扰以及配体与金属之间的电荷转移。

图6 化合物3在365 nm、不同温度下的发射光谱及最大发射峰强度与温度的关系

1.4 {Ag17S8}二聚体构筑的二维层状硫属银簇的合成、结构及性质
选用AgStBu、CF3COOAg、AgBF4和(CH3)4NBr作为反应物,在甲醇溶剂中采用一锅法合成了二维层状结构化合物{[Ag34(StBu)16(CF3COO)10(CO3)5(H2O)4][Et3N+]2}n(化合物4),其不对称单元结构如图7(a)所示。图7(a)中,粉色和蓝绿色分别代表位于由内层到外层的银,黄色代表硫,灰色代表碳,红色代表氧,亮绿色代表氟。该化合物的一个不对称单元可以看作是三明治式的{Ag17S8}阳离子簇单元和{Ag17S8}阴离子簇单元通过共享同一个CO2-3连接而成。化合物4在298 K和77 K时固态发射光谱如图7(b)所示。图7(b)的插图是用手持紫外灯(365 nm)在77 K的温度下拍摄的发光照片。

图7 化合物4的不对称单元结构、发光照片和固态发射光谱
化合物4在298 K时几乎不发光,而在77 K时发出强烈的黄绿色光,其中最大发射峰从298 K到77 K发生了红移。当温度在298 K和77 K之间来回变化时,温度敏感的发光行为是可逆的,因此化合物4有望成为良好的温度探针[56]。
2 阴离子模板构筑的硫属银簇
2.1 由Cl-模板诱导的硫属银簇的合成、结构及性质
利用AgStBu配体和CF3COOH在甲醇溶液中获得了一例前所未有的零维的三明治式高核硫属银簇化合物[Ag20(StBu)10(CF3COO)2]Cl(CF3COO)7·5CH3OH(化合物5),其结构如图8(a)所示。图中,绿色和浅蓝色分别代表位于内层到外层的银,黄色代表硫,灰色代表碳,红色代表氧,亮绿色代表氟。由图8(a)可以看出,Cl-位于结构中心,三个层与层之间通过Ag…Ag相互作用连接。这种独特的大环结构表明,化合物5的形成经历了阴离子模板化的自组装过程。由于过渡金属中心化合物具有优异的发光性能,因此还研究了室温下化合物5在甲醇溶液中的发光光谱,在330 nm的激发波长下,化合物5的最大发射峰位置在410 nm左右,结果如图8(b)所示[57]。
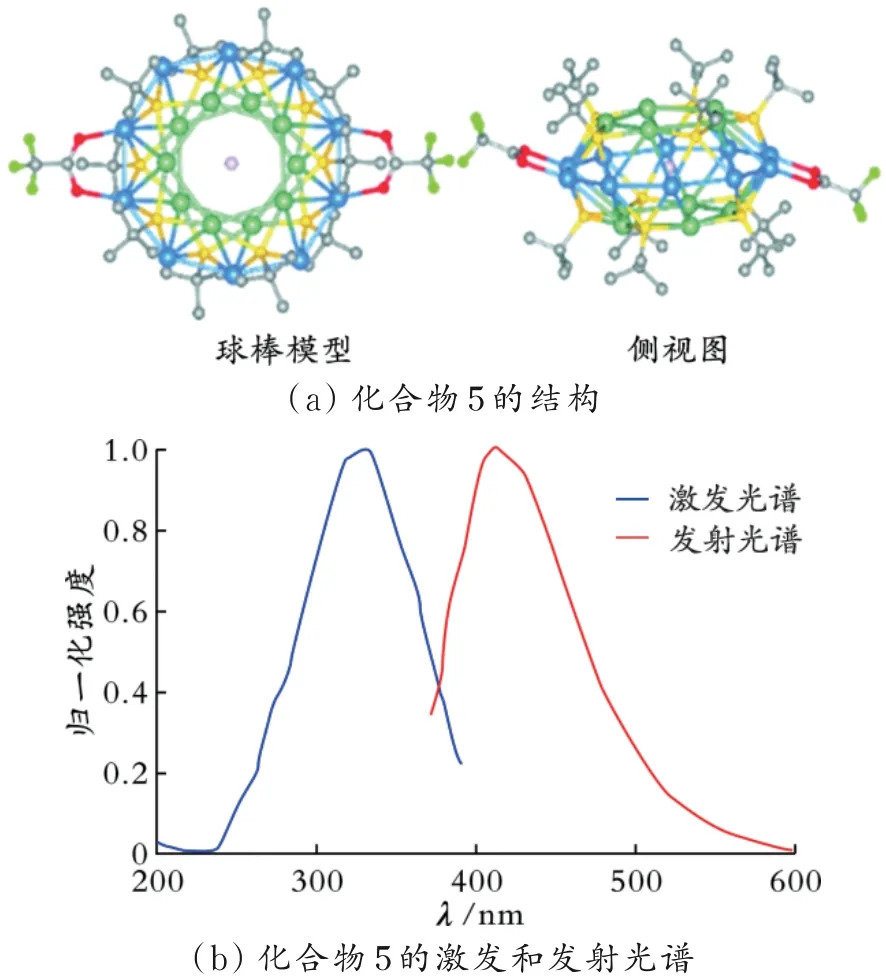
图8 化合物5的结构及其在甲醇溶液中的激发/发射光谱
2.2 由CO 2-3模板化的硫属银簇的合成、结构及性质
AgStBu与(NH4)3[CrMo6O24H6]·7H2O、Ni(CH3COO)2·4H2O、CF3COOAg和AgBF4在甲醇、乙腈和DMF组成的混合溶剂中自组装形成了一例一维硫属银簇化合物{[(CO3)@Ag20(StBu)10(CH3COO)8(DMF)2]·2H2O}n(化合物6),如图9所示[58]。图中,绿色代表银,黄色代表硫,灰色代表碳,红色代表氧,蓝色代表氮。化合物6的主体骨架与化合物5非常相似,两者的不同在于化合物6是由CO2-3作为阴离子模板来诱导形成的。
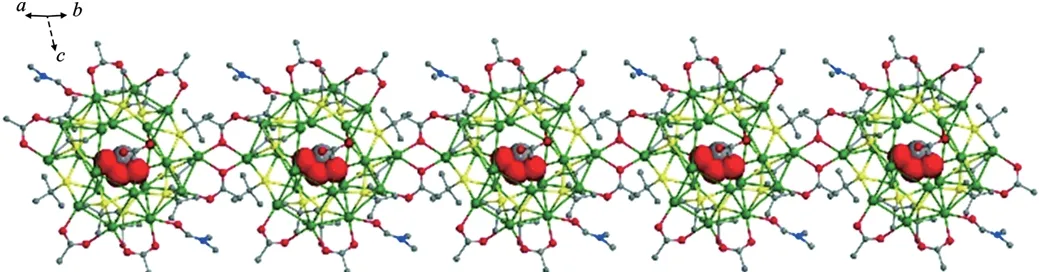
图9 化合物6的一维链状球棒模型
在室温下测试了化合物6的紫外可见吸收光谱、漫反射光谱及固态发射光谱,估算出化合物6的能隙大约为3.22 eV,说明化合物6是一种潜在的宽禁带半导体材料。化合物6的固态发射光谱、发光照片及电化学性能如图10所示。图10(a)的插图是用手持紫外灯拍摄77 K下的发光照片。化合物6在室温手持紫外灯照射下几乎不发光,而当浸入液氮中几秒以后,在同样照射强度下能发出黄光。随着温度缓慢上升到298 K时,黄色发射光逐渐消失。当温度在298 K和77 K之间来回变化时,温度敏感的发光行为是可逆的。因此,化合物6可能是温度探针的良好选择。
除了发光性能以外,还测试了化合物6的循环伏安特性曲线,结果见图10(b)。由图10(b)可以看出,在不同的扫描速率下,由化合物改性的碳糊电极在100~800 mV显示出一个氧化还原电对(I-I'),这主要是由Ag+/Ag0氧化还原引起的。随着扫描速率的变化,阳极峰电位向正方向移动,而相应的阴极峰电位向负方向移动,表明该工作电极的氧化还原过程是表面控制的。此外,还测试了该碳糊电极对亚硝酸盐的催化过程,结果见图10(c)。由图10(c)可以看出,随着亚硝酸盐的不断加入,还原峰电流增加,而相应的氧化峰电流降低,这表明被修饰的碳糊电极对亚硝酸盐的还原具有良好的电催化活性。

图10 化合物6的固态发射光谱及电化学性能
3 多阴离子模板构筑的硫属银簇
以(nBuN)2[W6O19]作为阴离子模板,利用AgStBu、CF3COOH和Et3N在甲醇溶液中自组装形成了一例具有一维链状结构的[Ag34(StBu)26(W6O21)(CF3COO)](CF3COO)·Et3N·20CH3OH(化 合 物7),其结构如图11(a)所示。图中,青绿色代表银,黄色代表硫,灰色代表碳,红色代表氧,亮绿色代表氟(其中左侧图中内部用灰色代表钨,红色代表氧的

图11 化合物7的结构及异构化为的过程

图12 化合物7、AgS t Bu和(n Bu4N)2[W 6O19]的循环伏安特性
4 结论与展望
近年来,研究人员一直致力于硫属配体构筑的高核银簇化合物的相关研究。稳定的Ag+和Ag0/+簇合物的结晶方式以及它们的结构确定在未来的研究中仍然具有重要意义,阴离子模板法和配体交换法等合成策略也逐步成为构筑高核银簇化合物的有效手段。总结七个硫属银簇的合成策略以及它们的光、电性质发现,硫醇盐配体对溶解性、疏水性、光吸收和光致发光有很大的调节作用。然而,要实现以功能为导向的高核银簇的设计及组装仍然是一项重要的挑战。
功能型硫属银簇化合物可以从以下几个方面进行研究,以期得到更多性能优异的银簇化合物:选择不同种类的阴离子作为模板,改变银簇化合物的结构,更大程度地影响银簇化合物的性质;通过使用功能化阴离子模板来调节簇状化合物的结构及性质,如引入具有手性或磁性的多金属氧酸盐,这将是调节银簇荧光性质和化学传感的最佳选择;由于银的独特反应性能,对银簇化合物体系的催化研究是一个重要的方向;发射近红外光的金属纳米簇化合物是一种有前途的发射器,可以应用于生物成像、光学信号处理和夜视技术等领域。

