血清神经元特异性烯醇化酶、组织多肽抗原、胃泌素释放肽前体对非小细胞肺癌的诊断价值研究
刘 颖 任中海 张英丽
流行病学报道分析发现,非小细胞肺癌(NSCLC)的发病率可超过850/10万人左右[1]。临床上NSCLC的发生能够导致患者呼吸功能的显著恶化,增加了肺癌患者远期病死和致残的风险[2]。临床上通过对于NSCLC的早期非创伤性检测,能够为疾病的早期诊断提供依据。血清肿瘤调控蛋白的检测,能够为恶性肿瘤的诊断提供参考。神经元特异性烯醇化酶(NSE)是癌细胞骨戒结构蛋白,其能够在癌细胞异常分裂的过程中显著释放[3];组织多肽抗原(TPA)是癌细胞膜糖蛋白成分,其能够翻译癌细胞的持续性自我扩增状态,反应癌细胞的异常凋亡分解速度[4];泌素释放肽前体(ProGRP)不仅能够影响到胃肠道激素的分泌,同时还能够影响到癌细胞的增殖转录调控过程[5]。为了揭示NSE、ProGRP、TPA在肺癌患者中的表达情况,从而为临床上肺癌的诊断提供参考,本次研究选取2018年8月~2020年5月本院经病理学检查确诊的74例NSCLC患者,探讨了NSE、ProGRP、TPA的表达情况及其诊断学价值。
1 材料与方法
1.1 对象
收集我院在2018年8月~2020年5月期间经病理学检查确诊的74例NSCLC患者(NSCLC组)、选取同期在体检中心获取的60例健康成年人作为志愿者(对照组)。其中NSCLC组,年龄41~75岁,平均年龄(63.0±9.4)岁;性别:男性40例,女性34例;TNM分期:Ⅰ期18例、Ⅱ期22例、Ⅲ期26例、Ⅳ期8例;肿瘤直径≥3 cm 31例、<3 cm 43例。对照组60例,年龄40~75岁,平均年龄(60.8±10.4)岁;性别:男性31例,女性29例。二组研究对象在上述的一般资料方面进行比较,无统计学差异(P>0.05)。
1.2 纳入及排除标准
诊断标准:NSCLC患者诊断标准参考中华医学会制定的标准[6];纳入标准:①患者年龄在19~75岁以内;②经胸部CT、MRI检查及病理学检查确诊,病理学类型为腺癌或者鳞癌;③既往未接受放化疗、免疫学治疗;④对照组来源于本院体检中心结果健康的自愿者;⑤本研究符合《赫尔透辛基宣言》相关医学伦理规定。排除标准:①合并严重肺部疾病等;②长期使用糖皮质激素或免疫抑制剂者;③其他部位感染及其他系统的重大疾病;④类风湿性疾病、免疫系统疾病患者。
1.3 检测方法
采用患者静脉血离心后取其上清液放入空白孔中,加入稀释液、孵育、清洗等处理后,再加入TMB显色底液(品牌:YSRIBIO ,由湖州英创生物科技公司生产)、孵育后,倒入终止液3 min内检测OD450值,BioTek酶标仪购由美国伯腾仪器有限公司生产。
1.4 统计分析

2 结果
2.1 NSCLC组和对照组血清NSE、ProGRP、TPA水平比较
NSCLC组患者血清NSE、ProGRP、TPA水平均高于对照组,均具有统计学差异(P<0.05);见表1。

表1 两组血清NSE、ProGRP、TPA水平比较
2.2 血清NSE、ProGRP、TPA水平检测诊断NSCLC的价值
血清NSE诊断NSCLC的灵敏度为34.82%、特异度为81.66%、ROC曲线下面积AUC值为0.623;血清ProGRP诊断NSCLC的灵敏度为42.74%、特异度为84.09%、ROC曲线下面积AUC值为0.668;血清TPA诊断NSCLC的灵敏度为51.28%、特异度为89.63%、ROC曲线下面积AUC值为0.704;血清NSE、ProGRP、TPA水平联合诊断NSCLC的灵敏度为93.20%、特异度为83.87%、ROC曲线下面积AUC值为0.879;见表2、图1。
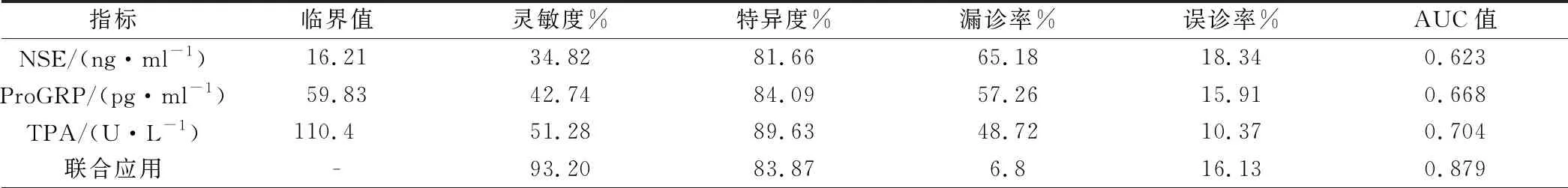
表2 血清NSE、ProGRP、TPA水平检测对NSCLC的诊断价值

图1 血清NSE、ProGRP、TPA水平检测诊断NSCLC的ROC曲线
3 讨论
NSCLC具有较高的总体发病率,其在不同类型的肺癌患者中,NSCLC的发病比例较高,其远期病死的风险也明显上升[7]。临床观察发现,NSCLC患者的生存预后恶化较为明显,多数NSCLC患者临床确诊时已处于疾病的中晚期[8]。而通过早期诊断NSCLC,能够为临床上NSCLC的根治性手术治疗提供契机,从而改善NSCLC患者的整体临床预后。现阶段影像学检查虽然能够在NSCLC的诊断过程中发挥作用,但依靠胸部CT等检查诊断NSCLC的灵敏度较低,其对于早期NSCLC诊断的可靠性仍然存在一定的局限。血清学方面的肿瘤指标,能够发挥其定量化和检测便捷的特点,在恶性肿瘤的早期筛查和诊断过程中具有重要辅助参考价值。虽然癌胚抗原或者糖链蛋白能够在NSCLC的诊断中发挥作用,但依靠癌胚抗原或者糖链蛋白诊断NSCLC的假阳性率仍然较高[7]。本次研究通过对于NSCLC患者血清中NSE、ProGRP、TPA的表达分析研究,能够为临床上肺癌的诊断提供新的研究指标。
NSE是神经特异性烯醇化酶,其主要表达于神经组织、间质成分等中,在癌细胞异常分裂的过程中,癌细胞内骨架结构蛋白的分解,能够显著促进NSE的释放[9];ProGRP是胃泌素释放前体物质,其对于肿瘤细胞增殖调控的影响,能够提高上皮来源恶性肿瘤细胞的DNA分裂速度。相关分子生物学的研究还认为,ProGRP对于肿瘤细胞生物学行为的改变,能够提高中晚期肿瘤细胞的浸润转移风险[10-11];TPA是组织多肽抗原,其能够在肿瘤细胞膜破碎的过程中显著释放,并能够反应癌细胞的增殖活跃状态[12]。
本次研究通过对于NSCLC患者血清中NSE、ProGRP、TPA的表达分析可见,在肺癌病例组患者血清中,NSE、ProGRP、TPA的表达浓度明显上升,高于健康对照成年组,统计学差异显著,表明NSE、ProGRP、TPA的高表达均能够影响到肺癌的病情进展过程。NSE、ProGRP、TPA的高表达,主要考虑由于癌细胞增殖活性的增强、癌细胞浸润行为的恶化及癌细胞核DNA的异常分裂等有关,多种病理性途径的激活,最终均能够促进NSE、ProGRP、TPA的表达释放。其他研究也表明,NSE的表达浓度在肺癌患者血清中可随着患者病情的恶化而显著升高,如果合并有远处转移或者远期复发倾向的患者,其NSE的表达浓度均明显升高[13,14]。诊断学方面的分析可见,NSE、ProGRP、TPA在单独诊断肺癌的过程中均具有一定的价值,NSE、ProGRP、TPA指标超过血清中检测临界值时,其诊断NSCLC的灵敏度虽然较低,但其诊断的特异度可超过70%以上,可靠性较为明显。但单独NSE、ProGRP、TPA检测的灵敏度较低,其原因主要由于单一的指标检测,难以对于不同类型来源的NSCLC均具有较高的特异性标志作用。而通过联合NSE、ProGRP、TPA进行检测,可以发现其诊断的灵敏度可超过90%以上,诊断的特异度也有所上升,提示了联合检测的现实参考意义。这主要由于联合不同指标进行检测,能够避免单一指标个体表达差异导致的诊断效能的下降。但有研究者认为,通过NSE、ProGRP等指标联合诊断,其诊断NSCLC的灵敏度仍然不超过50%[15-16],不同的研究之间数据差别较大,考虑由于入组病例数量及检测方式的不同有关。
综上所述,在NSCLC患者血清中,NSE、ProGRP、TPA的表达浓度明显上升,同时NSE、ProGRP、TPA在联合检测的过程中,其可以显著提高NSCLC的诊断效能。本次研究的现实意义在于探讨了NSE、ProGRP、TPA的具体诊断临界值。

