诱骗受体3(DcR3)与人上皮卵巢癌患者预后的关系
邢燕平 任红娟 王 欣
卵巢癌的发病呈现出了整体年轻化的趋势,在合并有相关家族史的女性中,其发病率还将进一步提高[1]。卵巢癌患者的远期临床预后较差,其复发转移的风险较高,卵巢癌患者的总体生存时间较短。而分析患者预后不良的影响因素,对疾病诊治具有重要指导意义。已有研究显示[2],肿瘤相关蛋白的异常表达与卵巢癌疾病进展即患者预后密切相关。诱骗受体3(DcR3)是肿瘤坏死因子家族受体,具有诱导下游促癌因子表达,并以此增强癌细胞的浸润和粘附功能,最终促进卵巢恶性肿瘤的发生[3,4]。部分研究发现[5],DcR3高表达是消化系统恶性肿瘤的危险因素之一,同时该指标还与患者预后相关,但DcR3在卵巢癌中表达及意义如何,临床尚无确切结论。本研究主要观察DcR3在卵巢癌组织中的表达状况,并分析其与患者预后间的关系。
1 材料与方法
1.1 一般资料
选取我院2015年5月至2017年9月经病理学检查证实的88例人上皮卵巢癌组织标本、88例良性卵巢肿瘤组织标本。
卵巢癌组,年龄36~72岁,平均(53.2±11.8)岁;FIGO分期:Ⅰ期26例、Ⅱ期35例、Ⅲ期24例、Ⅳ期3例;肿瘤组织学分级:G1级25例、G2级35例、G3级28例;淋巴结转移42例;病理学类型:浆液性囊腺癌56例、黏液性囊腺癌22例、子宫内膜样腺癌10例;病灶最大径≥5 cm 57例、<5 cm 31例。良性组,年龄35~68岁,平均(51.8±10.4)岁,其中浆液性囊腺瘤60例、黏液性囊腺瘤28例。2组患者的年龄比较,差异无统计学意义(P>0.05)。
诊断及入选标准:①卵巢癌的诊断参考《卵巢恶性肿瘤诊断与治疗指南(第四版)》[6];②经病理学检查的标本为术后标本;③患者无放疗或化疗史;④本研究涉及患者隐私资料注意保密,方案经伦理学会批准后实施。排除标准:①患有其他类型或部位恶性肿瘤;②临床及病理学检查资料不完整;③伴有其他系统的重大疾病。
1.2 免疫组化染色技术
免疫组化检查评分标准:DcR3蛋白主要定位于上皮卵巢癌细胞质中,如果免疫检测显示黄色、棕黄色、褐色则可进行相关评分,(1)根据染色的深度:未染色(0分)、仅仅淡黄色染色(1分)、棕黄色染色(2分)、染色呈褐色、黑色(3分);(2)根据染色的上皮卵巢癌细胞在显微镜下视野中所占比例:占比≤10%(1分)、染色细胞占比范围>10%~50%(2分)、染色细胞占比范围>50%~75%(3分)、染色细胞占比>75%(4分),染色深度评分与染色细胞占比评分二者乘积<3分为阴性、≥3分为阳性。总分<3分为(-),总分3~5分为(+),总分6~9分为(++),总分>9分为(+++)。
对样本进行切片后,通过二甲苯进行脱腊操作,随后置于5%双氧水内,反应15 min后,转入磷酸盐缓冲液内,反应8 min,冲洗2次后,通过10 ml 5%的山羊血清抗体进行封闭,反应12 min,DcR3抗体一抗(购自abcum公司,1∶500),4℃冷藏至次日,取出并冲洗2次,IgG二抗(购自北京康泰生物,1∶1000),静置反应25 min,冲洗2次,显色并脱水封片,于显微镜下进行结果读取。
1.3 统计学方法
2 结果
2.1 卵巢癌组织与卵巢良性肿瘤组织中的DcR3蛋白阳性表达率比较
卵巢癌组织中的DcR3蛋白阳性表达率为61.36%(54/88),高于良性组的28.41%(25/88),差异具有统计学意义(χ2=14.244,P<0.000)(表1)。

表1 卵巢癌组织与卵巢良性肿瘤组织中的DcR3蛋白阳性表达比较/例
2.2 卵巢癌DcR3蛋白阳性表达率与临床病理学特征的关系
经分析,不同FIGO分期、是否发生淋巴结转移、不同组织学分级的卵巢癌组织中的DcR3蛋白阳性表达率比较,差异具有统计学意义(P<0.05)(表2)。

表2 卵巢癌DcR3蛋白阳性表达率与临床病理学特征的关系(例,%)
2.3 卵巢癌DcR3蛋白阳性表达率与患者预后的关系研究
经过3年随访,生存17例患者,失访7例,死亡64例,采用Cox比例风险回归模型分析,DcR3蛋白阳性表达、FIGO分期增高、发生淋巴结转移、组织学高分级是卵巢癌患者不良预后的独立性危险因素(P<0.05),见表3。
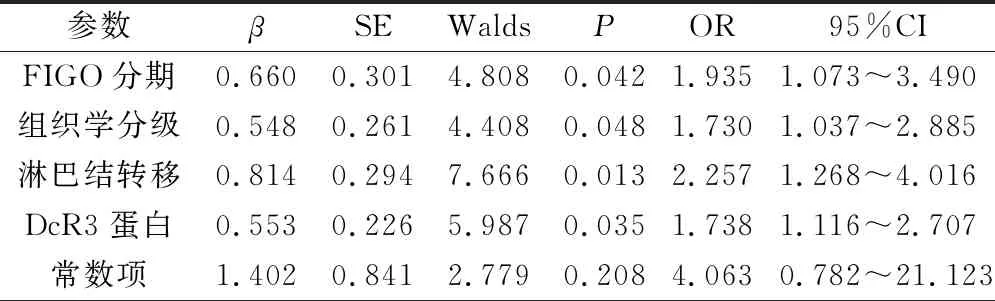
表3 卵巢癌DcR3蛋白阳性表达率与患者预后的关系研究
3 讨论
卵巢癌是妇科较为常见的恶性肿瘤,其临床预后恶化较为明显,远期病死率占据了妇科恶性肿瘤的前三位。在绝经迟、月经来潮早或者长期性激素紊乱的群体中,卵巢癌具有更高的发病风险[7]。流行病学研究发现,卵巢癌的5年生存率不足40%,其远期复发转移的风险可超过25%,且随着随访时间的延长,卵巢癌的复发转移率可进一步上升[8]。现阶段缺乏对于卵巢癌临床预后评估的可靠性指标,虽然影像学检查能够在卵巢癌的诊断过程中发挥作用,但影像学检查预测卵巢癌的滞后性较为明显,其对于卵巢癌临床结局评估的参考性较低。血清CA125虽然能够在卵巢癌的临床预后的评估中发挥作用,但单独依靠CA125评估卵巢癌临床预后的假阳性率仍然较高,其评估仍然存在一定的局限[9]。本次研究通过对DcR3蛋白与卵巢癌临床病理特征的关系分析,能够在揭示卵巢癌部分发病机理的同时,为临床上卵巢癌的诊疗提供新的预后指标。
DcR3蛋白是诱骗家族相关因子,其能够作为肿瘤坏死因子受体的重要激活成分,参与到肿瘤细胞内信号通路的激活过程。DcR3蛋白可增强肿瘤细胞的扩增速度,抑制其凋亡,进而加速卵巢癌恶化进程。分子生物学领域的研究还认为,DcR3蛋白能够通过提高癌细胞膜受体跨膜脂蛋白受体的激活程度,诱使MAPK信号路径大量活化,进而参与肿瘤发生、发展过程[10]。有部分研究者揭露了DcR3蛋白在卵巢癌患者中的表达情况,发现DcR3蛋白的表达与卵巢肿瘤的中晚期病情进展有关[11],但缺乏对DcR3蛋白与卵巢癌预后间的联系的研究。
本次研究发现,卵巢癌病灶内DcR3蛋白阳性水平显著较良性卵巢肿瘤组织高,表明DcR3蛋白在卵巢癌患者中存在明显的高表达现象,这主要与DcR3蛋白的异常增高可诱导卵巢细胞出现上皮细胞生物特征,并增强其基膜突破能力,最终提高癌细胞浸润、粘附水平。另外有研究也发现了与本次研究相似的结论,其认为在卵巢浆液性囊腺癌或者透明细胞癌患者中,DcR3蛋白的表达水平与其分期具有正向相关,同时还与患者复发风险正向相关[12]。在研究DcR3蛋白与卵巢癌病理特征间的联系时,本研究发现临床分期进展、伴盆腔内淋巴结转移或组织学分级不佳的患者,其瘤体内的DcR3阳性率较高,表明DcR3蛋白的异常增高还与患者疾病特征相关,提示DcR3还可用于分析卵巢癌患者疾病严重程度。这主要考虑由于DcR3蛋白的高表达,能够影响到卵巢癌的肿瘤微环境,提高癌细胞变形能力,导致癌细胞的浸润能力增强,其对周围组织的侵蚀能力上升;同时DcR3蛋白的高表达,还将加速癌细胞的分化进程,导致其排列紊乱,最终促进了卵巢癌组织学分级的恶化[13-16]。但本次研究并未发现DcR3蛋白在浆液性囊腺癌或者子宫内膜样腺癌等患者中的表达差异,表明DcR3蛋白并不会影响到卵巢癌的分化来源。危险因素分析可见,DcR3蛋白阳性表达、FIGO分期增高、发生淋巴结转移、组织学高分级是卵巢癌患者不良预后的独立性危险因素,临床上对于DcR3蛋白高表达或者合并其他高危因素的患者,应采用综合性治疗措施,从而改善卵巢癌的临床结局。
人上皮卵巢癌组织中DcR3蛋白表达上调,并且与肿瘤的恶性程度增加、不良预后相关。希望后续更多的研究可以关注到DcR3蛋白的具体诊断学AUC曲线问题。

