基于环介导等温扩增技术的草莓枯萎病检测
侯圣凡 刘峻杰 李小峰 王红清
(中国农业大学 园艺学院,北京 100193)
草莓(Fragaria×ananassaDuch)种植周期短、结果早且经济效益高,是一种重要的经济作物。我国草莓主要采用设施栽培,多年的连续种植导致草莓根茎部病害频繁发生,其中以真菌病害对草莓的影响最为显著,严重制约了我国草莓产业的健康发展[1]。
尖孢镰刀菌(Fusariumoxysporum)引起的枯萎病是一种毁灭性的土传真菌病害,致病能力强,感染面积广,被列为世界十大植物病原菌之一[2]。该菌有不同的专化型,分别能导致番茄、甜瓜、三七、辣椒、香蕉、西瓜、马铃薯和苜蓿等枯萎病发生,且分布广泛,在全国各个种植区均有不同程度的发生[3-6]。草莓枯萎病是由F.oxysporumf. sp.fragariae(Fof)引起的,Fof能够从根部快速侵染草莓,造成维管束堵塞,叶片不对称或变形,最终致使草莓植株萎蔫和死亡。草莓枯萎病传染性极强,几乎无药可施,因此对草莓枯萎病病原菌进行早期、特异性和准确的鉴定是有效控制病害的关键[7]。
环介导等温扩增(LAMP)是一种新型、快捷方便、灵敏度极高且廉价的核酸扩增方法。LAMP法有2个关键技术[8]:首先是引物的设计,针对特异性靶序列的高度保守区域,设计4条引物以及2条环状引物;其次是选用了Bst DNA聚合酶,该酶具有重要的链置换活性,能使LAMP扩增过程中发生链置换反应[9]。目前LAMP已被应用于植物病毒、类病毒、真菌、细菌和线虫等方面的检测[10-12]。近年来建立了许多新的方法用于Fof的检测,Suga等[13]利用Han-Skippy 2个转座元件之间的基因组区域设计了引物ForfaF和ForfaR,通过普通PCR的方法实现了对Fof特异性扩增;Hong等[14]以Han-Skippy基因区域为基础,利用实时荧光定量PCR对Fof进行检测;Burkhardt等[15]利用Han-Skippy区域设计重组酶聚合酶反应引物与Taqman荧光检测相结合也实现了对Fof的鉴定,以上检测手段都需要昂贵的检测设备且检测时间过长。针对草莓枯萎病的LAMP检测技术国内还未见报道。因此,本研究以Fof特异性区域Han-Skippy为靶序列,利用SYBR Green I染料建立Fof的LAMP检测技术,并通过组织培养法和PCR法加以辅佐验证,以期实现草莓枯萎病的快速检测。
1 材料与方法
1.1 供试材料
本研究共选用16种北京地区草莓的重要病原菌或常见的土传病原菌,其中F.oxysporumf. sp.fragariae3株,其他种类病原菌各1株(表1)。将上述菌株用马铃薯葡萄糖琼脂(PDA)平板在25 ℃下培养5 d后收集菌丝,使用BufferA和BufferB法提取DNA[1],置于-20 ℃下保存备用。
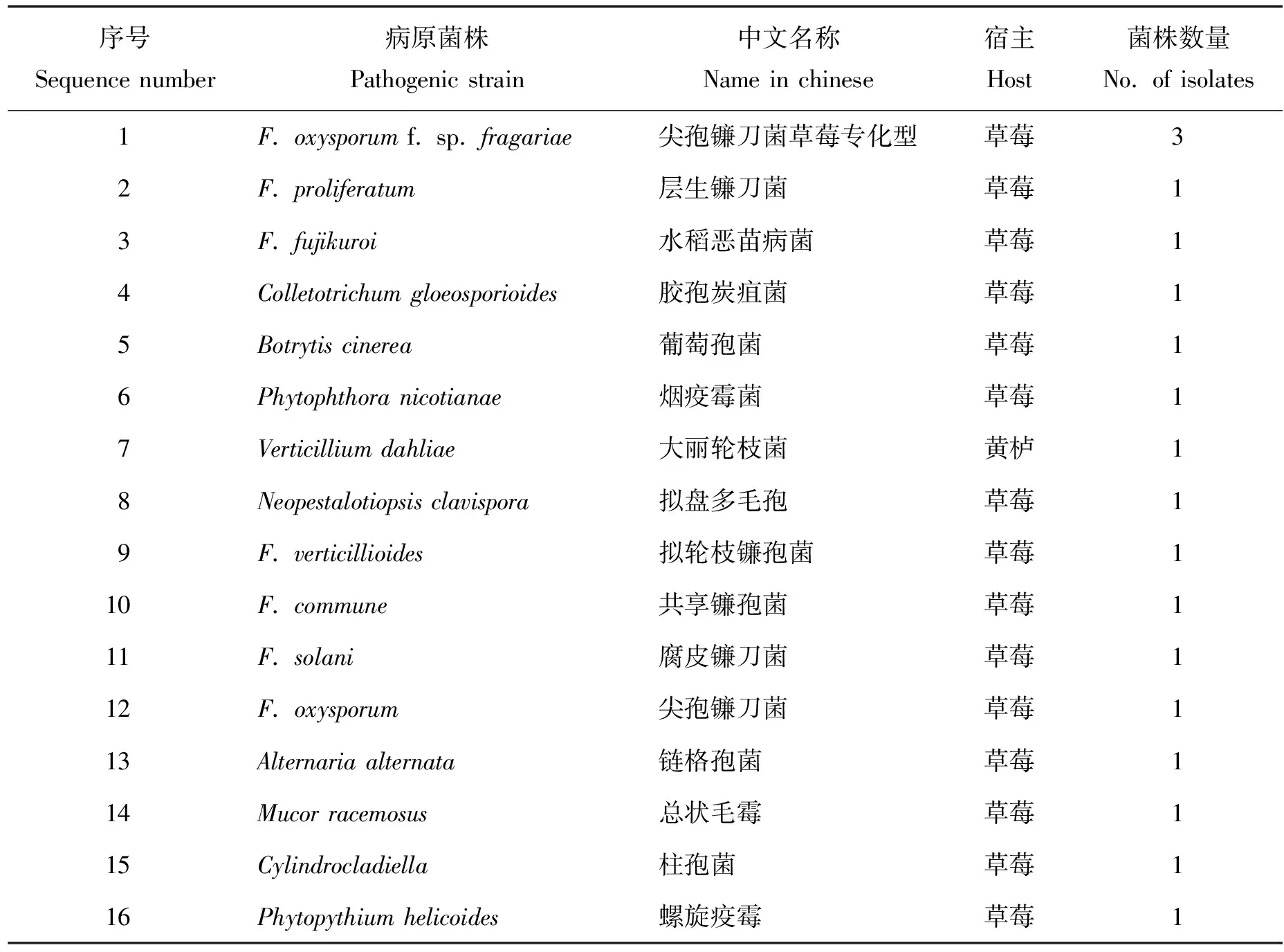
表1 试验用病原菌株Table 1 Pathogen strains in this test
1.2 引物设计
以Fof转座子Han-Skippy[13]基因序列为靶序列,用LAMP在线设计软件(http:∥primerexplorer.jp/e/v5_manual/index.html)选定了3套引物,但只有1套引物带有Loop引物,故选择此套引物作为最优的LAMP引物(表2),各引物在靶序列的相对位置见图1。

F3和B3为外引物;F2和F1为FIP内引物;B1和B2为BIP内引物;LF为环引物。F3 and B3 are external primers; F2 and F1 are internal primers FIP; B1 and B2 are internal primers of BIP; LF is loop primer.图1 Fof-LAMP引物在Han-Skippy序列上的定位Fig.1 The location of Fof-LAMP primers on the aligned Han-Skippy sequence

表2 LAMP和PCR引物序列Table 2 LAMP and PCR primers used in this study
1.3 LAMP体系和反应条件优化
以Fof转座子Han-Skippy基因区域为模板进行LAMP反应体系的优化,参考杜然等[16]的方法并加以改进。具体如下:以Bst DNA聚合酶(Bst 2.0 WarmStart DNA Polymerase)为基础配制,具体成分包括:2.50 μL 10×Thermo Pol Buffer、0.25 μL Mg2+溶液(100 mmol/L)、1.00 μL dNTPs溶液(10 mmol/L)、1.00 μL FIP溶液(20 μmol/L)、1.00 μL BIP溶液(20 μmol/L)、0.50 μL F3(10 μmol/L)、0.50 μL B3(10 μmol/L)、0.75 μL LoopF溶液(10 μmol/L)、0.50 μL Bst DNA聚合酶溶液(8 U/μL)、1.00 μL Betaine(5 mol/L)、1.00 μL模板DNA溶液(450 ng/μL),补足ddH2O至25.00 μL。将LAMP反应体系置于62.9 ℃水浴锅中反应60 min,然后向该体系中加入0.40 μL的10 000×SYBR Green I染料,在紫外灯下观察反应液颜色。荧光绿色为阳性,褐色为阴性。使用2.5%的琼脂糖凝胶电泳对反应液进行检测,有梯形条带为阳性,无条带为阴性。
对LAMP反应因子Bst DNA聚合酶、Mg2+、dNTPs和各条引物的浓度分别进行条件优化。设置Bst DNA 聚合酶浓度梯度为0.08、0.16、0.24和0.32 U/μL,设置Mg2+浓度梯度为1.0、2.0、3.0、4.0、5.0、6.0、7.0和8.0 mmol/L,设置dNTPs浓度梯度为0.2、0.4、0.6、0.8、1.0、1.2、1.4和1.6 mmol/L。在最适Bst DNA聚合酶浓度(0.16 U/μL)、Mg2+浓度(1.0 mmol/L)和dNTPs浓度(0.4 mmol/L) 的条件下,设置内引物(FIP和BIP)浓度梯度为0.4、0.8、1.2、1.6和2.0 μmol/L、外引物(F3和B3)浓度梯度为0.1、0.2、0.3、0.4和0.5 μmol/L和正向环引物(Loop F)浓度梯度为0.2、0.4、0.6、0.8、1.0和1.2 mmol/L。设置Betaine浓度梯度为0.2、0.4、0.6、0.8、1.0和1.2 mmol/L。在各反应因子最佳的浓度条件下,优化LAMP反应温度,在50.0~68.5 ℃范围中,逐步锁定最优反应温度范围。然后对LAMP反应时间梯度进行优化。每步骤重复3次。
1.4 LAMP反应灵敏度测定
提取Fof-DNA为模板,调整其浓度为450 ng/μL,然后将其以10倍梯度连续稀释为45 ng/μL、4.5 ng/μL、450 pg/μL、45 pg/μL、4.5 pg/μL、450 fg/μL、45 fg/μL和4.5 fg/μL。每梯度取1 μL DNA作为LAMP反应模板,阴性对照使用ddH2O,在62.9 ℃水浴锅中反应60 min。
同时,以各浓度梯度的Fof-DNA为模板进行常规PCR检测。该PCR反应体系(25 μL)包括:12.5 μL 2×2*SWTaq酶Mix、正引物FofraF溶液(10 μmol/L)和反引物FofraR溶液(10 μmol/L)各1 μL、DNA模板溶液1 μL,用ddH2O补齐至25 μL。ddH2O作为阴性对照。PCR反应程序:94 ℃ 预变形3 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸20 s,35个循环;72 ℃延伸3 min。反应结束后,使用2.5%琼脂糖凝胶电泳检测PCR扩增产物,扩增的DNA条带为239 bp。试验重复3次。
1.5 LAMP反应特异性检测
本研究所用的F.oxysporumf. sp.fragariae由本实验室保存。其他用于特异性检测的还包括层生镰刀菌(F.proliferatum)、水稻恶苗病菌(F.fujikuroi)、胶孢炭疽菌(C.gloeosporioides)、葡萄孢菌(B.cinerea)、烟疫霉菌(P.nicotianae)、螺旋疫霉(P.helicoides)、大丽轮枝菌(V.dahliae)、拟盘多毛孢(N.clavispora)、拟轮枝镰孢菌(F.verticillioides)、共享镰孢菌(F.commune)、腐皮镰刀菌(F.solani)、尖孢镰刀菌(F.oxysporum)、链格孢菌(A.alternata)、总状毛霉(M.racemosus)和柱孢菌(Cylindrocladiella)共16个草莓普遍存在的病原菌和常见土传病原菌菌株。以ddH2O代替真菌DNA作为阴性对照。试验重复3次。
1.6 利用LAMP体系检测田间感病植株
从北京通州草莓大棚中随即采集16株叶片枯萎、根部腐烂、维管束褐变,疑似草莓枯萎病症状的植株,以及1株健康草莓植株用于LAMP检测。用刀片将发病以及健康的试验样品根茎部维管束病健交接处切下,各取0.15 g放入液氮中研成粉末,用TIANGEN-DNAsecure Plant Kit提取其中的DNA,置于-20 ℃下保存备用。分别以各草莓根茎样品的DNA和Fof的DNA为模板,按LAMP体系进行反应。反应结束后在紫外灯下观察反应管颜色变化并且进行琼脂糖凝胶电泳检测。同时,利用Fof特异性引物FofraF和FofraR对田间样品进行常规PCR检测,进一步佐证LAMP试验结果。试验重复3次。
2 结果与分析
2.1 LAMP反应体系的建立
根据Fof转座子Han-Skippy基因区域为模板设计了5条LAMP引物。LAMP引物包括2条内引物FIP和BIP、2条外引物F3和B3、1条环引物LoopF。通过对Fof反应体系和反应条件的优化,确定Fof-LAMP(25 μL)各反应因子的最佳终浓度为:Bst DNA聚合酶0.16 U/μL、Mg2+1 mmol/L、dNTPs 0.4 mmol/L、FIP和BIP各0.8 μmol/L、F3和B3各0.2 μmol/L、LoopF 0.3 μmol/L、Betaine 0.2 mol/L和0.4 μL SYBR Green I染料(表3)。

表3 检测Fof的LAMP体系Table 3 The LAMP system to detect Fof
对Fof-LAMP反应温度进行优化。结果表明,当温度为57.5~65.9 ℃时,Fof-LAMP才会发生反应(图2(a))。当温度在58.0~65.4 ℃时,各温度下反应液发出的荧光绿色亮度基本无异,但62.9 ℃下,反应液的琼脂糖凝胶电泳条带更亮(图2(b)),说明Fof-LAMP反应效率更高,所以选择62.9 ℃作为Fof-LAMP的最适温度。
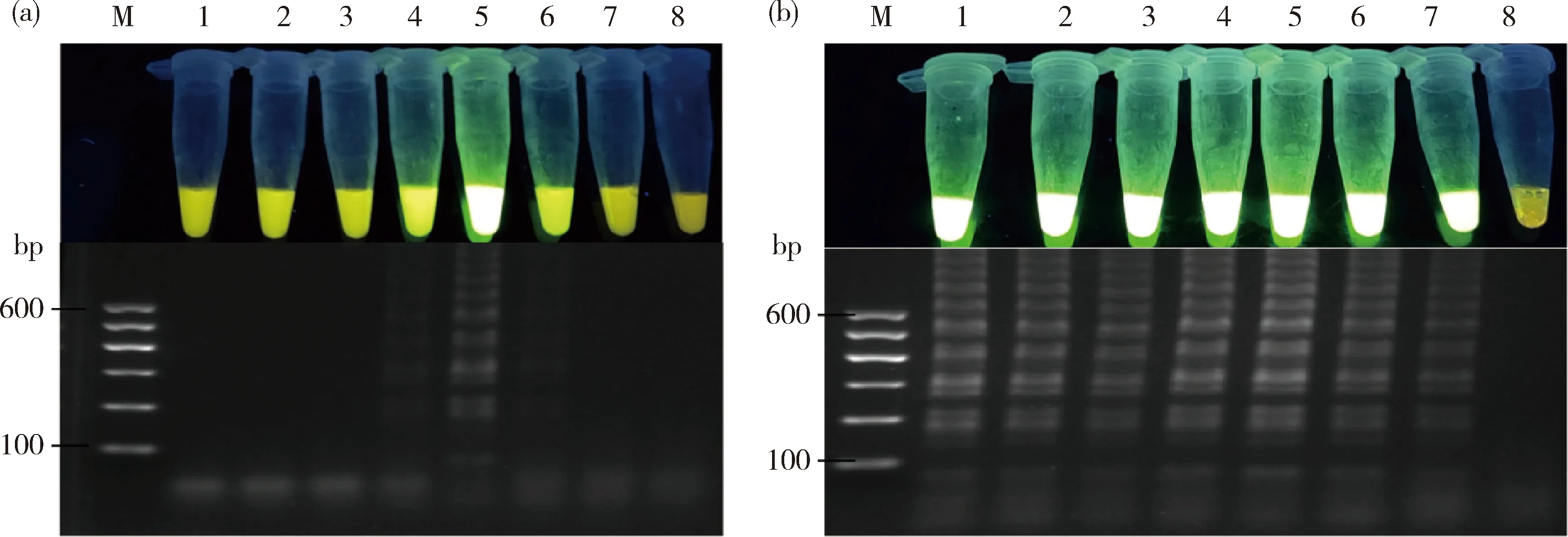
(a) M为分子量标记;1~7表示反应温度分别为50.0、51.4、53.8、57.5、62.0、65.9和68.5 ℃,8为阴性对照;(b)M为分子量标记;1~7表示反应温度分别为 58.0、58.6、59.6、61.1、62.9、64.4和65.4 ℃,8为阴性对照。图片上半部分为 LAMP 检测,下半部分为各样品相对应的琼脂糖凝胶电泳检测。图2、3和4同。(a) M is marker; 1 to 7 indicate that reaction temperatures are 50.0, 51.4, 53.8, 57.5, 62.0, 65.9 and 68.5 ℃, respectively, 8 is negative control; (b) M is marker; 1 to 7 indicate that Reaction temperatures are 58.0, 58.6, 59.6, 61.1, 62.9, 64.4 and 65.4 ℃, respectively, 8 is negative control.The upper part of the figure is LAMP detection; The lower part of the figure shows agarose gel electrophoresis detection corresponding to each sample.Fig 2, 3 and 4 are the same.图2 Fof的LAMP反应温度优化Fig.2 The temperature optimization of Fof LAMP reaction
在最适温度条件下对Fof-LAMP的反应时间进行优化(图3)。结果表明,当反应时间在45 min以上时,Fof-LAMP就会发生反应且各时间段间荧光绿色亮度无异。将各时间段的LAMP反应产物进行琼脂糖凝胶电泳检测,可以看出当反应时间在60 min以上时,各时间段间电泳条带亮度无异。说明当LAMP反应时间在60 min时,Fof-LAMP已反应充分,所以Fof-LAMP的最适反应时间为60 min。

M为分子量标记;1~7表示反应时间分别为15、30、45、60、75、90和105 min,8为阴性对照。M is marker; 1 to 7 indicate that reaction time are 15, 30, 45,60, 75, 90 and 105 min, respectively, 8 is negative control.图3 Fof的LAMP反应时间优化Fig.3 The LAMP reaction time optimization of Fof
2.2 检测LAMP反应的特异性
使用LAMP引物对草莓上常见的病原菌进行LAMP特异性检测。结果表明,含有Fof的3个样品(1号)反应后在紫外灯下发出荧光绿色,且在琼脂糖凝胶电泳中有3条明亮的梯形条带(图4)。而2~16号中非目的病原菌反应后在紫外灯下未发出荧光绿色,且琼脂糖凝胶电泳无梯形条带,与17号阴性对照结果一致。故本研究设计的LAMP引物针对Fof具有良好的特异性。

M为分子量标记;1~16见表1各菌序号, 17为阴性对照。M is marker; 1 to 16 are Table 1 sequence number of pathogenic strains, 17 is negative control.图4 Fof的LAMP特异性检测Fig.4 Specificity test of Fof by LAMP assay
2.3 LAMP检测的灵敏度
以10倍梯度稀释的Fof-DNA为模板进行LAMP扩增,结果显示当DNA浓度为450 ng/μL、45 ng/μL、4.5 ng/μL、450 pg/μL和45 pg/μL时LAMP反应呈SYBR Green I绿色,琼脂糖凝胶电泳显示有梯形条带产生(图5(a)),而DNA的浓度为4.5 pg/μL、450 fg/μL、45 fg/μL和4.5 fg/μL时LAMP反应呈褐色的阴性反应,说明该反应体系最低可检测到的模板DNA浓度为45 pg/μL。而常规PCR扩增中,最低可检测到的模板DNA浓度也为45 pg/μL(图5(b))。因此,LAMP检测的灵敏度与常规PCR一致。

M为分子量标记;1~9表示DNA浓度分别为450 ng/μL、45 ng/μL、4.5 ng/μL、450 pg/μL、45 pg/μL、4.5 pg/μL、450 fg/μL、45 fg/μL和4.5 fg/μL,10为阴性对照。(a)上半部分为LAMP检测;下半部分为各样品相对应的琼脂糖凝胶电泳检测。(b)常规PCR检测。下同。M is marker; 1 to 9 indicated that the DNA concentrations are 450 ng/μL, 45 ng/μL, 4.5 ng/μL, 450 pg/μL, 45 pg/μL, 4.5 pg/μL, 450 fg/μL, 45 fg/μL and 4.5 fg/μL, respectively, 10 is negative control. (a) The upper part is LAMP detection; The lower part shows agarose gel electrophoresis detection corresponding to each sample on the upper part. (b)The conventional PCR assay. The same below.图5 Fof的LAMP灵敏度检测Fig.5 Sensitivity test of the LAMP assay for Fof
2.4 LAMP体系检测田间感病植株
分别从16株罹病草莓根茎部维管束病健交接处采集DNA将其作为模板进行LAMP和PCR检测。结果表明在Fof阳性模板以及2~13号发病植株的反应产物显现荧光绿色,且扩增出梯形DNA条带(图6(a));而阴性模板、健康草莓根茎模板以及14~17号发病植株反应产物为褐色,也没有扩增到梯形DNA条带。说明16株草莓感病植株中2~13号植株的病原菌是Fof, 而14~17号植株为其他病原菌。
同时,常规PCR检测结果表明LAMP反应呈现荧光绿的草莓植株根模板会扩增出一条大小为239 bp的DNA条带,其中2、5、6、7、8和9号病株DNA提取液中没有扩增出条带(图6(b))。可能是由于DNA提取液中Fof的含量过低。

M为分子量标记;1为阳性对照,2~17为草莓患病植株的模板DNA,18为健康植株的模板DNA,19为阴性对照。M is marker; 1 is postive control, 2-17 are template DNA from diseased stems of strawberry, 18 is template DNA from healthy stems, 19 is negative control.图6 Fof的LAMP田间检测Fig.6 Field susceptible plants test of the LAMP assay for Fof
3 讨论与结论
3.1 LAMP技术检测草莓枯萎的可行性
由F.oxysporumf. sp.fragariae引起的草莓枯萎病是一种严重的土传病害,仅通过早期症状难以辨认,而且症状一旦显现后,病害将无法控制,所以对该病害早期快速的检测显得尤为重要。传统的病原菌鉴定方法是通过组织分离法培养病原菌,对其进行PCR生物学鉴定,此法至少需要5~7 d完成,耗时过长[17],而LAMP法从采样到鉴定完成仅需1 d即可。LAMP检测技术因其独特优势,已被广泛用于检测各种植物病害,Duan等[18]使用HNB-LAMP技术对番茄灰霉病进行检测;Yang等[19]使用SYBR-Green I-LAMP实现了对梨黑斑病的快速检测;杨帆等[20]建立了青稞黑穗病的LAMP检测体系;Chen等[21]也是通过LAMP技术实现了对油橄榄炭疽病的快速检测。
3.2 LAMP技术染料的选择
LAMP反应过程会析出大量焦磷酸根离子,其与反应液中的Mg2+结合,形成乳白色焦磷酸镁沉淀。因此,可以通过观察反应液中是否形成白色混浊来判断靶序列是否存在[8],也可以向LAMP反应中添加核酸染料或金属离子指示剂,通过反应液颜色的变化来判断反应结果。如Katoh等[22]通过使用羟基萘酚蓝(HNB)对Fof的LAMP反应液进行显色处理,阴性反应呈紫色,阳性反应呈天蓝色。而本研究则使用SYBR Green I荧光染料对LAMP反应液进行显色处理,阴性反应呈褐色,阳性反应呈荧光绿色。与SYBR Green I荧光染料相比,HNB检测灵敏度较高,但反应前后显色不明显,不利于人们进行肉眼检测,且HNB的显色会根据LAMP反应中添加各试剂的来源厂家不同和添加比例不同而存在差异,所以通过HNB显色具有很强的主观性。使用SYBR Green I荧光染料对LAMP反应进行显色,会更加方便客观的实现对草莓枯萎病的检测。但由于SYBR Green I荧光染料需要在LAMP反应后添加到体系中,所以对添加染料的环境以及操作者的技术有要求,否则极易造成假阳性。
3.3 LAMP技术检测存在的问题
LAMP特异性检测共检测了16种草莓上常见的病原菌以及土传病原菌。其中胶孢炭疽菌、烟疫霉菌和拟盘多毛孢都可造成草莓致死,作为Fof的主要对照菌,而其他菌可能会在采样过程中污染样品,所以作为次要的区分对照菌。本研究所建立的LAMP检测方法可以将Fof与其他15种菌区分开,其特异性满足实际应用的需求。本研究也曾对Fof接种的土壤样品以及枯萎病田间土壤样品进行分别检测,但并未检测到Fof的存在。分析可能存在的原因:一是对土壤样品中Fof的提取率太低;二是Fof本身属于半活体营养型真菌,只有活体存在时才有利于Fof的增殖生存,所以土壤中病原菌很难被检测到。在对诸多病原菌的LAMP检测中,LAMP的检测灵敏度往往比普通的PCR检测高10~100倍。本研究在灵敏度检测试验中,由于Fof是纯模板且浓度高,普通PCR检测时长为1.5~2.0 h,而LAMP检测时长为1.0 h,不同方法中目的片段扩增量可能存在差异,使得普通PCR检测灵敏度与LAMP检测灵敏度相似。而在实际的田间检测中,2、5、6、7、8和9号病株只能被LAMP检测到,可见LAMP检测灵敏度仍是高于普通PCR。
综上所述,本研究开发的LAMP检测体系为草莓枯萎病综合防治提供了一条新的途径,未来还需要一种高灵敏度且可以提前检测土壤中是否含有Fof的方法,实现对草莓枯萎病的早发现和早防治。

