体外受精-胚胎移植妊娠后宫腔积血的多因素分析
赵明子,郝翠芳,杜鑫,朱文倩
(1.青岛大学医学部,青岛 266000;2.青岛大学附属妇女儿童医院,青岛 266000;3.滨州医学院,烟台 264003)
宫腔积血(Intrauterine hematoma),又称绒毛膜下血肿(subchorionic hematoma,SCH),指妊娠早期及中期绒毛膜(或胎盘底部)与子宫蜕膜间的出血,多伴有腹痛、阴道流血等临床表现。部分患者临床症状不明显,仅通过B超检查提示宫壁与孕囊之间的低回声液性暗区确诊。文献报道的SCH人群发病率为3.1%~48.0%[1-2],各报道间发生率差异较大与研究人群不同有关。接受人类辅助生殖技术(ART)治疗后SCH发病率显著增高[3-5];各研究中SCH发病率的差异可能是因为研究人群差异及统计学方法不同所致。目前,多项研究发现SCH患者发生前置胎盘、胎盘粘连、未足月胎膜早破、胎儿生长受限等不良妊娠结局的风险较正常女性显著增高[2,6-9],然而其病因及发生机制尚不明确。有文献指出,既往分娩史、宫腔操作史与SCH的发生密切相关[10];凝血功能异常患者较正常女性发生SCH的概率显著增加[11-12];另有研究表明,免疫失衡会影响胚胎滋养层细胞正常侵入,导致胚胎浅着床,进而增加SCH的发生风险[13];此外,双胎妊娠较单胎妊娠更易合并SCH[14-15]。上述研究均对患者年龄、体质量指数(BMI)等基线资料进行了对比或校正,但仅针对自然受孕人群开展,目前尚缺乏体外受精-胚胎移植(IVF-ET)治疗后SCH发生的相关因素分析。Zhou等[16]对IVF治疗后妊娠的女性开展研究发现,鲜胚移植周期中SCH的发病率显著高于冻融胚胎移植周期,认为鲜胚移植是SCH的高危因素之一;但是,并未进行SCH发生的单因素、多因素分析,鲜胚移植患者SCH发生的风险因素依旧不明。因此,本研究回顾性分析IVF周期中鲜胚移植后早孕女性的临床资料,探讨女方年龄、不孕类型、既往宫腔操作史、凝血功能、免疫功能等因素与SCH发生的关系,以期为IVF周期中SCH的发生评估及尽早诊断提供参考。
资料与方法
一、研究对象
收集2020年6月1日至2021年6月1日于青岛市妇女儿童医院生殖中心接受新鲜周期IVF-ET治疗后妊娠的402例女性为研究对象。纳入标准:(1)超声确诊宫内早孕;(2)本周期采用鲜胚移植方案。排除标准:(1)采用冻胚移植、供精-IVF(Donor-IVF)、卵胞浆内单精子注射(ICSI)等其它助孕方案;(2)超声提示未见胎心胎芽、胎心搏动缓慢或消失;(3)存在异位妊娠、宫内外复合妊娠;(4)合并子宫畸形(纵隔子宫、弓状子宫、单角子宫、双子宫及双角子宫等);(5)临床资料缺失、中途失访者。
二、研究方法
1.研究分组:根据早孕期B超影像学表现,将402例患者分为积血组(170例,42.3%)和对照组(232例,57.7%)两组。
早孕SCH的诊断标准:(1)移植后超声检查提示宫内孕囊,囊内可见胎芽且心管搏动规律;(2)孕周6~13+6周(根据患者移植时间或早孕B超推算,如两者相差>5 d则以B超为准);(3)超声提示SCH:绒毛膜与子宫肌层间可见低回声或无回声区(多为新月形),或线状/点状高回声区(若血肿较大且已形成血块)[6]。
2.观察指标:(1)一般资料:收集患者的年龄、BMI、不孕年限、不孕类型、宫腔手术史(指宫腔粘连分离、内膜息肉切除、子宫纵隔切除术等;人工流产及剖宫产术除外)、免疫系统疾病史、B超影像学资料。(2)实验室指标:进入胚胎移植治疗周期前行血清学检查,包括甲状腺功能五项[甲状腺过氧化物酶抗体(TPO-Ab)、甲状腺球蛋白抗体(TG-Ab)、血清游离三碘甲腺原氨酸(fT3)、血清游离四碘甲腺原氨酸(fT4)及血清促甲状腺素(TSH)]、凝血功能(凝血常规、血小板聚集功能)、免疫功能[抗可提取性核抗原(ENA)抗体谱、抗核抗体]及夫妻双方染色体核型。
三、统计学方法
结 果
一、一般资料
402例患者年龄21~44岁,平均(32.40±3.42)岁;BMI 17~36 kg/m2,平均(23.14±3.00)kg/m2;不孕年限1~15年,平均(3.65±2.44)年。积血组和对照组两组间平均年龄、BMI、不孕年限比较均无显著性差异(P>0.05)(表1)。
表1 两组一般资料比较(-±s)
二、单因素分析
对各不同因素进行分层分析发现,不同不孕类型、凝血功能、女方染色体、男方染色体各组间SCH发生率有显著性差异(P<0.05),继发性不孕、凝血功能异常、女方及男方染色体异常者SCH患病率显著增高(P<0.05);而不同年龄、不孕年限、BMI、甲状腺功能、妊娠囊个数等各组间无显著性差异(P>0.05),详见表2。
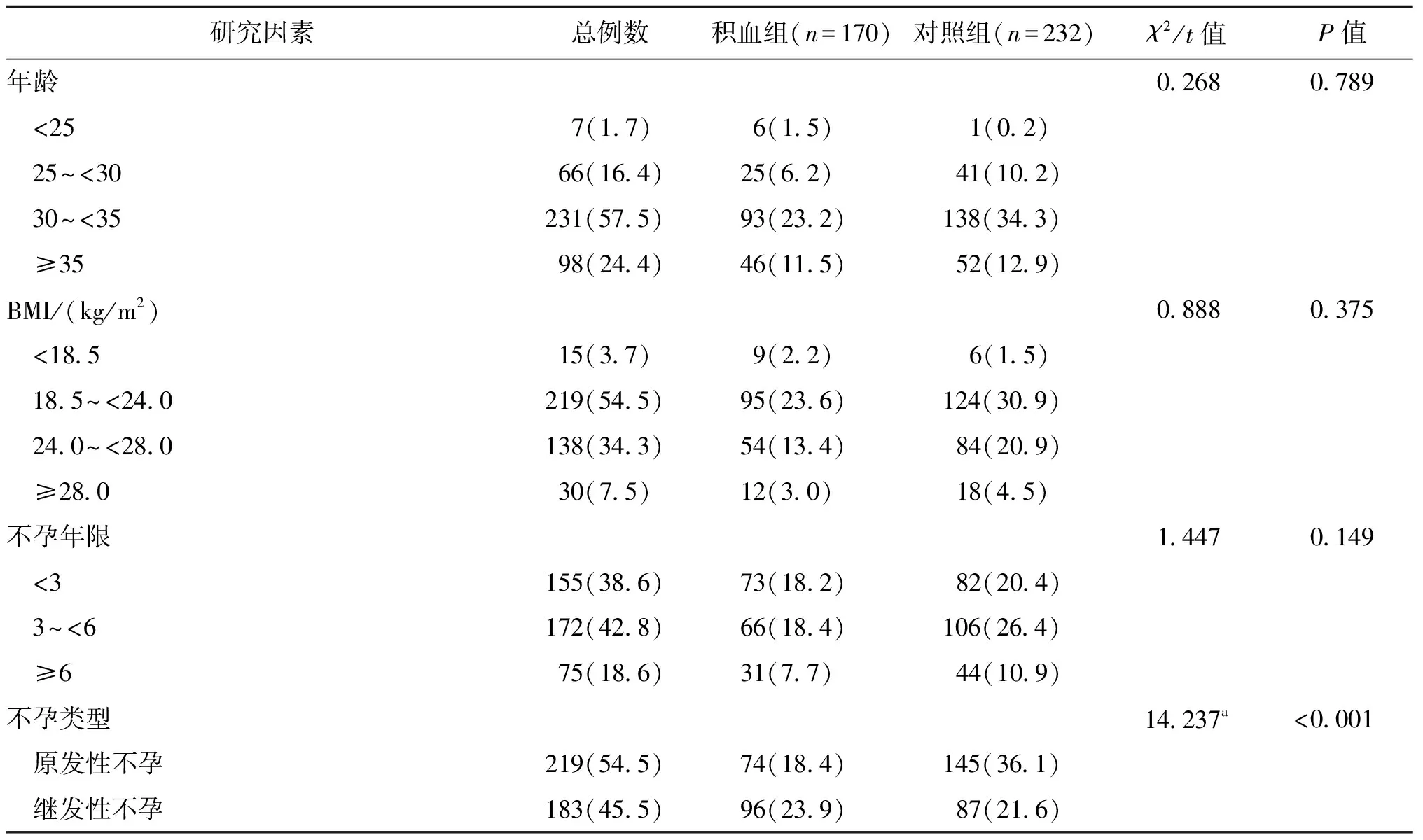
表2 各因素在两组间的分布及单因素比较[n(%)]

续表
三、多因素分析
将上述单因素分析中有统计学意义的因素纳入多因素分析,结果显示:继发性不孕女性SCH患病率显著高于原发性不孕女性(P=0.021,OR=1.794,95%CI:1.093~2.946);合并免疫功能异常女性SCH患病率显著高于免疫功能正常女性(P<0.001,OR=7.210,95%CI:3.732~13.928);凝血功能异常女性SCH患病率显著高于凝血功能正常女性(P<0.001,OR=4.255,95%CI:2.483~7.294);女方染色体呈现多态性或异常核型者SCH的患病率显著高于染色体正常(46,XX)女性(P=0.021,OR=2.045,95%CI:1.115~3.751);而男方染色体正常的女性与男方染色体异常的女性SCH患病率无显著性差异(P>0.05),详见表3。
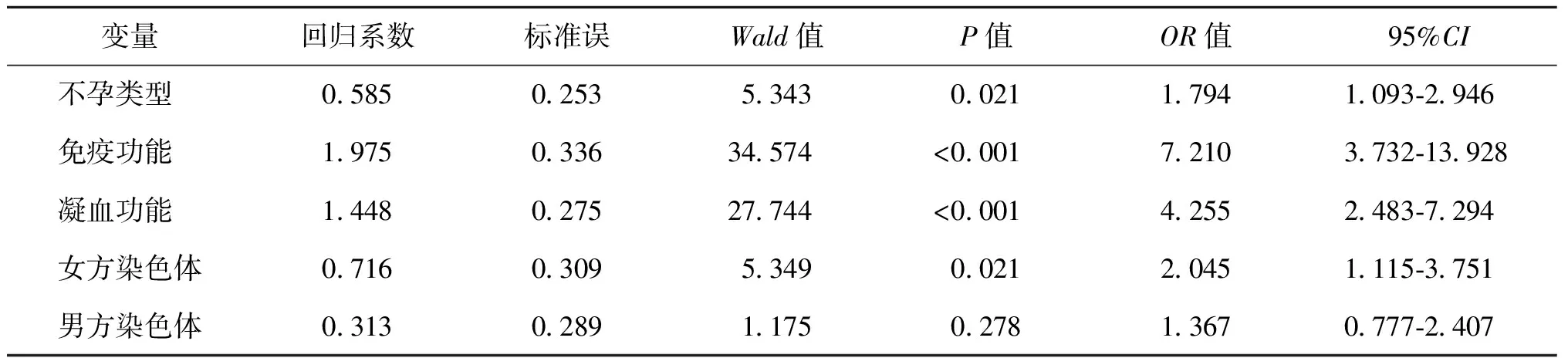
表3 SCH发生的多因素分析
讨 论
随着人类辅助生殖技术(ART)的发展,有数据显示,接受ART治疗的女性妊娠后SCH患病率显著高于自然受孕人群[3-5]。So等[10]研究指出,冻融胚胎移植(FET)妊娠合并SCH的女性发生前置胎盘、胎盘粘连的风险增加。接受ART治疗的人群孕期确诊SCH会加重患者的焦虑情绪,不利于维持良好的妊娠状态。目前诱导SCH发生的危险因素尚不明确,缺乏针对IVF人群的数据支持。因此,本研究回顾性分析402例接受IVF鲜胚移植助孕治疗后妊娠女性的临床资料,对11项相关因素进行单因素及多因素分析,最终提示不孕类型、凝血功能异常、免疫功能及女方染色体异常是SCH发生的独立危险因素,拓展了SCH的风险因素研究,为IVF周期中SCH的临床诊疗提供参考。
本研究结果显示,继发性不孕女性SCH发生率[23.9%(96/402)]显著高于原发性不孕女性[18.4%(74/402)](P<0.001)。Biesiada等[17]在研究中提出,经产妇SCH患病率约为63.25%,显著高于初产妇的43.75%;So等[10]对1 416例IVF-ET冻胚移植女性开展研究的结果表明,既往妊娠次数越多,SCH的发生率越高。之前还有文献报道,与原发性不孕患者相比,80.9%~81.2%的继发性不孕女性有过人工流产史[18-19]。这可能是因为人工流产术、妊娠及分娩史均可能对子宫内膜及子宫微环境造成不同程度的损伤,从而引起子宫内膜缺血、缺氧,血管形成障碍等,更易导致SCH的发生[20]。本研究中经多因素分析显示,继发性不孕女性合并SCH的概率是原发性不孕女性的1.794倍(P=0.021),且继发性不孕是SCH的独立危险因素;这与前述研究结果相符,且本研究将研究对象限定为鲜胚移植人群,进一步证实了既往宫腔损伤会增加SCH的患病风险。
本研究中凝血功能异常女性SCH发生率显著高于凝血功能正常女性(25.1% vs.17.2%,P<0.001)。已有较多文献报道,凝血功能异常可能与SCH发生有关,血栓前状态、血浆凝血酶原时间(PT)缩短、凝血因子缺乏的患者更易发生SCH[12,21-23]。患者血液高凝状态易形成血栓,从而导致子宫动脉氧供不足,血管内皮功能受损[11-12];当胚胎滋养层细胞侵袭子宫内膜时,绒毛膜与子宫蜕膜间血管破裂、出血,血液积聚于绒毛膜与蜕膜之间,进而形成宫腔内可见的新月形血肿[24]。本研究经多因素分析显示,凝血异常早孕女性SCH发病率为正常妊娠女性的4.255倍,再次验证了凝血功能在妊娠过程中的重要影响。
本研究中多因素回归分析结果显示,免疫功能异常女性SCH发生率是免疫功能正常女性的7.210倍。胡慧等[25]对妊娠早期重度SCH患者的病因进行分析,发现SCH患者中抗核抗体阳性等免疫功能异常者占30.0%(9/30),且抗核抗体与SCH关联密切,这与我们的结论相似。但Alijotas等[26]提出的观点相反,他们认为补体C4水平低、高丙种球蛋白血症是发生SCH的危险因素,抗核抗体与SCH的发生则无明显相关性。我们研究发现,免疫指标异常的95例患者中,抗ENA抗体谱阳性者占40.0%(38/95),抗核抗体阳性者占29.5%(28/95,且核型数量占比顺序为:核颗粒型>胞浆颗粒型>致密颗粒型),推测免疫亢进打破了子宫内膜与胚胎间的免疫耐受状态,不利于胚胎的正常侵入与妊娠,是SCH的潜在高风险因素[13]。然而,抗核抗体与SCH发生的关系各研究结果不尽一致,考虑与研究人群及样本量的差异有关。本研究仅收集我院单中心IVF鲜胚移植患者的临床资料,研究结论存在一定的局限性,后续还需更大样本量的多中心或随机对照试验(RCT)进一步明确抗核抗体与SCH发生的关系。
本研究将染色体异常分为染色体多态性改变及染色体核型异常两类。其中,染色体多态性包括短臂延长或缩短(p+/-)、9号染色体臂间倒位[inv(9)]、次缢痕增加(qh+);染色体核型异常包括结构及数目异常。在本研究纳入的402例女性中,SCH女性染色体(p+/-)多见于21、13、22号染色体,其次为1、14、15号染色体,少数为9号染色体(详见表2)。陈志恒等[27]、Madon等[28]的研究表明,染色体多态性、染色体核型异常与不孕不育、复发性流产、胚胎停育等异常生殖功能状态密切相关,且多见于D组(13、14、15号)染色体、G组(21、22号)染色体和1、16、9号染色体。我们的研究结果亦支持该结论,因此我们推测,对于染色体(p+/-)多态性变异患者,SCH可能为胚胎染色体分裂、分化过程中轻度变异的临床表现之一,是SCH发生的重要危险因素。然而,我们的研究纳入9号染色体多态性的样本例数较少,共纳入2例女方inv(9)样本,未见(qh+)样改变,男方未见inv(9)样改变。9号染色体与SCH的相关性尚需更多大样本临床数据加以验证。
综上所述,对于继发性不孕、IVF-ET移植前检查发现免疫功能异常、凝血功能异常及女方染色体异常的女性在助孕治疗获得妊娠后应警惕SCH的发生,提前告知患者SCH发生风险,并严密随访病情发展变化,以便及早发现及处理。

