直接进样测汞法测定即食海带中总汞的 不确定度评定
占文慧
(广东产品质量监督检验研究院,广东佛山 528300)
随着工业化进程的发展,工业活动引发的汞污染越来越引起重视[1]。空气、水质和土壤一旦受到汞的污染,就可能在海洋生物、水体中生物及农作物中富集,通过食物链对人体的神经系统、肝脏、肾脏等造成危害[1]。海带是生长在海水里的藻类植物,又称海洋蔬菜,含有人体所需的钙、磷、硒等营养元素,以及丰富的功能性物质,如褐藻酸、二十碳五烯酸、甘露醇、维生素(A、B、C和F)和牛磺酸等。海带既有食用价值,又有药用、保健、工业和农业价 值[2-3]。然而海带中蛋白质、甲壳胺和海藻酸等物质对水体中重金属有一定的吸附性能[4]。郑兴[5]发现海带对汞离子有很强的吸附性能。
《绿色食品 藻类及其制品》(NY/T 1709—2021)对藻类及其制品中甲基汞限量要求为0.5 mg/kg[6]。本文通过测定海带中总汞含量来评估甲基汞,当总汞含量低于甲基汞限量值时,可以明确甲基汞符合限量值,产品安全可靠[7]。
食品中汞的检测方法有直接测汞法[8]、ICP-MS法[9]、冷原子吸收法[10]、原子荧光光谱法[11-12]及双硫腙比色法[13]。除直接测汞法,其他检测方法都需要大量硝酸、硫酸和高氯酸,且具有分析时间长、试剂用量大、消化温度难以控制、对于易挥发元素汞容易造成损失、方法的灵敏度差和稳定性差等缺点。海带中汞含量属于痕量分析,应采用直接测汞法。直接测汞法具有快速、取样量少,灵敏度高、精度好和无试剂污染等优点,可直接进行样品测定[14-15]。因此本文采用直接测汞法测定即食海带中汞含量并对其进行不确定度分析。
1 材料与方法
1.1 材料与试剂
汞标准溶液(1 000 µg/mL,国家钢铁材料测试中心钢铁研究总院);硝酸(UPS级,68%,苏州晶瑞化学股份有限公司);重铬酸钾(GR,99.8%,阿拉丁);试验用水为Milli-Q净化系统过滤的纯水。
即食海带为超市采购。
1.2 仪器与设备
DMA-80 evo测汞仪(意大利Milestone公司);ME204电子天平(梅特勒-托利多仪器上海有限公司);Milli-Q超纯水纯化系统(美国Millipore公司)。
1.3 试验方法
1.3.1 样品处理
取5包样品混匀后,按四分法,分取6份样品匀浆,用作制样均匀性测量。从6份中选一份样品做12平行,其中6平行做测量重复性,另外6平行做加标样品。
1.3.2 样品测定
样品舟于马弗炉650 ℃烘30 min,冷却后用于称样。称取约0.1 g(精确至0.000 1 g)样品于样品舟中,进行上机检测。
1.3.3 仪器条件
DMA-80 evo测汞仪:干燥温度200 ℃,干燥时间60 s;分解温度650 ℃,分解时间60 s;齐化时间12 s;载气流量100 mL/min。
1.3.4 标准溶液的配制
取汞标准溶液1 000 mg/L,100 μL于100 mL容量 瓶中,用重铬酸钾的硝酸溶液(0.5 g/L)定容至刻度,配制成浓度为1 000 μg/L的汞标准使用液。用可调移液器分别吸取汞标准使用液0 mL、0.050 mL、0.100 mL、 0.150 mL、0.200 mL、0.300 mL、0.400 mL、0.500 mL、 0.750 mL、1.000 mL、1.250 mL、1.500 mL和2.00 mL于50 mL容量瓶中,得含汞浓度为0 μg/L、1.00 μg/L、2.00 μg/L、3.00 μg/L、4.00 μg/L、6.00 μg/L、8.00 μg/L、10.00 μg/L、15.00 μg/L、20.00 μg/L、25.00 μg/L、30.00 μg/L和40.00 μg/L的系列标准溶液。
用可调移液器分别吸取0.100 mL汞系列标准溶液置于样品舟中,其汞含量为0 ng、0.10 ng、0.20 ng、0.30 ng、0.40 ng、0.60 ng、0.80 ng、1.00 ng、1.50 ng、2.00 ng、2.50 ng、3.00 ng和4.00 ng。用同一样品舟,依次进样,上机时温度为25 ℃。
1.3.5 样品中汞的含量计算
样品中汞含量的计算如下:

式中:x为样品中汞含量,mg/kg;c为汞质量,ng;m为样品质量,g;
2 结果与分析
2.1 标准曲线拟合
汞校准曲线数据见表1。线性拟合回归方程为y=0.045 3c-0.000 5,相关系数r=0.999 3,其中,y为峰高、c为汞质量,a=-0.000 5,b=0.045 3。
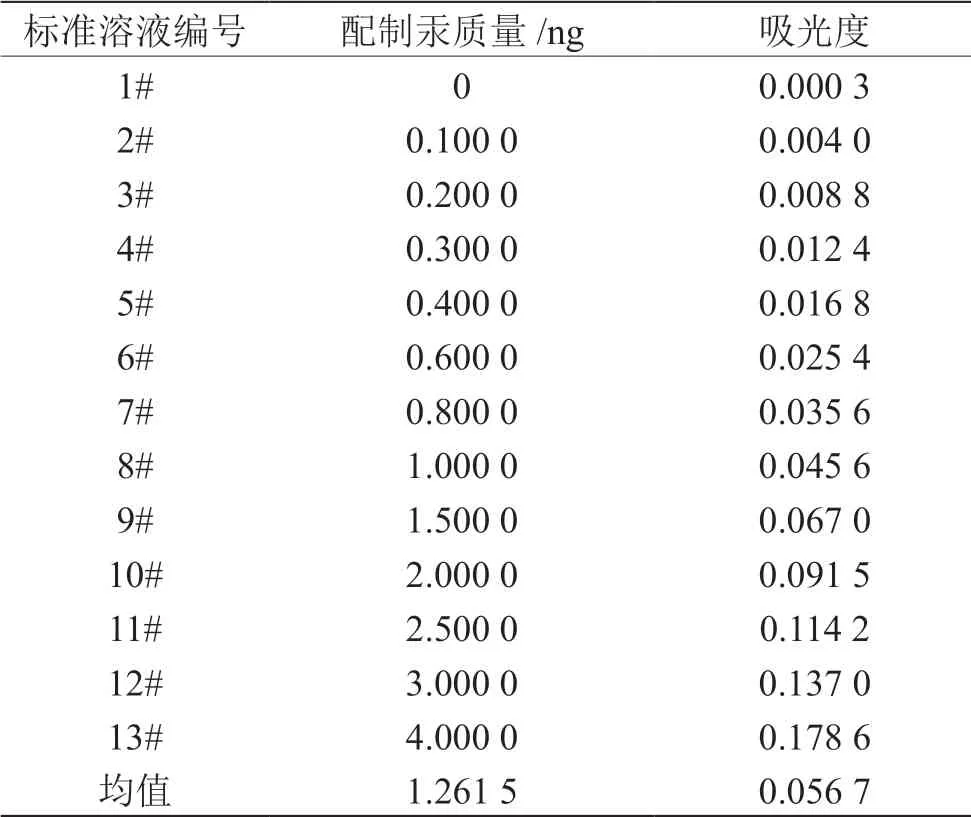
表1 标准曲线数据
2.2 方法验证
测量重复性见表2,平行测定6次,分别为 0.007 5 mg/kg、0.007 5 mg/kg、0.007 7 mg/kg、 0.007 2 mg/kg、0.007 4 mg/kg和0.007 3 mg/kg,6次相对标准偏差为2.36%,说明测量重复性好,精密度高,满足GB/T 27404—2008要求。制样均匀性结果见表3,样品测量值最小0.007 1 mg/kg,最大值 0.009 2 mg/kg,最大值与最小值之间偏差按平均值0.007 9 mg/kg来计算,为26.5%,说明样品均匀性不好。加标回收试验结果见表4,平行测定6次,贡加标量为0.8 ng,平均回收率为97.2%,相对标准偏差为3.21%,说明回收率高,加标回收试验精密度高。所用天平为万分天平,样品上机时温度为25 ℃。
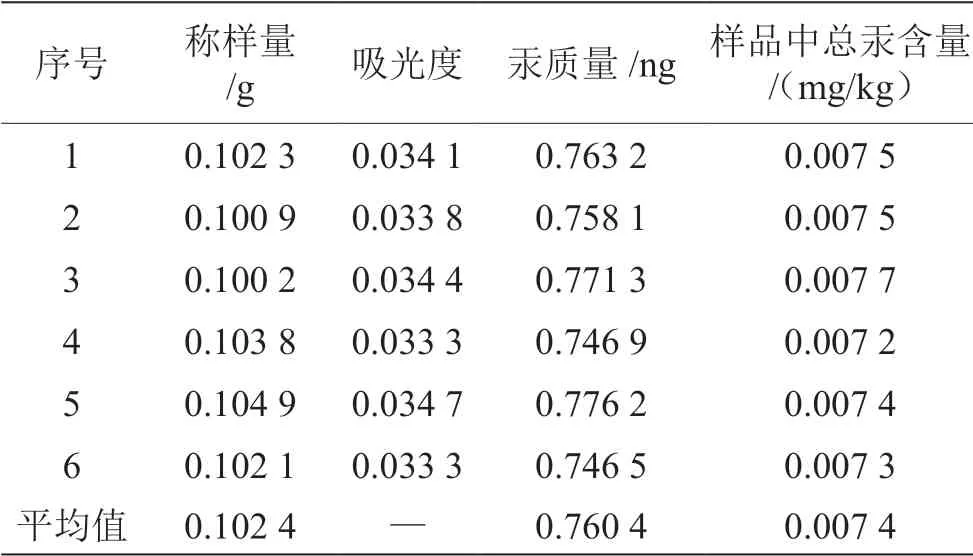
表2 即食海带中汞含量的重复测量结果

表3 制样均匀性测定结果(单位:mg/kg)
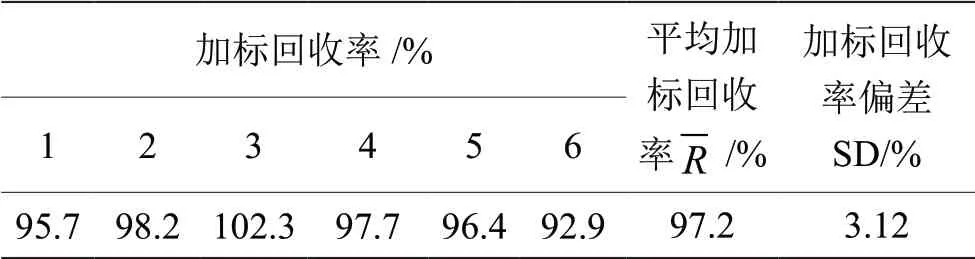
表4 加标回收试验结果
2.3 不确定度来源
根据公式(1)和样品测定过程,确定不确定度来源为:①天平称量的相对不确定度urel(m);②校准曲线拟合的相对不确定度urel(1);③标准品纯度的相对不确定度urel(2);④标准溶液配制的相对不确定度urel(3);④制样均匀性的相对不确定度urel(4);⑤测量重复性的相对不确定度urel(5);⑥方法回收率的相对不确定度urel(6)。
2.4 测量结果不确定度各分量的计算
2.4.1 天平称量urel(m)
查所用天平检定证书50 g以下的示值允差±下的示值允差,实测误差error=+0.1 mg,称量质量m为0.1 g的匀浆液或粉末,称量2次,一次调零,一次称样,按均匀分布,k=,则
由表2知本次即食海带样品称样量= 0.102 4 g,由天平称量引入的相对标准不确定度为
2.4.2 校准曲线拟合urel(1)
由工作曲线拟合时引入的试样中汞含量c的标准不确定度计算公式为:
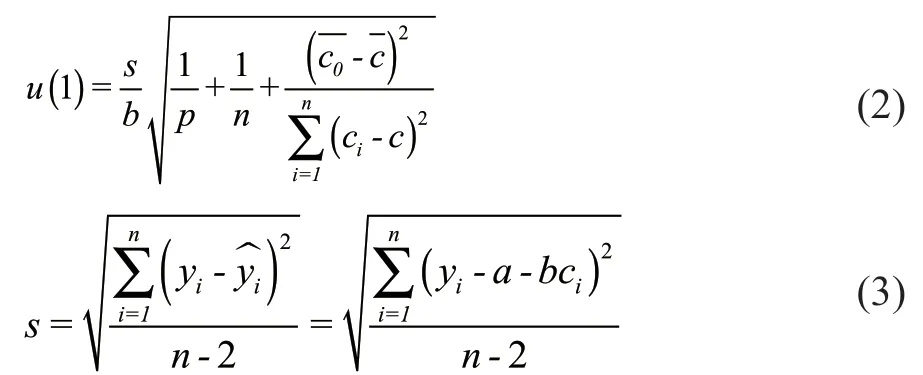
式中:s为校准曲线的剩余标准差;b为工作曲线的斜率;p为样品测量次数,日常p=2;n为建立工作曲线用标准溶液测量总次数;为样品浓度平均值;为校准曲线各点浓度的均值;ci为校准曲线各点的浓度值,yi为校准曲线的仪器信号值;为从校准曲线方程计算的仪器信号值。
将表1、表2对应数据代入公式(2)和(3)中,得s=0.001 182;
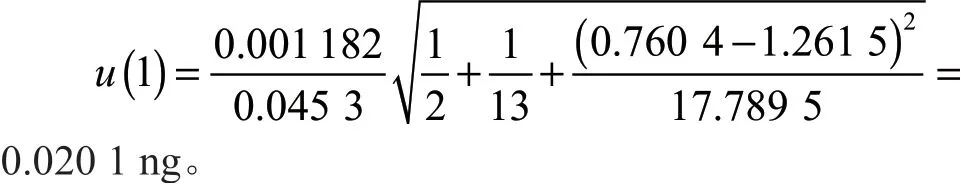
标准曲线拟合引入的相对不确定度为

2.4.3 标准品纯度urel(2)
从标准溶液证书上,查到汞标准溶液标准值 1 000 μg/mL,相对扩展不确定度U=0.4%(k=2)则汞标准溶液相对不确定度为urel(2)=U/2=0.004/2=0.002。
2.4.4 标准溶液配制urel(3)
由1.3.4可知,本次标准曲线配制过程中,使用100 mL容量瓶1次,50 mL容量瓶13次,200 μL移液器5次,移取体积分别为100 μL、50 μL、100 μL、 150 μL和200 μL;1 mL移液器5次,移取体积分别 为0.300 mL、0.400 mL、0.500 mL、0.750 mL和 1.000 mL;5 mL移液器3次,移取体积分别为 1.25 mL、1.50 mL、2.00 mL。
容量瓶、移液器体积引入的不确定度采用B类评定,20 ℃时允差为查计量规程所得[16-18]。100 mL 容量瓶20 ℃时允差为±0.2 mL;50 mL容量瓶20 ℃时允差为±0.1 mL;200 μL移液器,移取体积分别为100 μL、50 μL、100 μL、150 μL和200 μL时,20 ℃时允差分别为±2%、±3%、±2%、±2%和±1.5%; 1 mL移液器,移取体积分别为0.300 mL、0.400 mL、 0.500 mL、0.750 mL和1.000 mL时,20 ℃时允差分 别 为±1.5%、±1.5%、±1.0%、±1.0%和±1.0%;5 mL移液器,移取体积分别为1.25 mL、1.50 mL和 2.00 mL时,20 ℃时允差分别为±1.0%、±1.0%和±1.0%。
按 三 角 分 布 计 算k=,100 mL容 量 瓶体积引入的相对标准不确定度为;0.000 82 ;50 mL容量瓶体积引入的相对标准不确定度为=0.000 82;200 μL移 液器体积引入的相对标准不确定度为0.019 69;1 mL移液器体积引入的相对标准不确定度0.011 17;5 mL移液器体积引入的相对标准不确定度为为
实验室温度为25 ℃,水的膨胀系数为2.1× 10-4/℃,温度差异引起的体积变化,其不确定度按三角分布计算k=[19]。100 mL容量瓶、50 mL容量瓶、200 μL移液器、1 mL移液器和5 mL移液器与校正时温度不同引起的相对标准不确定度为
100 mL容量瓶相对标准不确定度为u2(100 mL容 量 瓶)=0.000 822+0.000 432=8.573×10-7;50 mL容量瓶相对标准不确定度为u2(50 mL容量瓶)= 0.000 822+0.000 432=8.573×10-7;200 μL移 液 器 相对标准不确定度为u2(200 mL移液器)=0.019 692+ 5×0.000 432=0.000 39;1 mL移液器相对标准不确定度为u2(1 mL移液器)=0.011 172+5×0.000 432=0.000 13; 5 mL移液器相对标准不确定度为u2(5 mL移液器)=0.017 12+3×0.000 432=0.000 05。
标准溶液配制引入的相对不确定度为
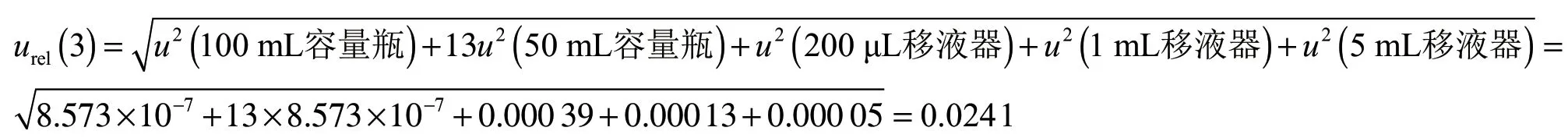
2.4.5 制样均匀性urel(4)
制样均匀性采用单因子方差分析[20],计算公式为:
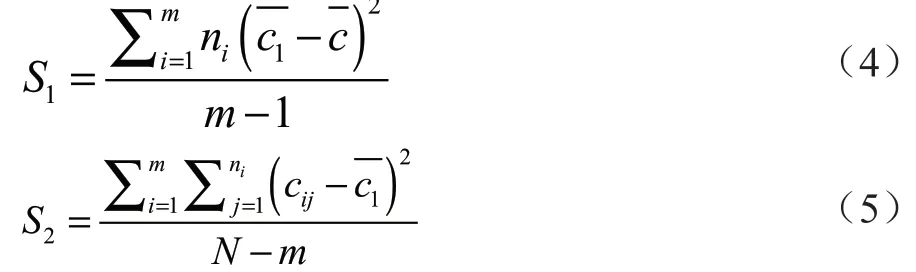
式中:S1为样品间方差;S2为样品内方差;m为样品数量;N为总测试次数;n为每个样品的测量次数。由表2和表3可知,m=6,N=12,n=2。
将表3数据带入公式(4)、(5)、(6)中得
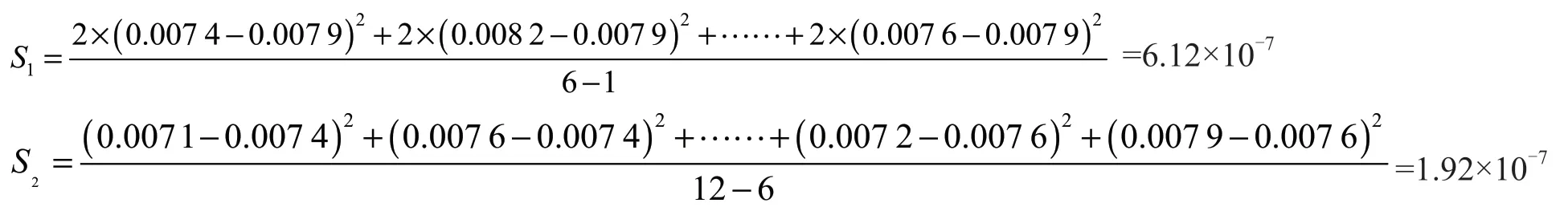
2.4.6 测量重复性urel(5)

式中:n为重复测定次数,n=6;N为本次检测用6次结果平均值作为最终结果,N=6。将表2数据代入公式(7)得

2.4.7 方法回收率urel(6)
方法回收率引入的相对不确定度为
2.5 标准不确定度的合成、扩展
由表5中各分量的相对标准不确定度,得出合成相对标准不确定度为:


表5 各分量的相对标准不确定度
合成标准不确定度为u(x)=×urel(x)=0.007 9× 1.069 4=0.000 55 mg/kg。取扩展因子为k=2(置信概率95%),得扩展不确定度U=0.000 55×2= 0.001 1 mg/kg;根据不确定度的评定,采用直接法测即食海带中汞含量的结果为x=(0.007 9±0.000 1) mg/kg(k=2)[19]。
3 讨论与结论
本文建立了直接法测即食海带中的汞,确定不确定度的来源并进行不确定度评估。从结果评定可知,制样均匀性、标准曲线拟合和标准曲线配制为不确定度主要来源。天平称量、标准纯度、测量重复性和加标回收率对测定结果影响较小。在日常检测中,在标准溶液配制和标准溶液上机检测时,要严格控制,如采用精度高并且计量合格容量瓶、移液管或是移液器等,标准溶液配制时应选择合适的浓度,尽量减少稀释步骤,从而减小由稀释过程引入的不确定度。在样品制样时,应注意不使试样污染,样品混合后,需用四分法进行 缩分[21-22]。

