白酸汤发酵过程中微生物多样性及有机酸动态变化研究
万宁威,雷帮星,李彪,杨悦,何劲*
1(贵阳学院 食品与制药工程学院,贵州 贵阳,550005)2(贵州大学 贵州省生化工程中心,贵州 贵阳,550025)
白酸汤是以大米、糯米为原料,由醋酸菌、乳酸菌、酵母菌等微生物发酵而成的传统调味品,具有酸鲜纯正、清凉爽口的独特风味,在西南地区广受欢迎[1],有悠久的食用历史。白酸汤含有丰富的益生菌、有机酸、矿物质、维生素等物质,对降低肠道pH、促进人体利用营养物质、抑制致病菌生长、调节肠道菌群、预防消化道疾病等有重要作用[2-5]。然而长期以来,白酸汤大都是小作坊生产,为数不多的酸汤企业采用的也都是传统自然发酵,生产规模小、发酵周期长、受环境影响大、酸汤质量不稳定,严重限制了白酸汤大规模工业化生产[6]。
近几年,关于白酸汤中微生物群落和有机酸组成的研究越来越多,但对其相关性分析的文献极少。熊瑛等[7]对贵州5个不同地区酸汤中的有机酸进行测定,发现乳酸占总酸70%以上,其次为乙酸、柠檬酸。石敏等[8]通过传统分离、计数法发现凯里白酸汤中优势微生物有乳杆菌、明串珠菌和醋酸杆菌。随着生物技术的迅猛发展,宏基因技术越来越多的被应用于发酵食品中,发酵食品中复杂的微生物群落组成、变化以及功能被越来越多的学者关注[9-10]。本实验采用高通量测序技术对白酸汤发酵过程中微生物群落组成进行分析,同时通过高效液相色谱法测定其有机酸含量,并采用双向正交偏最小二乘法(orthogonal function partial least squares,O2PLS)对微生物群落变化和有机酸含量之间的相关性进行分析,确定与有机酸含量相关性高的微生物种类。为进一步筛选、分离白酸汤中优势微生物菌种,为直投式发酵剂研发,实现白酸汤发酵过程的精准调控,提高白酸汤产品生产效率与品质提供理论依据。
1 材料与方法
1.1 材料与试剂
老酸汤,贵州亮欢寨生物科技有限公司;安琪甜酒曲,安琪酵母股份有限公司;糯米粉,市售;甲醇,安徽天地高纯溶剂有限公司;活性炭,重庆川东化工(集团)有限公司;磷酸、乳酸、苹果酸,天津市科密欧化学试剂有限公司;乙酸,成都金山化学试剂有限公司;丁二酸,天津市大茂化学试剂厂。
1.2 仪器设备
LDZM-60L型立式高压蒸汽灭菌器,上海申安医疗器械厂;SPX-150BⅢ型生化培养箱,天津市泰斯特仪器有限公司;LC-20A型高效液相色谱仪、SPD-M20A型二极管阵列检测器,日本岛津公司;TGL-16M型台式高速冷冻离心机,湖南平凡科技有限公司。
1.3 试验方法
1.3.1 白酸汤制作工艺流程及操作要点
原料→煮沸→冷却→液化→灭菌→冷却→接种老酸汤→36 ℃恒温培养→白酸汤
操作要点:原料中糯米粉和水的料液比为1∶50(g∶mL);安琪甜酒曲添加量为0.4%;老酸汤接种量为10%;每24 h取样,-18 ℃冻存备用。
1.3.2 有机酸测定
采用高效液相色谱法[7],称取酸汤样品10 g,加入活性炭0.2 g,纯净水定容至50 mL,振荡混匀,5 000 r/min离心10 min,上清液0.22 μm水系滤膜过滤,测定乳酸、乙酸、苹果酸和丁二酸含量。
1.3.3 微生物多样性测定
将所采集样本送往生工生物工程(上海)股份有限公司进行测定处理。具体测定流程为:微生物总DNA提取,对细菌基因组V3~V4区使用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)、反向引物806R(5′-GGACTACHVGGTWTCTAAT-3′)进行扩增,真菌ITS区使用正向引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)、反向引物ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)进行扩增[11-13],将扩增产物进行回收纯化,荧光定量处理,在Illumina MiSeq平台上对其进行测序。
数据处理与分析:使用SMRT Link软件,将所有的subreads进行相互比对和质量校正,自我纠错后得到高质量的一致性序列CCS reads,根据双端barcode标签序列识别并区分样品得到各样本数据。然后将其进行聚类,其中相似性≥97%的序列归为1个OTU,将OTU代表序列与Silva数据库[14]进行比对和物种注释,最后对有效数据进行OTUs丰度、Alpha和Beta多样性等分析。
1.3.4 数据处理
分别采用系统软件SPSS和SIMCA-p进行显著性和相关性分析。
2 结果与分析
2.1 白酸汤发酵过程中有机酸含量变化
在白酸汤发酵过程中,有机酸总量呈逐渐上升的趋势,如图1所示,6 d后有机酸含量保持不变,说明此时白酸汤发酵基本结束。其中乳酸和乙酸含量随着发酵时间增加而稳定增长,在第6天均达最大值,分别为5.58和1.04 mg/mL;苹果酸含量先降后增,在第0天时为0.17 mg/mL,第3天降至0.09 mg/mL,4~6 d逐渐增长,最终含量为0.19 mg/mL;丁二酸在0~3 d时未检出,4~6 d随发酵时间呈直线上升,在第6天达到最高为0.33 mg/mL。乳酸和乙酸含量在白酸汤发酵过程中占有机酸总含量的95%以上,是白酸汤中主要有机酸。

图1 白酸汤发酵过程中有机酸含量变化Fig.1 Changes of organic acid content during fermentation of white acid soup
2.2 白酸汤发酵过程中微生物变化
2.2.1 白酸汤发酵过程中微生物的α多样性分析
Chao指数和Ace指数可以用来评价菌群丰富度[15],如表1所示,在白酸汤发酵过程中,细菌的物种丰富度呈先升高后降低的趋势,Ace指数在第3天时最高为111,比第0天增长了81.97%,在第8天时降至0;Chao指数在第5天时最高为129,比第0天增长了111.48%,在第8天时降低至63。真菌物种丰富度随发酵时间增长而持续降低,在第0天时 Chao指数和Ace指数为50.07和49.75,在第8天时为38.13和37.75,分别降低了23.85%和24.12%。
菌群多样性通过Shannon指数和Simpson指数来评价[16]。细菌物种多样性随发酵时间的变化也呈现先增加后减小的趋势,Simpson指数变化不明显,Shannon指数在第5天达到最大为4.73,后持续减小,第8天时降至3.81。Shannon指数显示真菌物种多样性在第0天时最高为1.77,后持续降低至0.87。Simpson指数显示真菌物种多样性在第4天时最高为0.46,比第0 天增长了109.09%。
细菌的Ace指数、Chao指数及Shannon指数均大于真菌,说明细菌菌群丰富度和物种多样性均大于真菌,由此可见细菌在白酸汤发酵过程中发挥的作用更大。石敏等[8]在研究中发现,白酸汤在发酵1~4 d有效酸度和总酸含量持续增加,总糖含量持续降低,在第5天后趋于平缓。本实验中,在白酸汤发酵5 d时,物种丰富度及多样性最高,微生物大量繁殖,推测是米汤中营养成分被快速消耗,后续无法满足更多菌群的生长需求,导致微生物生长受到抑制。
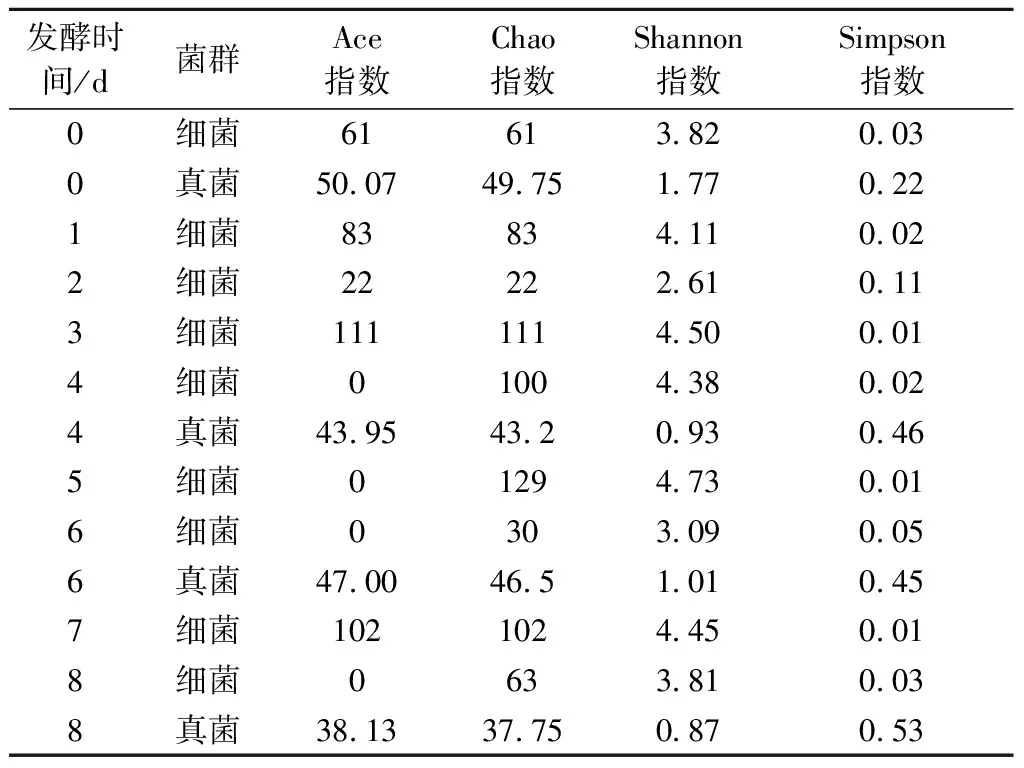
表1 发酵过程中的微生物α多样性分析Table 1 Analysis of microbial α diversity during fermentation
2.2.2 白酸汤发酵过程中微生物β多样性分析
对发酵不同时间的白酸汤进行种水平上的层级聚类分析,探究发酵过程中微生物群落结构变化,结果如图2所示。

a-细菌;b-真菌图2 白酸汤发酵过程中种水平上的层级聚类Fig.2 Hierarchical clustering on species level in the fermentation of white sour soup
样品之间越接近,其种水平上的结构就越相似,3~6 d,7~8 d 和 0~2 d 的细菌菌群分为3簇,有明显差异性。0、4、6~8 d 的真菌菌群也分为3簇且差异性显著。由此说明,白酸汤发酵主要经历前(0~2 d)、中(3~6 d)、后(6~8 d)3个阶段,且这3个阶段微生物群落结构差异显著。发酵前期,细菌优势菌群为维氏乳杆菌(Lactobacillusvini)和罗旺醋杆菌(Acetobacterlovaniensis),真菌物种多样性在此期间最高,优势菌群有毛榛毕赤酵母(Pichiamandshurica)、桔假丝酵母(Candidaquercitrusa)和矮小假丝酵母(Kazachstaniahumilis)。发酵中期,细菌物种多样性最高,优势菌群为法式醋酸杆菌(Acetobacterfarinalis)、布氏乳杆菌(Lactobacillusbuchneri)、类谷糠乳杆菌(Lactobacillusparafarraginis)和液化葡糖酸醋酸杆菌(Gluconacetobacterliquefaciens),真菌优势菌群为毛榛毕赤酵母。发酵后期,细菌优势菌群为维氏乳杆菌和法式醋酸杆菌,真菌优势菌群为毛榛毕赤酵母。
2.2.3 群落结构组分分析
如图3所示,白酸汤中细菌组成在种水平上主要有维氏乳杆菌(Lactobacillusvini)、法式醋酸杆菌(Acetobacterfarinalis)、布氏乳杆菌(Lactobacillusbuchneri)、罗旺醋杆菌(Acetobacterlovaniensis)、发酵乳杆菌(Lactobacillusfermentum)、副干酪乳杆菌(Lactobacillusparacasei)、解淀粉乳杆菌(Lactobacillusamylolyticus)等12种菌种。发酵前期优势菌群为维氏乳杆菌和罗旺醋杆菌,其丰度分别为41.66%、23.53%,维氏乳杆菌比第0天增长了314.11%。法式醋酸杆菌和布氏乳杆菌是发酵中期的优势菌群,其丰度分别达到25.08%和32.16%,类谷糠乳杆菌(Lactobacillusparafarraginis)和液化葡糖酸醋酸杆菌(Gluconacetobacterliquefaciens)在此期间丰度也达到最大分别为10.8%和10.5%。发酵后期维氏乳杆菌和法式醋酸杆菌的丰度达到80%,说明在发酵后期维氏乳杆菌和法式醋酸杆菌起主导作用。
白酸汤中真菌的物种多样性比细菌少,在种水平上主要有毛榛毕赤酵母(Pichiamandshurica)、桔假丝酵母(Candidaquercitrusa)、矮小假丝酵母(Kazachstaniahumilis)、膜醭毕赤酵母(Pichiamembranifaciens)、Zygoascusmeyerae、三角酵母(Trigonopsisvariabilis)。白酸汤第0天优势菌群为毛榛毕赤酵母、桔假丝酵母、矮小假丝酵母,其占比分别为12.4%、20.2%、14.8%,发酵过程中,毛榛毕赤酵母迅速繁殖成为发酵中后期优势菌群,在第8天时丰度达到77.9%。三角酵母相对丰度也由0.04%增长至1.08%。其他酵母生长均被抑制。

a-细菌;b-真菌图3 白酸汤发酵过程中种水平细菌及真菌相对丰度变化Fig.3 Changes of relative abundance of bacteria and fungi at species level during fermentation of white sour soup
王琪琪等[17]研究结果表明:白酸汤中优势细菌为哈氏乳杆菌(Lactobacillusharbinensis,43.46%)、布氏乳杆菌(Lactobacillusbuchneri,31.25%)等,优势真菌为膜璞毕赤酵母(Pichiamembranifaciens,88.31%)和博伊丁假丝酵母(Candidaboidinii,6.39%)。与本实验结果相比,在属水平上一致,在种水平上有明显差异,可见白酸汤发酵菌种的多样性。白酸汤是以大米、糯米为原料,由醋酸菌、乳酸菌、酵母菌等微生物发酵而成,但是不同公司的白酸汤主要发酵菌种不一致,这可能是导致市售白酸汤风味不统一的重要原因。
2.2.4 有机酸及优势菌群相关性分析
2.2.4.1 白酸汤发酵过程与有机酸相关的微生物重要性指标分析
利用O2PLS[18]模型对细菌和真菌相对丰度与有机酸含量进行相关性分析,获得菌群丰度与有机酸含量相关性的自变量重要性指标[变量投影重要性(variable importance projection,VIP)(pred)]。如图4所示,细菌和真菌的VIP(pred)均在0.5~1.5。大于1.4的有2个种,在1.3~1.4的有4个种,在1.2~1.3的有2个种,在1.0~1.2的有7个种。其中法式醋酸杆菌、维氏乳酸杆菌与有机酸相关重要性最高,选VIP(pred)值>1的15个种进行与有机酸相关的分析。
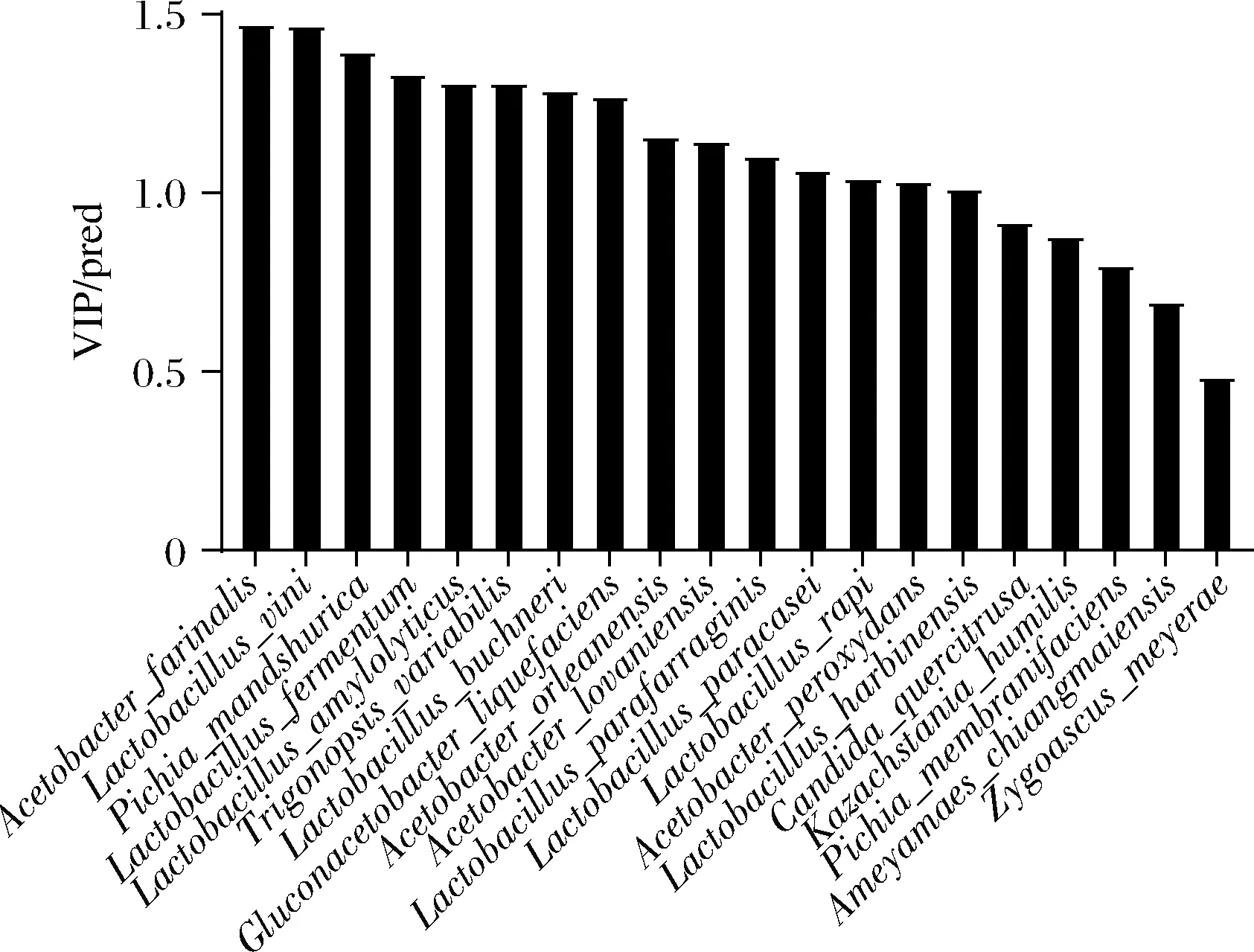
图4 与有机酸相关的微生物VIP分析Fig.4 Microbial VIP analysis related to organic acids
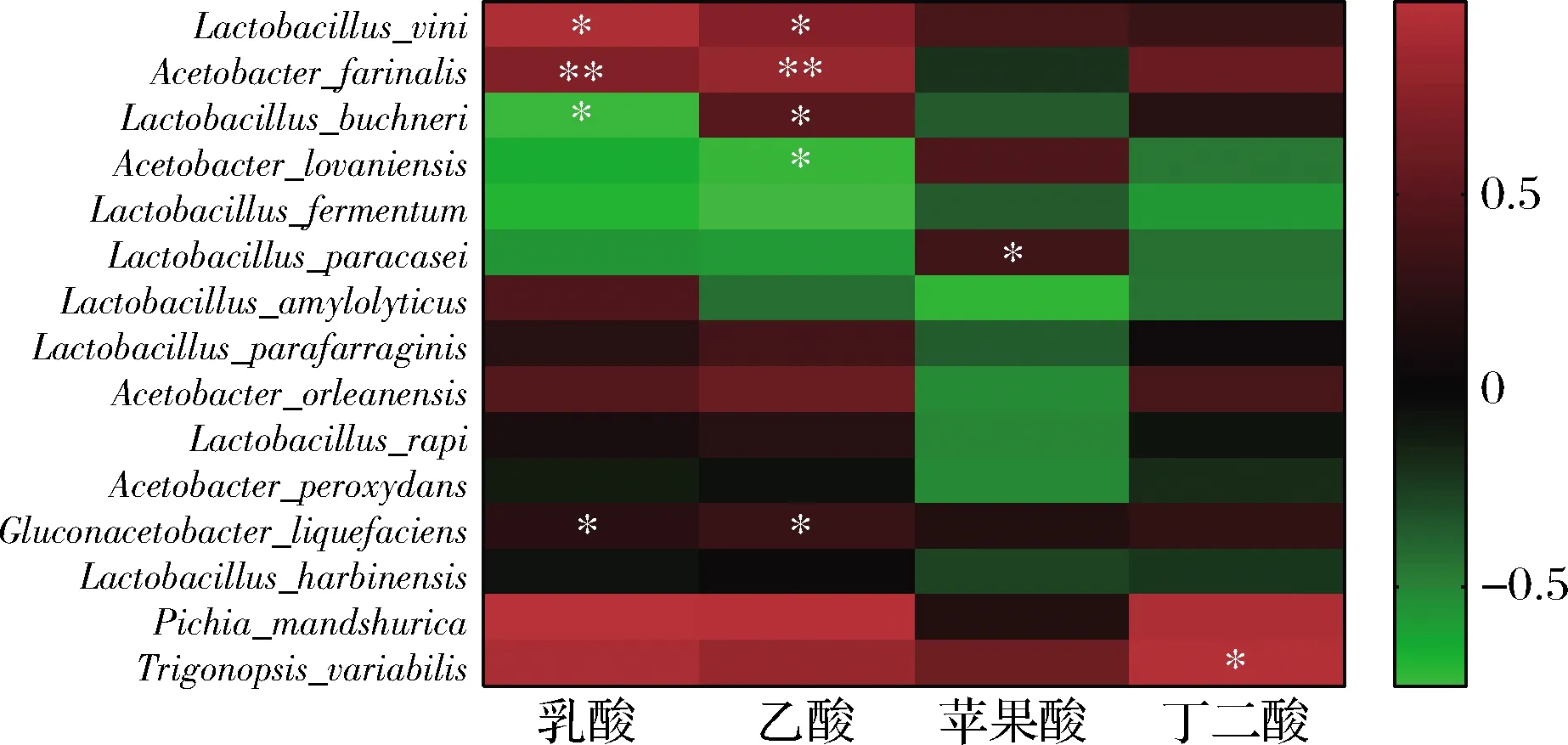
图5 微生物与有机酸相关性系数热图Fig.5 Correlation coefficient heatmap of microorganisms and organic acids 注:*代表微生物与有机酸之间差异显著(P<0.05); **代表差异极显著(P<0.01)
2.2.4.2 白酸汤发酵过程与有机酸相关微生物分析
选取VIP(pred)值>1的细菌和真菌(种)与有机酸进行相关性分析,结果如图5所示。
与乳酸呈正相关的有9个种,负相关9个种,维氏乳杆菌与乳酸含量极显著正相关(P<0.01);与乙酸正相关的有10个种,负相关有8个种,法式醋酸杆菌与乙酸含量极显著正相关(P<0.01);与苹果酸正相关的有9个种,负相关9个种,解淀粉乳杆菌与苹果酸含量显著负相关(P<0.05);与丁二酸正相关的有8个种,负相关10个种,三角酵母与丁二酸含量显著正相关(P<0.05)。本实验采用静置发酵,因此:发酵初期,发酵液中可能积累了米汤液化后的糖类物质,维氏乳杆菌经过厌氧发酵产生大量乳酸,因此维氏乳杆菌和乳酸极显著正相关。随着发酵的进行,布氏乳杆菌经过异型发酵将乳酸转化乙酸和乙醇[19],因此布氏乳杆菌和乳酸显著负相关,与乙酸正相关。发酵中后期,由于乙醇的产生和发酵液酸度的降低等原因维氏乳杆菌、布氏乳杆菌等乳杆菌生长受到抑制,法式醋酸杆菌、罗旺醋酸杆菌大量繁殖,乙酸累积,因此醋酸杆菌与乙酸显著正相关。苹果酸和丁二酸为三羧酸循环的产物,在产生的同时又作为其他代谢途径的原料被消耗,所以没有大量累积。酵母菌在发酵过程中能代谢产生氨基酸、酶、乙醇等物质,为其他微生物的生长提供碳源和氮源[20],毛榛毕赤酵母含量和乳酸、乙酸含量呈现显著正相关,三角酵母和丁二酸含量也呈现显著正相关(P<0.05)。
3 讨论与结论
白酸汤产品在西南地区广受欢迎,但其发酵机理和发酵工艺尚不明确,生产模式也尚未统一。因此,探索白酸汤发酵过程中微生物的多样性及有机酸含量动态变化规律、分离优势菌株、开发人工可控发酵白酸汤,具有十分重要的理论意义和实践应用价值。
通过高通量测序技术和高效液相色谱法对白酸汤发酵不同时期样品的微生物多样性和有机酸含量进行测定,并利用双向正交偏最小二乘法(O2PLS)对微生物相对丰度与有机酸含量相关性进行分析。结果表明,白酸汤发酵过程中微生物种类丰富,细菌的生物多样性远远大于真菌生物多样性。通过在种水平分析细菌和真菌在发酵过程中的种类和丰度,并与有机酸含量相关性进行分析推测,发酵前期,维氏乳杆菌能迅速适应新环境,大量繁殖,丰度达到41.66%,主要发酵产物乳酸降低了酸汤中pH,同时还参与发酵过程中氨基酸代谢[21-22],丰富了产品风味。毛榛毕赤酵母和桔假丝酵母生长良好,它们能够参与碳水化合物代谢和酯类物质形成,对产品的香气和风味有重要作用[23],桔假丝酵母可以通过Ehrlich途径代谢产生氨基酸小分子,比其他酵母产生的风味物质更多[24]。发酵中期,经过前期乳酸发酵和乙醇发酵后,酸度的降低和乙醇、乳酸的积累为法式醋酸杆菌和布氏乳杆菌的生长提供了适宜的碳源和环境,其丰度分别达到 25.08%和32.16%,积累一定量的乙酸。类谷糠乳杆菌和液化葡糖酸醋酸杆菌在此期间丰度达到最大分别为10.8%和10.5%,类谷糠乳杆菌的代谢产物能够抑制致病菌和腐败酵母菌的生长[25],液化葡糖酸醋酸杆菌有多种酶类,可产生多种影响发酵过程中抗氧化性能变化的重要化合物[26]。发酵后期,随着发酵的进行,白酸汤中营养成分消耗以及pH值持续下降,许多不耐酸细菌和真菌受到抑制,经过白酸汤环境的多重选择,白酸汤中微生物趋于稳定,维氏乳杆菌和法式醋酸杆菌的丰度达到80%,毛榛毕赤酵母丰度达到77.9%,说明在白酸汤发酵后期维氏乳杆菌、法式醋酸杆菌和毛榛毕赤酵母起主导作用。
综上所述,本研究揭示了白酸汤发酵过程中与有机酸含量相关性较高的功能微生物为维氏乳杆菌、法式醋酸杆菌和毛榛毕赤酵母,为进一步筛选、分离白酸汤中优势微生物菌种,研发直投式发酵剂,为实现白酸汤发酵过程的精准调控,提升白酸汤品质稳定性提供理论依据。

