水提藤椒挥发油的成分分析以及抗氧化和抑菌活性研究
程思,罗园,罗莎杰,代建刚,李美凤,饶朝龙,陈艳*
1(成都中医药大学 公共卫生学院,四川 成都,611130)2(成都中医药大学 医学技术学院,四川 成都,611130)
藤椒,学名竹叶花椒(ZanthoxylumarmatureDC.),属于芸香科花椒属花椒亚属,是我国花椒种质资源中的特色品种,具有独特的麻香风味[1]。四川省洪雅县是我国最大的藤椒产地。近年来,形成了以四川洪雅藤椒油为调味料的“藤椒菜品”系列[2]。已有研究表明,藤椒中主要有效成分为挥发油、生物碱、木脂素和酰胺类物质等[3]。藤椒除果实可食用外,其根、茎、叶具有多种药用特性,传统上用于疾病治疗,如驱虫、解热、开胃、胃痛、消化不良和牙痛[4]。
目前,人们将天然抗氧化成分和抑菌材料(如药食同源中药材和天然香料提取物)用于食品和日化品工业中的兴趣与日俱增[5]。藤椒挥发油作为天然产物,评价其抗氧化活性,对其在食品和日化领域的开发应用具有重要的指导意义。另外,病原微生物易引起食品变质和食物中毒,对人类健康造成危害,导致巨大的经济损失。因此,天然抑菌剂的开发应用对保障人体健康也起着重要作用。
藤椒挥发油是表征藤椒香气强度的主要指标,并且具有抗氧化、抑菌和抗炎等生物活性[6]。目前,国内外对藤椒挥发油的研究主要集中在比较不同提取方法对藤椒挥发油得率的影响,不同品种、产地、检测条件等对藤椒挥发油成分分析的影响及其部分生物活性的研究,还没有关于藤椒挥发油对微生物生长作用机理的报道[7]。因此,本研究通过GC-MS分析水提藤椒挥发油的化学成分,采用体外试验评估其抗氧化和抑菌能力,并通过OD值测定致病菌生长以及扫描电子显微镜(scanning electron microscope,SEM)观察菌体形态,进一步探究其抗菌活性及可能的作用机制。
1 材料与方法
1.1 材料与仪器
鲜藤椒,四川省洪雅县;Na2SO4、赤血盐钾、FeSO4·7H2O、维生素C、浓盐酸、无水酒精、FeCl3、Na2HPO4、三氯醋酸、NaH2PO4、NaOH、H2O2、2-羟基苯甲酸、连苯三酚、二甲基酮、DPPH、三羟甲基氨基甲烷[tris (hydroxymethyl) methyl aminomethane THAM,Tris],均为分析纯,成都科龙化学试剂公司;营养琼脂、营养肉汤,北京奥博星生物技术有限公司;金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、鼠伤寒沙门氏菌(Salmonellaenterica)、产气肠杆菌(Enterobacteraerogenes)、痢疾志贺氏菌(Shigellacastellani),由成都中医药大学医学技术学院微生物实验室提供。
气相色谱-质谱联用仪,美国安捷伦公司;医用离心机,上海菲恰尔分析仪器有限公司;紫外分光光度计,上海元析仪器有限公司;L2S可见分光光度计,上海仪电(集团)有限公司;THZ-92A台式恒温振荡器,上海跃进医疗器械有限公司;303As-1电热恒温培养箱,上海浦东荣丰科学仪器有限公司;XW-80A旋涡混合器,上海青浦沪西仪器厂;SU-3500扫描电镜,日立株式会社。
1.2 实验方法
1.2.1 藤椒挥发油的提取
将清理干净的藤椒,去除藤椒籽粒,只保留果皮。准确称取60.00 g藤椒果皮,在1 000 mL平底烧瓶中加入600 mL蒸馏水和玻璃珠数颗,连接挥发油提取器,同时将蒸馏接收器注满蒸馏水,随后缓慢加热平底烧瓶。4 h后冷却至室温,从接收管中获得藤椒挥发油粗品[1]。向藤椒挥发油粗品中加入0.05 g的Na2SO4,在常温下静置12 h后,通过0.22 μm的微孔过滤膜滤去Na2SO4,备用。
1.2.2 挥发油的GC-MS分析
1.2.2.1 GC/MS检测条件
参照陈艳等[8]的方法,具体条件如下:
①色谱条件:HP-5MS石英色谱柱(30 m×250 μm×0.25 μm),进样口温度280 ℃;升温程序:起始柱温60 ℃,保持2 min,以5 ℃/min升温到130 ℃,然后以20 ℃/min升温到280 ℃;载气为高纯氦气(纯度为99.999%),流速1 mL/min,进样量1 μL,分流比20∶1。
②质谱条件:电子轰击离子源,电子能量70 eV,离子温度230 ℃,四级杆温度150 ℃,质量扫描m/z35~550。扫描方式:全扫描;溶剂延迟3 min。调谐文件为自动调谐。
1.2.2.2 GC-MS分析方法
将得到的藤椒挥发油总离子流图结合每个峰保留时间,在计算机质谱数据库进行检索,将得到的CAS号在http://www.ichemistry.cn上进行检索获得具体化合物信息。
1.2.3 藤椒挥发油体外抗氧化活性测定
1.2.4 藤椒挥发油抑菌活性测定
1.2.4.1 抑菌圈直径(diameter of inhibitory zone,DIZ)的测定
滤纸片法:用打孔器将滤纸制成直径为6 mm的圆形小纸片,放入藤椒挥发油中浸泡24 h,在无菌条件下将其贴在已准备好的各种涂致病菌平板上,每皿3片,等距摆放,每株菌做3次重复,同时用无菌水做对照,37 ℃培养24 h。采用十字交叉法测量DIZ(包括滤纸片直径):用直尺分别测量每个抑菌圈2个垂直方向的直径大小,重复3次,取平均值[6]。
抑菌圈判定标准[1]:DIZ>15 mm为高度敏感,表明试样对该菌具有较好的抑制作用;10~15 mm为中度敏感;8~10 mm为低度敏感;无抑菌圈为不敏感。
1.2.4.2 最小抑菌浓度(minimal inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)的测定
肉汤微量稀释法[12]:由于挥发油易挥发,因而采用试管法。取10支灭菌试管,将菌液稀释到0.5个麦氏浊度,取相应1 000 μL培养液于每支试管中,再依次加入藤椒挥发油0.5、1、2、4、6、8、10、12、14和16 μL。将挥发油配制成一系列梯度浓度的溶液,使得试管中含挥发油体积分数0.05%、0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%和1.6%,放入恒温振荡器中37 ℃培养24 h,观察是否长菌并记录生长情况,如果管底有膜状生成物或试管液体浑浊则为阳性管;管内液体澄清,肉眼见无菌生长则为阴性管,用无菌水作对照。每梯度做3次平行试验,根据试管内液体的浑浊程度判断MIC,最低浓度的阴性管为MIC。
将测出的MIC及相邻浓度的试管中液体,接种到琼脂培养基上,用灭菌涂布棒涂抹均匀,37 ℃培养24 h,观察并记录实验结果,无菌生长的最小浓度即为MBC。重复以上操作3次,取平均值。
1.2.5 藤椒挥发油抑菌机理研究
1.2.5.1 杀菌时间分析
参照DIAO等[13]的方法,由于藤椒挥发油对大肠杆菌、金黄色葡萄球菌、痢疾志贺氏菌具有较高的敏感性,因此这3种细菌被选做后续实验的模式微生物。用1/2 MIC、MIC的藤椒挥发油和0.99%乙醇处理3种受试菌株,监测12 h内的OD值变化。在培养过程中,分别于0、1、2、3、5、7、9和12 h采集8个样品,在600 nm处测定OD值。
1.2.5.2 SEM观察
参照DAKHEEL等[14]的方法,受试菌种在37 ℃的营养肉汤中培养过夜。将藤椒挥发油(对照、MIC)分别加入到悬菌液中。所有细胞悬液分别在37 ℃孵育12 h,4 ℃下5 000 r/min离心7 min,细胞用生理盐水洗涤2~3次,4 ℃固定在体积分数2.5%戊二醛中,2 h后分别用体积分数30%、50%、70%、80%、90%和100%乙醇脱水10 min,然后用叔丁醇代替乙醇。脱水后,用CO2干燥,在离子镀膜机中溅射镀金2 min。用SEM观察细菌细胞的形态。
1.2.6 数据分析
采用SPSS 25.0和Origin 8.0进行数据分析,组间比较采用单因素方差A检验和邓肯检验。统计学意义的截断值设定为P<0.05。
2 结果与分析
2.1 藤椒挥发油成分分析
通过对总离子流图中的各峰经质谱扫描后得到质谱图,经过计算机质谱数据系统检索,结合保留时间及相关文献资料[15],结果见图1和表1。本次从提取的挥发油组分中共鉴定出12种化合物,其中相对含量较高的为芳樟醇(46.43%)、柠檬烯(26.41%)、桧烯(10.84%)、β-蒎烯(1.60%)和大根香叶烯(1.34%)。芳樟醇具有抗龋齿、镇静、抗菌作用,可以用于合成香料、除臭剂、杀虫剂[16]。柠檬烯具有良好的镇咳、祛痰、抑菌作用[17],复方柠檬烯在临床上可用于利胆、溶石、促进消化液分泌和排除肠内积气[18]。此次提取的鲜藤椒果皮中的挥发油成分与赵志峰等[19]的研究大致相同,在藤椒果皮中柠檬烯的含量高于全果,但芳樟醇的含量低于全果且未鉴别出石竹烯成分,由此可推测石竹烯仅存在于藤椒籽中。
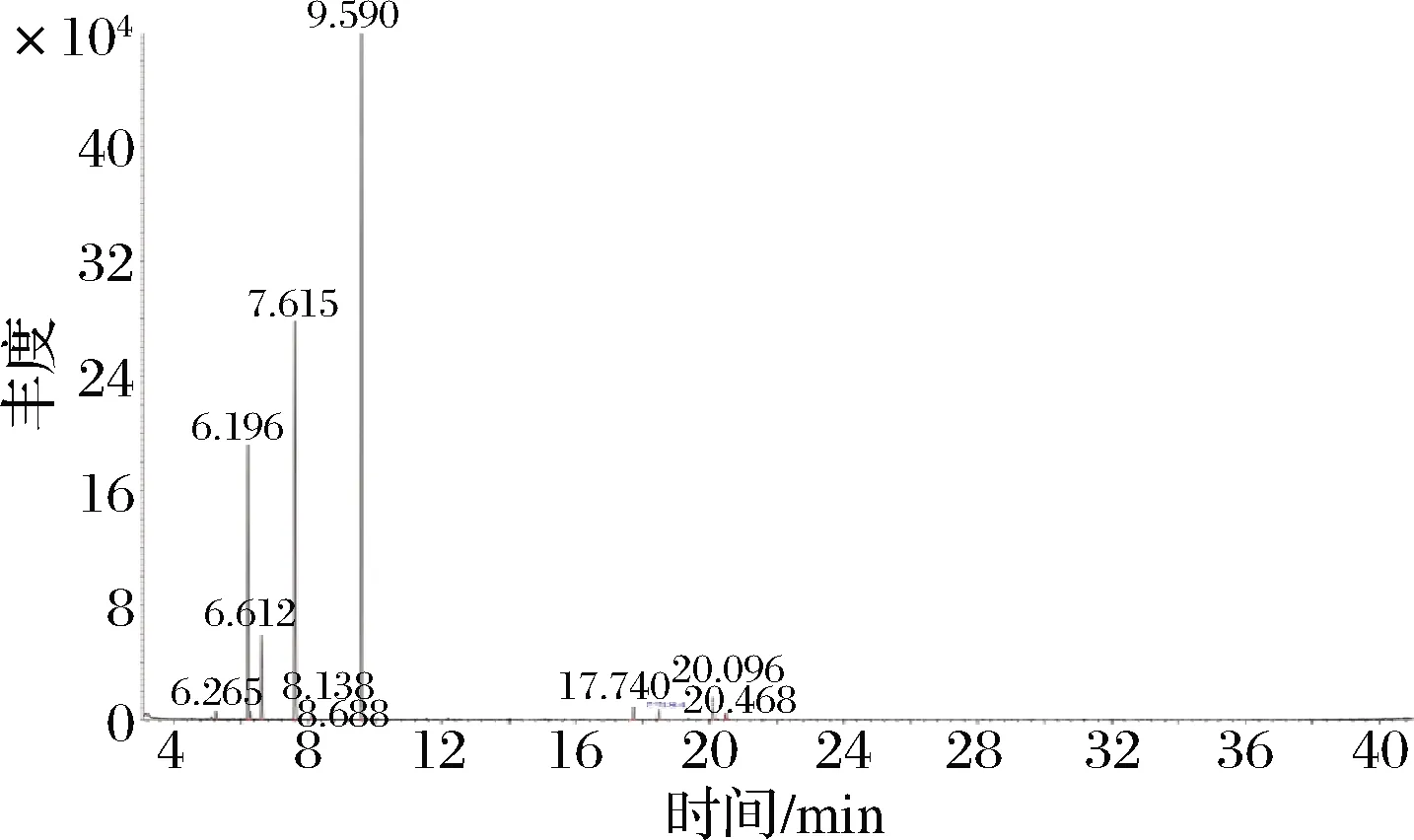
图1 藤椒挥发油总离子流图Fig.1 Total ion chromatogram of volatile oil from Zanthoxylum armatum

表1 藤椒挥发油化学成分
2.2 藤椒挥发油体外抗氧化分析
2.2.1 藤椒挥发油的还原力
一种天然物质清除自由基的能力与其还原能力是密不可分的[20],在Fe2+-Fe3+氧化还原体系中,可以根据其颜色的变化来判断还原程度,反应后吸光度、还原能力和抗氧化性呈正相关[21]。如图2所示,随着维生素C和藤椒挥发油的质量浓度的增加,维生素C、藤椒挥发油的还原力都逐渐增大。其中维生素C的还原效果上升呈斜线趋势,而藤椒挥发油逐渐趋于平行。7 mg/mL的藤椒挥发油的吸光值(OD700=0.329)与0.025 mg/mL的维生素C的吸光值(OD700=0.334)相当。
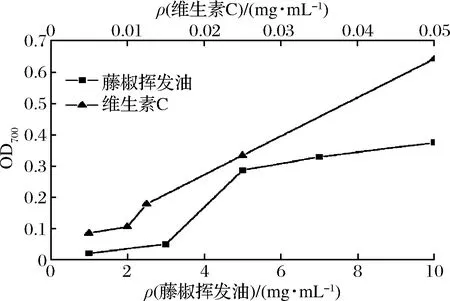
图2 藤椒挥发油的还原力Fig.2 Reducing power of volatile oil
2.2.2 藤椒挥发油清除·OH能力
水杨酸比色法是利用H2O2和Fe2+发生Fenton反应并呈现出相应的颜色,510 nm处是其最大吸收峰。然而,当反应体系中存在·OH清除剂时,会与水杨酸竞争·OH,从而导致吸光度下降[22]。如图3所示,维生素C、藤椒挥发油均表现出良好的·OH清除效果,表现为质量浓度越大,清除效果越好。经计算,维生素C和藤椒挥发油的IC50分别为0.3和18.1 mg/mL。在达到0.6 mg/mL后维生素C对·OH的清除率增加缓慢。试验表明,藤椒挥发油具有一定的·OH清除作用。

图3 藤椒挥发油对·OH的清除能力Fig.3 Scavenging ability of volatile oil on hydroxyl free radicals
2.2.3 藤椒挥发油清除DPPH自由基的能力
DPPH自由基是以氮为中心的很稳定的自由基[23],由于3个苯环的π-π共轭作用和空间障碍使得氮原子上的单个电子无法形成电子对,从而导致DPPH自由基具有较好的稳定性。而其呈现的颜色(紫色)随溶剂(乙醇)的浓度变化而变化,其较强吸收峰在517 nm处。由于溶液中存在的抗氧化物质会使得部分DPPH自由基被清除,导致溶液颜色从紫色变为黄色,吸光值也相应变小。研究表明,吸光度变小的程度与自由基去除程度具有相关性[24]。如图4所示,在0.005~0.05 mg/mL质量浓度内,维生素C对DPPH自由基清除率表现为稳中有升,且在50%及以上。藤椒挥发油对DPPH自由基的清除率表现出微弱的浓度依赖性,经计算得维生素C和藤椒挥发油的IC50分别为0.2和56.3 mg/mL。
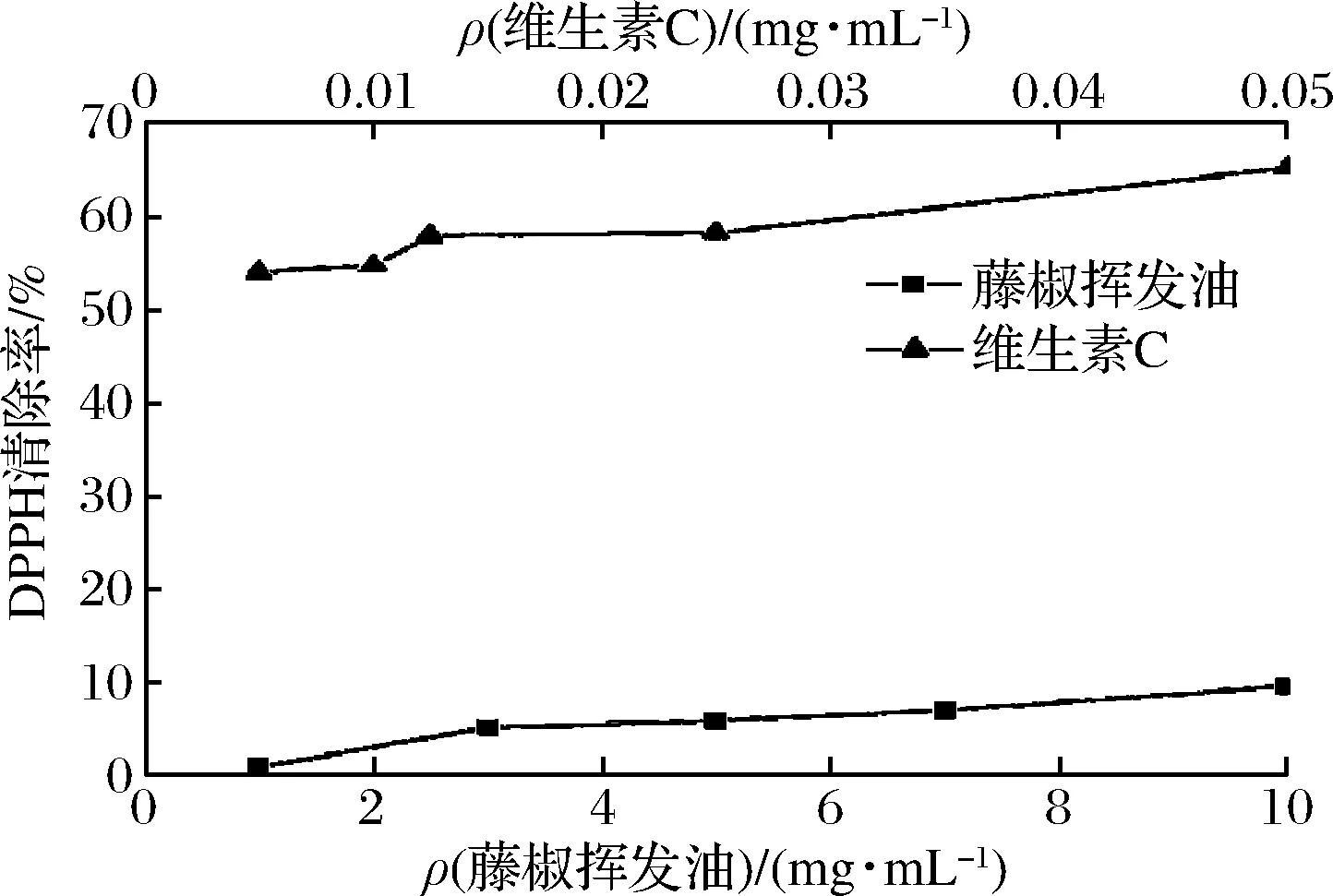
图4 藤椒挥发油对DPPH自由基的清除能力 Fig.4 Scavenging ability of volatile oil on DPPH free radicals
2.2.4 藤椒挥发油清除·O2-能力
实验采用邻苯三酚自氧化法。在碱性环境下,邻苯三酚会发生自动氧化,并且速度很快,生成有色产物和·O2-,·O2-又反过来催化自氧化,中间产物的含量受到·O2-浓度的影响,减少·O2-便可以降低有色产物的含量,并由此测定清除·O2-的能力[25]。如图5所示,维生素C、藤椒挥发油都表现出良好的·O2-清除率。但是随着浓度的增加,维生素C对·O2-的清除率增加的趋势大于藤椒挥发油。通过计算得维生素C和藤椒挥发油的IC50分别为0.4和10.2 mg/mL。试验表明,藤椒挥发油具备较好的·O2-清除效果。

图5 藤椒挥发油对·O2-对清除能力Fig.5 Scavenging ability of volatile oil on superoxide anion free radicals
2.3 藤椒挥发油的抑菌活性分析
2.3.1 藤椒挥发油的DIZ、MIC和MBC测定
藤椒挥发油的DIZ、MIC和MBC如表2所示。藤椒挥发油对大肠杆菌、产气肠杆菌、鼠伤寒沙门氏菌、痢疾志贺氏菌和金黄色葡萄球菌均有不同程度的抑制作用。所有供试菌株的DIZ为9.1~13.5 mm,MIC为0.1%~1%,MBC为0.2%~1%。抑菌效果排序如下:痢疾志贺氏菌>鼠伤寒沙门氏菌>金黄色葡萄球菌>大肠杆菌>产气肠杆菌,即藤椒挥发油对痢疾志贺氏菌抑菌能力最强。而大肠杆菌和金黄色葡萄球菌是革兰氏阴性和革兰氏阳性食源性病菌的代表菌。因此,进一步探讨了对痢疾志贺氏菌、大肠杆菌和金黄色葡萄球菌的抑菌作用机理。

表2 藤椒挥发油对各供试菌种的DIZ、MIC和MBCTable 2 The DIZ, MIC and MBC of the volatile oil on each tested bacteria
2.4 藤椒挥发油的抑菌机理研究
2.4.1 杀菌时间分析
以大肠杆菌、金黄色葡萄球菌和痢疾志贺氏菌为模式菌,通过OD法监测不同浓度的藤椒挥发油对其生长的影响。藤椒挥发油对受试菌在600 nm处的OD值的影响如图6所示。与对照组相比,暴露于藤椒挥发油1/2MIC和MIC的OD值变化不大,菌株数量基本保持不变。相反,随着时间的推移,暴露于0.99%乙醇的对照组菌株的OD值呈上升趋势。可知3种受试菌株的活力丧失具有统计学意义,提示藤椒挥发油是一种天然防腐剂,其杀菌效果与暴露时间和浓度有关。
2.4.2 SEM观察分析
SEM图像显示,藤椒挥发油处理的细菌和未处理的对照细菌的细胞结构存在差异。未处理的细胞完好无损(规则的杆状或球状),表面光滑,如图7-a、图7-b、图7-c所示。以MIC的藤椒挥发油处理的细菌细胞结构发生了相当大的变化,细胞表面粗糙,有凹陷,如图7-d、图7-e、图7-f所示。SEM观察证实,细胞的结构完整性受到了破坏,细菌的形态发生了很大的变化。图7中处理组的大肠杆菌和金黄色葡萄球菌细胞外膜上有气孔,这使得细胞成分很容易通过这些气孔溢出,也导致了细胞的凹陷。由于气孔的形成,细菌的外膜或细胞壁最有可能成为藤椒挥发油的细胞靶标。此外,不同细菌种类间细胞壁组成的差异解释了它们对藤椒挥发油的不同敏感性。试验结果表明,藤椒挥发油的抑菌作用可能是通过破坏细菌细胞膜或细胞壁,从而使细胞内成分外漏。

a-大肠杆菌;b-金黄色葡萄球菌;c-痢疾志贺氏菌图6 藤椒挥发油在37 ℃营养培养液中对大肠杆菌、金黄色葡萄球菌和痢疾志贺氏菌生长的影响Fig.6 Effects of volatile oil on the growth of E. coli, S. aureus and S. castellani in 37 ℃ nutrient culture medium

a-大肠杆菌对照组;b-金黄色葡萄球菌对照组; c-痢疾志贺氏菌对照组;d-大肠杆菌MBC组; e-金黄色葡萄球菌MBC组; f-痢疾志贺氏菌MBC组图7 大肠杆菌、金黄色葡萄球菌和痢疾志贺氏菌 细胞表面形态的变化Fig.7 Changes of cell surface morphology of E. coli, S. aureus and S. castellani 注:使用扫描电子显微镜(×20 000)进行观察。对照组代表 未经挥发油处理,MBC组代表经藤椒挥发油处理6 h
3 结论
利用GC-MS进行分析,藤椒挥发油组分中共鉴定出12种化合物,由芳樟醇(46.43%)、柠檬烯(26.41%)、桧烯(10.84%)、β-蒎烯(1.60%)、大根香叶烯(1.34%)等组成。体外抗氧化试验结果表明,藤椒挥发油具备一定的抗氧化能力,且其抗氧化能力总体上是随浓度的增加而增强,对·OH、DPPH自由基、·O2-清除率也随浓度的增加而增大。抑菌实验表明,水提藤椒挥发油对痢疾志贺氏菌、鼠伤寒沙门氏菌、金黄色葡萄球菌、大肠杆菌和产气肠杆菌均有不同程度的抑制作用,其中,对痢疾志贺氏菌的抑制作用最好,对产气肠杆菌的抑制作用最弱。抑菌机理可能是通过破坏细菌的细胞膜和细胞壁通透性,进而导致胞内成分外泄。
综上,藤椒挥发油拥有良好的抗氧化和抑菌能力并包含多种功效性组分,可作为一种多功效型食品添加剂应用到食品行业,为天然抗氧化剂、天然生物防腐剂的研究提供线索,为藤椒的综合利用以及深加工产物的开辟提供参考。

